敲低MANF对利福平诱导HepG2细胞损伤的影响及机制
2021-11-09张卫平许建明
戴 琼,张卫平,陈 刚,王 鹏,许建明,梅 俏
抗结核药物诱导肝脏产生适应性反应是药物性肝损伤领域研究的热点。课题组前期的体外研究发现未折叠蛋白反应(unfolded protein response,UPR)中的PERK通路介导了利福平(rifampicin,RFP)诱导的适应性反应,同时发现分泌型蛋白中脑星型胶质细胞源性神经生长因子(mesencephalic astrocyte-derived neurotrophic factor,MANF)的表达也发生了改变。UPR由PERK、IRE1和ATF6 3条信号通路组成。有研究报道UPR 3条通路的靶蛋白分子可以调节MANF的表达,过表达ATF6后MANF表达增加,XBP1可以增加MANF的表达。但是MANF对UPR 3条通路是否具有反馈调节作用以使UPR维持在合适的强度未见文献报道。该研究通过分子生物学技术敲低HepG2细胞的MANF基因,观察敲低MANF对RFP诱导HepG2细胞损伤及UPR相关基因表达的影响,探讨其细胞保护作用的分子机制。
1 材料与方法
1.1 主要材料
携带MANF敲低序列的慢病毒以及空白慢病毒购自和元生物技术(上海)股份有限公司;DMEM高糖细胞培养液购自美国Hyclone公司;胰酶消化酶、胎牛血清购自美国Gibco公司;PVDF膜购自Millipore公司;蛋白Marker、ECL显影液购自Thermo scientific公司;MANF、非剪接型X-盒结合蛋白1(non-spliced X-box binding protein 1-U, XBP1-U)抗体购自美国Abcam公司;葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)、蛋白酶R样内质网激酶(protein kinase R-like ER kinase, PERK)、p-PERK、真核翻译启动因子2α(eukaryotic translation initiation factor 2α, eIF2α)、p-eIF2α、活化转录因子4(activating transcription factor 4, ATF4)、CCAAT/增强子结合蛋白(C/EBP-homologous protein, CHOP)、Tribbles同源蛋白3(Tribbles homolog 3, TRIB3)、肌醇需求激酶1(inositol-requiring enzyme 1, IRE1)、p-IRE1、剪接型X-盒结合蛋白1(spliced X-box binding protein1-S, XBP1-S)、活化转录因子6(activating transcription factor 6, ATF6)抗体购自美国CST公司;TRIzol购自美国Thermo公司;逆转录试剂盒和PCR扩增试剂盒购自日本TaKaRa公司;GRP78、PERK、eIF2α、ATF4、CHOP、TRIB3、IRE1、XBP1-S、XBP1-U、ATF6引物购自生工生物工程(上海)股份有限公司;RFP(R3501)、DMSO购于美国Sigma公司;谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, AKP)、总胆红素(total bilirubin, TBIL)测定试剂盒购自南京建成生物工程研究所;人间接胆红素(indirect bilirubin, IBIL) ELISA试剂盒购于上海易利生物科技有限公司;青霉素/链霉素、BCA蛋白测定试剂盒、GAPDH抗体、二抗、CCK-8试剂盒购自上海碧云天公司;PE Annexin V凋亡检测试剂盒购自上海贝博生物公司;细胞培养板购于美国TrueLine公司;酶标仪购自美国PE公司(Enspire);流式细胞仪购于美国贝克曼公司(CytoFLEX)。1.2 细胞分组及其培养
HepG2细胞购自中国科学院上海分院细胞库;利用慢病毒转染技术构建MANF敲低稳转细胞株(MANF Y25)及其对照细胞株(MANF Y07),实验分成4组:MANF Y07+DMSO组、MANF Y07+RFP组、MANF Y25+DMSO组、MANF Y25+RFP组。用含10%胎牛血清、1%青霉素/链霉素的DMEM高糖培养基培养。在含5% CO、37 ℃的培养箱中培养,每天半量换液,取对数生长期的细胞用于实验。细胞转染时采用不含血清及双抗的DMEM高糖培养基培养。1.3 慢病毒构建及转染
将生长至对数生长期的目的细胞胰酶消化后,以每孔5×10个细胞的密度均匀铺在12孔板上,当细胞生长至汇合度30%~40%时感染慢病毒,同时将培养基更换成不含血清和双抗的DMEM高糖培养基,培养8~12 h后,更换成含10%胎牛血清的DMEM高糖培养基培养,48~72 h后用嘌呤霉素筛选阳性克隆细胞2周左右。1.4 Western blot检测蛋白表达水平
将生长至对数生长期的MANF Y07、MANF Y25细胞胰酶消化后,以每孔2.0×10个细胞的密度均匀接种在6孔板上,当细胞生长至汇合度达到70%~80%时,加入100 μmol/L RFP诱导24 h,然后收集各组细胞。用蛋白提取试剂盒提取蛋白,用BCA蛋白测定试剂盒进行蛋白定量,上样后于SDS-PAGE凝胶上进行电泳、分离,再转入PVDF膜上转膜,5%脱脂奶粉TBST溶液室温封闭1 h,再分别加入GAPDH(1 ∶5 000)、MANF、GRP78、p-PERK、PERK、p-eIF2α、eIF2α、ATF4、CHOP、TRIB3、p-IRE1、IRE1、XBP1-S、XBP1-U、ATF6抗体(1 ∶1 000),4 ℃孵育过夜。次日PVDF膜恢复室温后用TBST洗膜5次,每次8 min,分别加入二抗(1 ∶5 000),于室温下孵育1 h,再次用TBST洗膜5次,每次8 min,最后加ECL显影液显影。GAPDH作为内参,采用Image J软件分析结果。蛋白表达水平以与内参比值的平均灰度表示。1.5 实时荧光定量PCR(qRT-PCR)检测MANF及UPR相关基因表达水平
收集100 μmol/L RFP处理后的各组细胞,用TRIzol提取各组细胞中的总RNA。根据逆转录试剂盒的操作说明将RNA逆转录成cDNA,逆转录条件:37 ℃,15 min(逆转录反应),85 ℃,5 s(逆转录酶失活),4 ℃,然后用PCR扩增试剂盒扩增PCR。扩增条件:变性 95 ℃ 5 s,退火 60 ℃ 30 s,延伸 60 ℃ 30 s,共40个循环。读取每个反应的Ct值,以2表示基因相对表达量。所用qRT-PCR引物序列见表1。
表1 qRT-PCR引物序列
1.6 Annexin V-PE/7-AAD双染法检测细胞凋亡率
将生长至对数生长期的MANF Y07、MANF Y25细胞胰酶消化后,以每孔2.0×10个细胞的密度均匀接种在6孔板上,当细胞生长至汇合度达到70%~80%时,加入100 μmol/L RFP诱导24 h,然后收集各组细胞。预冷的PBS洗涤细胞2次,结合缓冲液重悬细胞,再加入5 μl Annexin V-PE 和 7-AAD避光孵育15 min,最后加入200 μl结合缓冲液,1 h内流式细胞仪检测。1.7 CCK-8法检测细胞增殖
取对数生长期的MANF Y07、MANF Y25细胞胰酶消化后,以每孔2.5×10个细胞的密度均匀接种在96孔板上,边缘孔用无菌PBS填充。当细胞生长至汇合度达到70%~80%时,加入100 μmol/L RFP诱导24 h后,每个孔中分别加入10 μl CCK-8溶液和90 μl的纯DMEM培养液,轻轻敲击培养板,使两者充分混匀,于37 ℃培养箱中避光孵育1~4 h。使用酶标仪测定450 nm波长处的吸光度(optical density,OD)值。1.8 细胞培养上清液中细胞损伤标志物相对含量检测
收集各组细胞培养上清液(约2 ml),以3 000 r/min离心10 min。立即测定上清液或储存在-80 ℃冰箱以备用,注意避免反复冻融以及含有RFP的样本注意避光保存。分别根据ALT、AST、AKP、TBIL、IBIL检测试剂盒的操作说明,设定标准孔、样品孔、对照孔和空白孔,将各组样品与试剂盒里的试剂按照要求加到标准孔、样品孔、对照孔和空白孔中,轻轻敲击96孔板,使之充分混匀,于37 ℃培养箱中避光孵育一定时间,最后根据各自所要求的波长,用酶标仪测定各组细胞培养上清液所对应的吸光度,根据计算公式或者标准曲线得出各组细胞损伤标志物(ALT、AST、AKP、TBIL、IBIL)的相对含量。
2 结果
2.1 MANF在HepG2稳转细胞株中的表达及敲低MANF对GRP78表达的影响
MANF基因敲低效率通过Western blot和qRT-PCR检测。与对照细胞株(MANF Y07)相比,在MANF敲低稳转细胞株(MANF Y25)中,MANF蛋白表达减少了约40%(F
=18.44,P
<0.05),MANF 基因表达减少了约90%(F
=1 067.41,P
<0.01),见图1,表明MANF敲低稳转细胞株构建成功。100 μmol/L RFP给药24 h后可增加MANF的蛋白及基因表达(P
<0.01)。本研究首先观察了RFP处理的HepG2细胞中GRP78蛋白及基因表达的变化。Western blot和qRT-PCR分析均表明,RFP处理可上调GRP78蛋白及基因的表达(P
<0.05,P
<0.01),见图2。MANF敲低前后对比发现,敲低后GRP78蛋白(F
=15.12,P
<0.05)及基因(F
=359.32,P
<0.01)表达水平进一步升高,表明RFP可以激活GRP78,而在敲低MANF后这种激活效应进一步加强。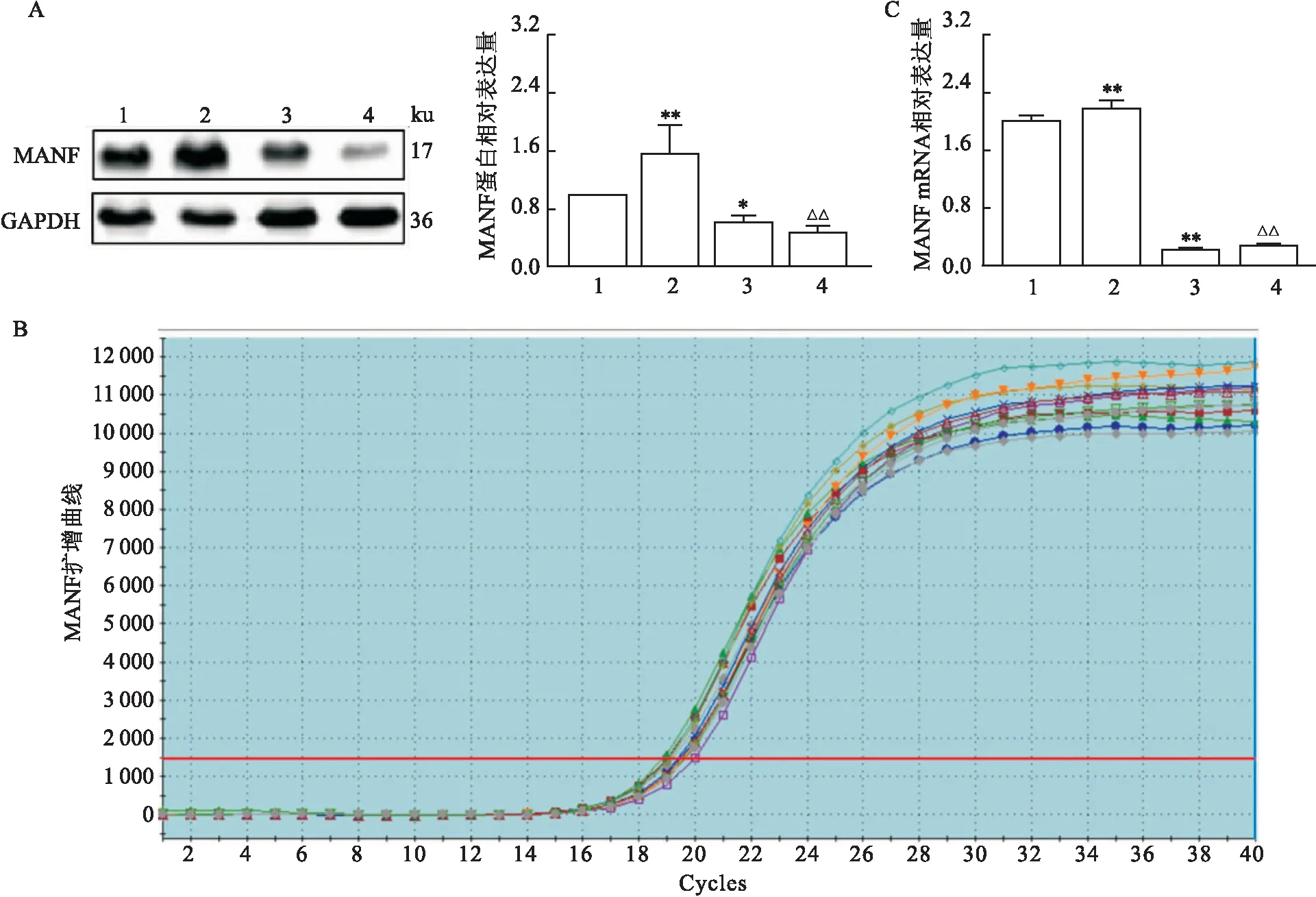
图1 MANF在HepG2稳转细胞株中的表达A:各组MANF蛋白表达水平;B:MANF的扩增曲线;C:各组MANF基因表达水平;1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:*P<0.05,**P<0.01;与MANF Y07+RFP组比较: △△P<0.01

图2 敲低MANF对GRP78表达的影响A:各组GRP78蛋白表达水平;B:GRP78的扩增曲线;C:各组GRP78基因表达水平;1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:*P<0.05,**P<0.01;与MANF Y25+RFP组比较:##P<0.01;与MANF Y07+RFP组比较:△P<0.05,△△P<0.01
2.2 MANF敲低对HepG2细胞UPR 3条信号通路的影响
2
.2
.1
MANF敲低对HepG2细胞PERK-ATF4-CHOP信号通路的影响 用RFP处理HepG2细胞24 h后,结果如图3所示,在MANF敲低前,RFP可以诱导p-eIF2α/eIF2α、ATF4的蛋白表达(P
<0.01)以及PERK(P
<0.05)、eIF2α(P
<0.01)、ATF4(P
<0.01)、CHOP(P
<0.05)、TRIB3(P
<0.01)基因表达,MANF基因敲低后发现p-PERK/PERK(F
=349.3,P
<0.01)、p-eIF2α/eIF2α(F
=626.0,P
<0.01)、ATF4(F
=87.38,P
<0.01)的蛋白表达水平进一步升高,同时发现PERK(F
=121.50,P
<0.01)、eIF2α(F
=49.02,P
<0.01)、ATF4(F
=48.96,P
<0.01)、CHOP(F
=92.99,P
<0.01)、TRIB3(F
=35.14,P
<0.01)的基因表达水平也进一步升高。说明RFP可以激活PERK-ATF4-CHOP信号通路,在敲低MANF后这种激活效应进一步加强。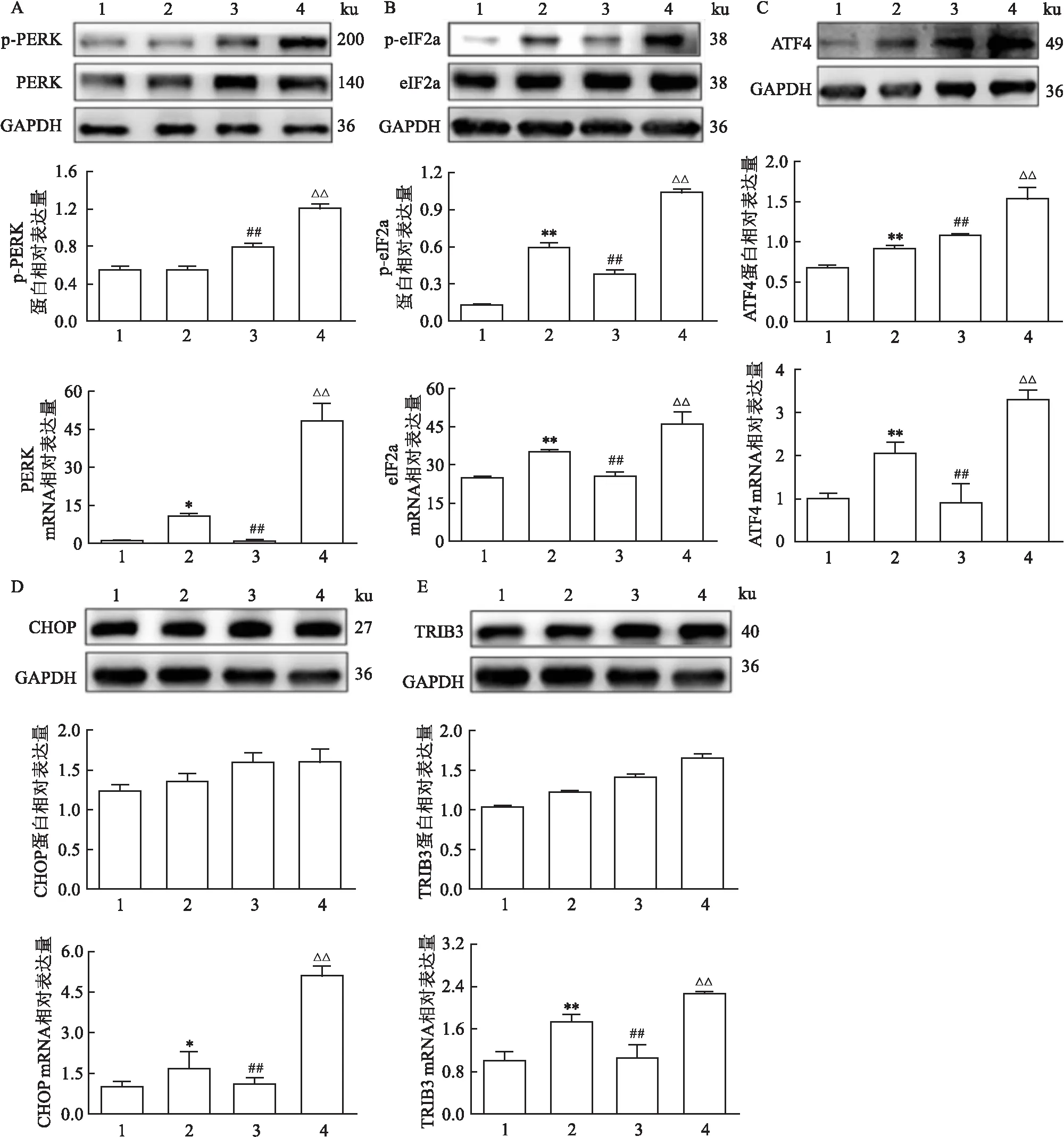
图3 MANF敲低对HepG2细胞PERK-ATF4-CHOP信号通路的影响A-E:各组PERK、eIF2α、ATF4、CHOP、TRIB3蛋白和基因表达水平;1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:*P<0.05,**P<0.01;与MANF Y25+RFP组比较:##P<0.01;与MANF Y07+RFP组比较:△△P<0.01
2
.2
.2
MANF敲低对HepG2细胞IRE1-XBP1信号通路的影响 如图4所示,MANF敲低前后对比发现,MANF敲低后RFP诱导IRE1(F
=56.04,P
<0.01)、XBP1-S/XBP1-U(F
=40.38,P
<0.01)基因表达水平升高,表明RFP可以激活IRE1-XBP1信号通路,在敲低MANF后这种激活效应进一步加强。
图4 MANF敲低对HepG2细胞IRE1-XBP1信号通路的影响A、B:各组IRE1、XBP1-S、XBP1-U蛋白和基因表达水平;1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:**P<0.01;与MANF Y25+RFP组比较:#P<0.05,##P<0.01;与MANF Y07+RFP组比较:△△P<0.01
2
.2
.3
MANF敲低后对ATF6信号通路的影响 如图5所示,在MANF敲低前,RFP诱导ATF6蛋白的表达,MANF基因敲低后发现ATF6的蛋白(F
=364.7,P
<0.01)和基因(F
=29.90,P
<0.01)表达
图5 MANF敲低后对ATF6蛋白和基因表达的影响1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:**P<0.01;与MANF Y25+RFP组比较:#P<0.05,##P<0.01:与MANF Y07+RFP组比较:△△P<0.01
水平均进一步升高。说明RFP可以激活ATF6信号通路,在敲低MANF后这种激活效应进一步加强。
2.3 MANF敲低后对HepG2细胞损伤的影响
Annexin V-PE/7-AAD双染法结果显示:与MANF Y07+RFP组(11.64±0.99)%比较,MANF Y25+RFP组(16.48±1.14)%细胞凋亡率升高(F
=35.80,P
<0.01),见图6A;CCK-8检测结果显示:MANF Y25+RFP组(1.96±0.08)细胞OD值较MANF Y07+RFP组(2.29±0.04)降低(F
=56.59,P
<0.01),见图6B;细胞培养上清液结果显示:与MANF Y07+RFP组[(12.87±0.85)、(4.27±0.17)、(2.08±0.02)、(11.53±0.64)、(2.77±0.53)U/L]比较,MANF Y25+RFP组[(29.81±0.85)、(6.58±0.93)、(2.43±0.05)、(15.49±0.59)、(5.97±0.53)U/L]细胞培养上清液中的细胞损伤标志物ALT(F
=27.97,P
<0.01)、AST(F
=14.41,P
<0.05)、AKP(F
=46.17,P
<0.01)、TBIL(F
=378.58,P
<0.01)、IBIL(F
=32.71,P
<0.01)均升高,见图6C-6G。表明MANF敲低后加重了RFP诱导的HepG2细胞损伤。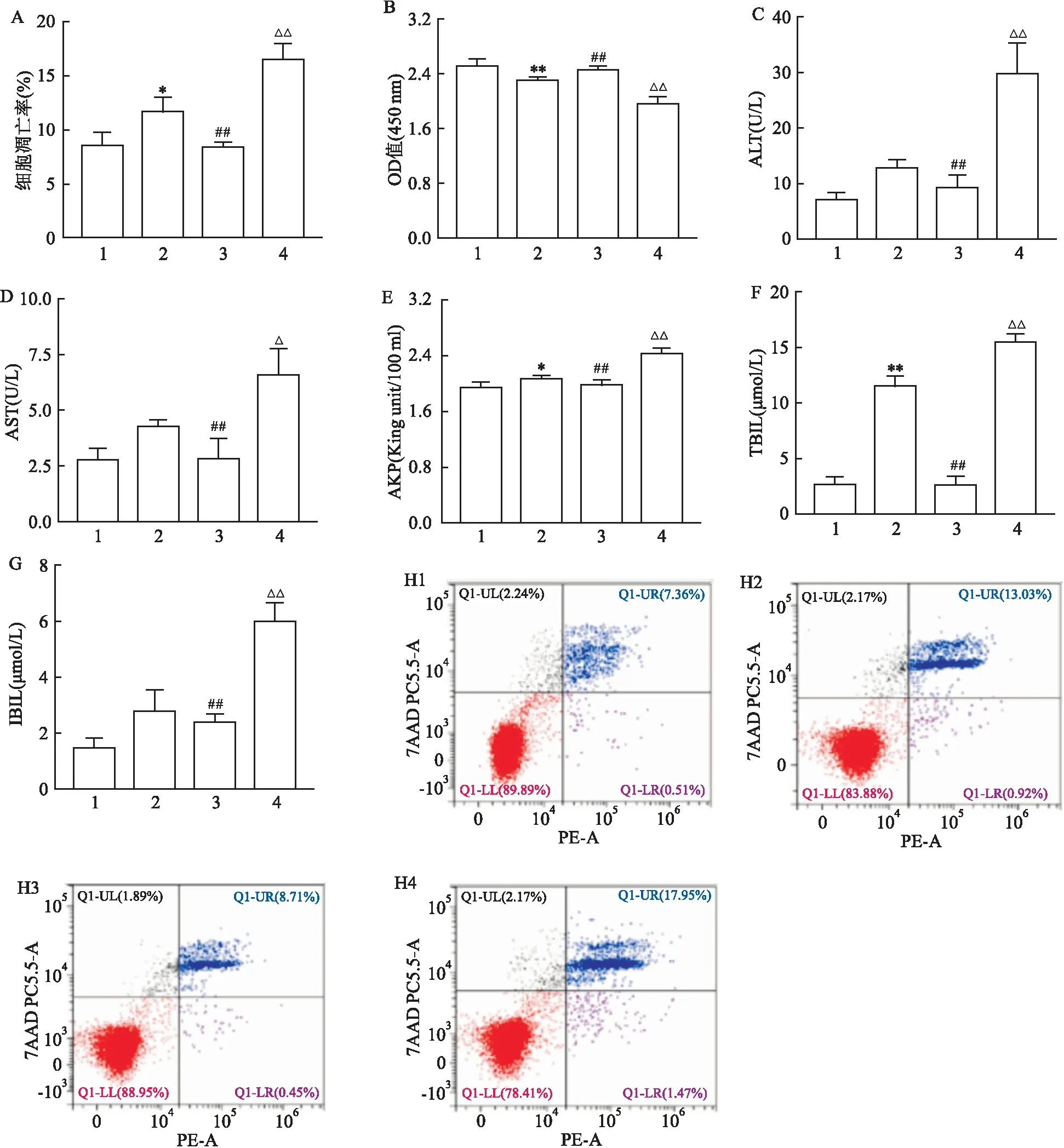
图6 MANF敲低后对HepG2细胞损伤的影响A:MANF敲低后对HepG2细胞凋亡的影响;B:MANF敲低后对HepG2细胞增殖的影响;C-G:MANF敲低后各组细胞培养上清液中细胞损伤标志物ALT、AST、AKP、TBIL、IBIL的变化;H:各组HepG2细胞凋亡的流式图;1:MANF Y07+DMSO组;2:MANF Y07+RFP组;3:MANF Y25+DMSO组;4:MANF Y25+RFP组;与MANF Y07+DMSO组比较:*P<0.05,**P<0.01;与MANF Y25+RFP组比较:##P<0.01;与MANF Y07+RFP组比较:△P<0.05,△△P<0.01
3 讨论
当机体在毒性药物、感染、低氧、氧应激等条件诱导下,内质网中未折叠或错误折叠的蛋白质聚集导致内质网应激(endoplasmic reticulum stress,ERS)。ERS可以触发适应性保护机制-UPR,旨在清除未折叠或错误折叠的蛋白质来恢复内质网平衡。内质网伴侣蛋白GRP78,是内质网稳态的主要调节因子,对于ERS的启动非常重要。在非应激条件下,GRP78与跨膜应激传感器PERK、IRE1和ATF6结合;在应激条件下,错误折叠的蛋白质与这些传感器竞争与GRP78结合,释放PERK、IRE1和ATF6应激传感器以激活UPR。随着ERS时间的延长,PERK多聚化并激活eIF2α磷酸化,促进ATF4的翻译,从而激活包括CHOP和TRIB3在内的特异性UPR靶基因的转录诱导细胞凋亡。持续应激下,IRE1可以通过激活c-jun氨基末端激酶(JNK)通路和招募凋亡信号调节激酶(ASK1)来触发细胞凋亡。ATF6是UPR的关键调节因子,既可以通过诱导CHOP的表达,驱动细胞凋亡机制;也可以通过调节ERS期间的蛋白质折叠能力促进细胞存活。本研究结果提示RFP可以激活GRP78以及PERK-ATF4-CHOP、IRE1-XBP1、ATF6 3条UPR信号通路,并且MANF敲低后,上述激活效应进一步加强,同时细胞损伤加重。这说明MANF可能通过调节UPR,恢复内质网稳态,来发挥细胞保护作用。有文献报道MANF可以通过抑制ERS的凋亡信号通路来介导细胞保护作用,本研究结果与之一致。
MANF是ERS最敏感的基因,具有独特的三维结构,N端saposin样结构域和C端SAP(SAF-A/B,Acinus and PIAS,SAP)结构域,MANF的C末端与Ku70的SAP结构域同源,Ku70是促凋亡Bax蛋白的抑制剂,发挥抗细胞凋亡的作用,因此推测MANF的SAP结构域与其抗凋亡作用有关。遇到炎症和ERS时,MANF通过C端SAP结构域与核因子-κB(NF-κB)p65亚基的DNA结合结构域相互作用而负调控NF-κB通路,从而起到抑制炎症反应的作用。本次体外研究显示:RFP可以诱导MANF的蛋白及基因表达;敲低MANF后,HepG2细胞凋亡率升高,细胞增殖能力降低。此研究结果可以证明ERS增加了MANF的表达和分泌以及MANF在RFP诱导HepG2细胞损伤中发挥细胞保护作用,这可能和MANF有抗细胞凋亡与抑制炎症反应作用有关。Yang et al研究发现:MANF基因缺失激活了ATF4/CHOP和JNK/c-JUN/CHOP信号通路,并且加重了肝缺血再灌注诱导的肝损伤,本研究得出的结论与之基本一致。
ALT、AST、AKP、TBIL、IBIL是临床上反映肝功能状态的重要指标,细胞培养上清液中ALT、AST、AKP、TBIL、IBIL的含量与细胞损伤程度密切相关。本研究观察到RFP可以诱导细胞培养上清液中细胞损伤标志物ALT、AST、AKP、TBIL、IBIL水平升高,并且MANF敲低后这些指标进一步升高,间接说明敲低MANF加重了RFP对HepG2细胞的损伤。与敲低MANF升高了HepG2细胞凋亡率及降低了细胞增殖能力这些结果相结合,可以进一步说明MANF有细胞保护作用。
