流式淋巴细胞亚群检测在癌症中的临床应用价值及意义
2021-11-08金昊


摘要:目的:研究肿瘤患者外周血中淋巴细胞亚群的各项指标和肿瘤患者临床信息及预后的相关性。方法:选取肺癌、宫颈癌和乳腺癌患者共134例,收集肿瘤患者外周血并用流式细胞术检测和分析外周血中淋巴细胞亚群7项指标,同时收集肿瘤患者的临床信息,分析两者是否具有相关性。结果:研究发现肺癌及宫颈癌患者外周血中淋巴细胞亚群7项指标,其中CD8阳性T细胞绝对数及CD4/CD8比值同患者的临床分期、淋巴结转移和远处转移相关。结论:本研究发现肺癌和宫颈癌早中期患者外周血中CD8阳性T细胞的数量较晚期患者明显增多,提示肿瘤患者外周血中CD8阳性T细胞的数量同患者的预后相关。
关键词:淋巴细胞亚群,流式细胞术,细胞毒性T细胞
【中图分类号】R4 【文献标识码】A 【文章编号】2107-2306(2021)09--04
由于全球人口的增长和老龄化,以及吸烟、不良饮食和久坐等生活方式导致癌症患者数量越来越多,全球癌症负担持续增加[1]。肿瘤免疫学研究表明,癌症的发生、发展与机体的免疫状态密切相关[2, 3]。其中T淋巴细胞是细胞免疫的主要应答形式,在机體抗肿瘤免疫中起主导作用,能够识别和清除肿瘤细胞[4, 5]。流式淋巴细胞亚群作为一种常规检查,是反映细胞免疫功能的重要指标,在肿瘤免疫监测具有重要意义,进一步为患者的临床治疗方案提供参考依据[6, 7]。本研究通过分析患者外周血中CD3阳性T淋巴细胞,CD4阳性T淋巴细胞,CD8阳性T淋巴细胞,B淋巴细胞和NK细胞占淋巴细胞的比例及绝对数,并将这些指标相结合,从而评估机体的免疫功能状态。
1.材料与方法
1.1材料
采集天津市肿瘤医院空港医院放疗科住院患者EDTA抗凝外周血2ml。所有患者采血前均未接受过肿瘤治疗,并且具有完整的临床相关资料。
1.2实验方法
取100ul外周血样本加入流式管中,标记CD3/CD19/CD16+CD56/CD45和CD3/CD4/CD8/CD45抗体(Beckman Coulter公司),室温孵育15分钟,加入500ul溶血素(Beckman Coulter公司),室温静置10分钟,PBS洗涤细胞后上机。流式数据用Kaluza软件(Beckman Coulter公司)进行分析。
1.3统计学方法
应用SPSS statistics 21软件进行统计学分析。当样本数据符合正态分布时,独立样本之间采用t检验或者单因素分析检验的统计学方法;当样本数据不符合正态分布时,样本之间采用非参数t检验和Kruskal-Wallis检验的统计学方法。P<0.05为差异具有统计学意义。
2.结果
2.1外周血中淋巴细胞亚群同预后相关
本研究中共收集肺癌32例,乳腺癌59例,宫颈癌43例。其中乳腺癌均为确定将接受手术患者,而肺癌和宫颈癌都未接受手术治疗。因此从癌种和治疗方式进行评估,乳腺癌较肺癌和宫颈癌具有更好的预后。本研究共收集患者外周血中CD3阳性T细胞、CD4阳性T细胞和CD8阳性T细胞占淋巴细胞百分比和绝对值6项指标,加上CD4/CD8比值共7项指标进行数据分析,结果如图1所示。三个癌种间,CD3阳性T细胞和CD4阳性T细胞的绝对数都相近,无统计学差异(图1A和图1B);但是肺癌和宫颈癌患者外周血中CD8阳性T细胞的绝对数明显较乳腺癌患者降低(图1C,P值分别为0.0080**和0.0003***)。而当分析三种淋巴细胞亚群在外周血中占淋巴细胞百分比时,我们发现CD4阳性T细胞占淋巴细胞百分比在三个癌种之间无差异(图1E),而乳腺癌患者外周血中CD3阳性T细胞和CD8阳性T细胞占淋巴细胞百分比高于肺癌和宫颈癌患者(图1D和1F)。由于肺癌和宫颈癌较乳腺癌是更为开放性肿瘤,因此其他淋巴细胞比如NK细胞数量较乳腺癌会增加,这就导致CD3阳性T细胞比例在乳腺癌中会升高,但是CD3阳性T细胞绝对数并没有差异,这也从侧面反应了淋巴细胞亚群的绝对数较其占淋巴细胞百分比是更好的参考指标。此外乳腺癌患者CD8阳性T细胞占淋巴细胞百分比较肺癌和宫颈癌患者高,也再次证实了乳腺癌患者具有更多数量的CD8阳性T细胞。更为直观的CD4/CD8比值指标显示,乳腺癌患者的CD4/CD8比值低于肺癌和宫颈癌患者(图1G)。因此我们认为在预后较好的乳腺癌患者人群中,其CD8阳性T细胞绝对数明显高于预后较差的肺癌和宫颈癌患者,同时乳腺癌患者的CD4/CD8比值低于肺癌和宫颈癌患者。
A. 三种癌症患者外周血中CD3阳性T细胞绝对数的相互比较;B. CD4阳性T细胞绝对数的相互比较;C. CD8阳性T细胞绝对数的相互比较;D. CD3阳性T细胞占淋巴细胞百分比的相互比较;E. CD4阳性T细胞占淋巴细胞百分比的相互比较;F. CD8阳性T细胞占淋巴细胞百分比的相互比较;G. CD4/CD8比值的相互比较
上述结果提示通过检测癌症患者外周血样本的淋巴细胞亚群,CD8阳性T细胞绝对数较高的患者具有更好的预后。此外CD4/CD8比值较低的患者也具有较好的预后,也再次证实这类患者的CD8阳性T细胞数量较多。为了再次验证我们的结论,本研究分别将肺癌和宫颈癌患者的外周血淋巴细胞亚群的7项指标同患者的临床信息相结合分析,进行深入的研究探索。
2.2肺癌患者外周血淋巴细胞亚群同其临床信息的相关性分析
共收集肺癌患者32例,其中男性24例,女性8例,年龄分布37-78岁。其中肺鳞癌8例,肺腺癌9例,其它病理类型的肺癌15例,多为中晚期患者。由于早期患者较少,因此本研究将临床分期进行N分期和M分期单独分析。
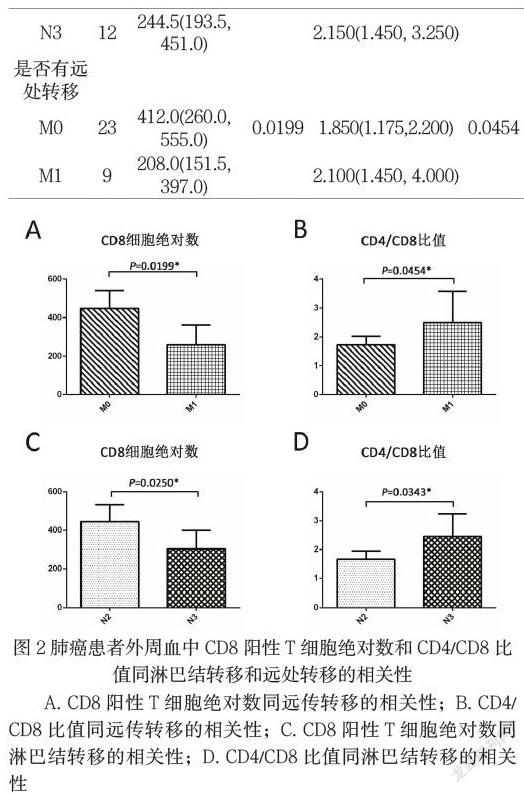
我们将这7项指标分别与患者的性别,年龄,病理类型,淋巴结转移和远处转移进行分析。结果显示其中CD3阳性T细胞和CD4阳性T细胞占淋巴细胞百分比和绝对数与患者的所有临床信息都无统计学差异,没有相关性。而CD8阳性T细胞绝对数与患者临床信息相关性如图2表1所示。其中淋巴结转移定义为N3的患者其外周血样本中CD8阳性T细胞绝对数同样明显低于N2患者(如图2C所示);有远处转移的患者其CD8阳性T细胞的绝对数也明显低于无转移的患者(图2A所示)。这部分结果与2.1的结果相一致,我们证实了肺癌早中期患者外周血中CD8阳性T细胞绝对数要明显高于肺癌晚期患者,提示外周血中CD8阳性T细胞绝对数是预后相关的指标之一,具有较高CD8阳性T细胞的患者可能具有更好的预后。
A. CD8阳性T细胞绝对数同远传转移的相关性;B. CD4/CD8比值同远传转移的相关性;C. CD8阳性T细胞绝对数同淋巴结转移的相关性;D. CD4/CD8比值同淋巴结转移的相关性
同时我们也分析肺癌患者外周血中CD8阳性T细胞占淋巴细胞百分比与患者临床信息的相关性,发现无任何统计学差异。提示对于肿瘤患者外周血中淋巴细胞亚群指标,淋巴细胞及其亚群的绝对数较亚群占淋巴细胞百分比是更为优秀及能够正确反应患者免疫功能状态的指标。
与CD8阳性T细胞指标一样,CD4/CD8也同肺癌患者的淋巴结转移和远处转移具有相关性,具有对侧淋巴结及远处转移的肺癌患者具有更高的CD4/CD8比值,如图2B和图2D及表1所示。
通过上述结果,我们证实了肺癌患者外周血中CD8阳性T细胞的绝对数与患者的肿瘤进展具有相关性,晚期患者其CD8阳性T细胞较少,自身的免疫功能较弱,更有利于肿瘤发生发展及转移,同时也具有更差的预后。那与CD8阳性T细胞绝对数该指标相关联的指标CD4/CD8比值也能够从另一个侧面反应肺癌患者的免疫功能状态,提示预后。两者相结合从而给临床一个重要的信息,方便患者的后续治疗。
2.3宫颈癌患者外周血淋巴细胞亚群同其临床信息的相关性分析
为了进一步验证我们上述的结论,我们再次收集宫颈癌患者43例,年龄分布25-69岁,病理类型都为鳞癌。根据TNM分期,本研究分别将患者外周血中淋巴细胞亚群的指标与患者临床信息进行分析。
结果显示其中CD3阳性T细胞和CD4阳性T细胞占淋巴细胞百分比和绝对数与患者的所有临床信息都无统计学差异,没有相关性,CD8阳性T细胞占淋巴细胞百分比与患者的临床信息同样无统计学差异。宫颈癌患者外周血中淋巴细胞亚群指标CD8阳性T细胞绝对数及CD4/CD8比值则同宫颈癌患者的临床T分期,淋巴结转移和远处转移相关,如图3表2所示。有淋巴结转移和远处转移的宫颈癌患者其外周血中CD8阳性T细胞的数量较没有淋巴结和远处转移的患者要少(图3A和3C),同时CD4/CD8比值明显升高(图3B和3D)。根据单因素分析我们发现宫颈癌患者外周血中CD4/CD8比值同T分期具有相关性,但是CD8阳性T细胞的绝对数则和T分期无统计学差异(表2)。进一步分析T1-T4期宫颈癌患者外周血中CD8阳性T细胞绝对数和CD4/CD8比值同T分期的相关性,我们发现T4期宫颈癌患者外周血中CD8阳性T细胞数量要少于T3期(如图3E所示,有统计学差异)和T1-T2期(如图3E所示,无统计学意义。猜测由于样本数量不够,导致其没有统计学差异)。而T4期患者的CD4/CD8比值要明显高于T1-3期患者(如图3F所示,均有统计学差异)。因此早中期宫颈癌患者较晚期宫颈癌患者外周血中具有更多的CD8阳性T细胞数量和较低的CD4/CD8比值;而有淋巴结和远处转移的宫颈癌患者外周血中CD8阳性T细胞数量低于无转移的宫颈癌患者,CD4/CD8比值则较高。
A. CD8阳性T细胞绝对数同淋巴结转移的相关性;B. CD4/CD8比值同淋巴结转移的相关性;C. CD8阳性T细胞绝对数同远处转移的相关性;D. CD4/CD8比值同远处转移的相关性;E. CD8阳性T细胞绝对数同临床T分期的相关性;F. CD4/CD8比值同临床T分期的相关性
这部分结论提示宫颈癌患者外周血中CD8阳性T细胞的绝对数同宫颈癌的肿瘤进展转移及预后相关,与肺癌患者的完全一致,也再次验证了我们在2.1部分提出的结论或者假设:肿瘤患者外周血中CD8阳性T细胞的绝对数及其相关联的指标CD4/CD8比值同肿瘤的发生发展和转移相关,同时这两个指标也是肿瘤患者预后的独立因素。外周血中具有较多数量的CD8阳性T细胞(CD4/CD8比值相对较低)的肿瘤患者具有更好的预后。
3.讨论
免疫系统是机体执行免疫应答及免疫功能的重要系统,具有监视、防御和调控的作用[8]。免疫系统不仅能够识别外来入侵的病原体,同时也能够识别和清除体内发生突变的肿瘤细胞、衰老细胞等其他有害成分。正常情况下发生突变的肿瘤细胞都会被机体的免疫系统识别并且清除,但是肿瘤患者体内的肿瘤细胞由于肿瘤微环境的复杂性,使其逃脱了机体的免疫监视,进而发生发展甚至转移。如何使机体有效识别肿瘤细胞并对其进行清除是肿瘤治疗的核心问题之一[9-10]。
机体的免疫系统由多种成分构成,包括免疫器官、免疫细胞和免疫分子。淋巴细胞作为主要的免疫细胞,在免疫系统发挥功能的过程中起重要作用[4]。淋巴细胞简单的我们可以划分为CD3阳性T细胞,B淋巴细胞和NK细胞,其中CD3阳性T细胞又可以分为CD4阳性T细胞和CD8阳性T细胞。再往下细分我们又可以将CD4阳性T细胞分为辅助性T细胞,记忆型T细胞,调节性T细胞等等[11, 12]。此外巨噬细胞、DC细胞和MDSC细胞也是免疫细胞的重要成员,协助免疫系统发挥功能。肿瘤免疫微环境是一个非常复杂的内环境,不仅包括肿瘤细胞,免疫细胞,内皮细胞等其他细胞,还包括各种细胞因子和基质成分。由于免疫细胞以及肿瘤微环境的复杂性,我们无法做到实时地检测所有免疫细胞,因此我们通过流式细胞術检测肿瘤患者外周血中CD3阳性T细胞,CD4阳性T细胞,CD8阳性T细胞,B淋巴细胞和NK细胞来评估肿瘤患者的一个免疫功能状态,从而为临床提供有用的信息[13, 14]。
T淋巴細胞介导的细胞免疫是机体主动的免疫应答,T淋巴细胞具有多种生物学功能,如直接杀伤靶细胞、辅助B细胞产生抗体以及产生细胞因子等[15-17]。而CD8阳性T细胞是细胞毒性T细胞,能够直接杀伤靶细胞[18]。因为本研究检测和分析T淋巴细胞及其亚群同临床的相关性。结果显示肿瘤患者外周血中同细胞毒性T细胞相关的两个指标CD8阳性T细胞绝对数和CD4/CD8比值同肿瘤患者的临床信息相关,早中期肿瘤患者外周血中细胞毒性T细胞数量要高于晚期患者,提示细胞毒性T细胞的数量与肿瘤患者的预后相关。肿瘤患者外周血中具有较多数量的细胞毒性T细胞,其具有更好的预后。本研究很好的诠释了细胞毒性T细胞作为机体免疫系统杀伤肿瘤细胞的主要执行者,只有这类淋巴细胞基数达到一定数量时,机体的免疫系统才有可能去杀伤肿瘤细胞;而如果这类细胞的数量基数都很低,机体的免疫系统就无法去杀伤肿瘤细胞,从而影响后续的治疗包括一些免疫单抗治疗,如PD-1,CTLA-4等[19]。外周血淋巴细胞亚群虽然不能够准确反应肿瘤原位中淋巴细胞亚群的状态,但是外周血样本取材方便,检测准确的特点,同时同一患者外周血和肿瘤原位淋巴细胞亚群变化具有一致性,使得外周血淋巴细胞亚群分析成为目前最为可行的评估肿瘤患者免疫状态[20-22]。
通过本研究,我们发现肿瘤患者外周血中CD8阳性T细胞的绝对数同患者的临床分期,淋巴结转移和远处转移相关,提示可能是肿瘤患者预后的独立因素之一。肿瘤患者外周血中CD8阳性T细胞的数量越多,患者具有更好的预后。我们希望通过检测肿瘤患者外周血中淋巴细胞亚群,为临床提供有价值的信息,进而使临床能够根据每个患者的免疫功能状态制订个体化的治疗策略,也使每个患者能够从各项检测中得到最优化的获益。
参考文献:
[1] Yang L, Zheng R, Wang N, et al. Incidence and mortality of stomach cancer in China, 2014[J]. Chin J Cancer Res, 2018, 30 (3):291-298. DOI:10.21147/j.issn.1000-9604.2018.03.01.
[2] Fahmi T, Esendagli G, Yilmaz G, et al. Immune compartmentalization of T cell subsets in chemically-induced breast cancer[J]. Scand J Immunol, 2010, 72 (4):339-348. DOI:10.1111/j.1365-3083.2010.02447.x.
[3] Yoshimura K, Laird LS, Chia CY, et al. Live attenuated Listeria monocytogenes effectively treats hepatic colorectal cancer metastases and is strongly enhanced by depletion of regulatory T cells[J]. Cancer Res, 2007, 67 (20):10058-10066. DOI:10.1158/0008-5472.CAN-07-0573.
[4] Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma[J]. Lancet Oncol, 2016, 17 (8):e328-e346. DOI:10.1016/S1470-2045(16)30206-6.
[5] Dunn GP, Bruce AT, Ikeda H, et al. Cancer immunoediting: from immunosurveillance to tumor escape[J]. Nat Immunol, 2002, 3 (11):991-998. DOI:10.1038/ni1102-991.
[6] Xia Y, Li W, Li Y, et al. The clinical value of the changes of peripheral lymphocyte subsets absolute counts in patients with non-small cell lung cancer[J]. Transl Oncol, 2020, 13 (12):100849. DOI:10.1016/j.tranon.2020.100849.
[7] Showe MK, Kossenkov AV,Showe LC. The peripheral immune response and lung cancer prognosis[J]. Oncoimmunology, 2012, 1 (8):1414-1416. DOI:10.4161/onci.21096.
[8] Grivennikov SI, Greten FR,Karin M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140 (6):883-899. DOI:10.1016/j.cell.2010.01.025.
[9] Yang F, Jin H, Wang J, et al. Adoptive Cellular Therapy (ACT) for Cancer Treatment[J]. Adv Exp Med Biol, 2016, 909:169-239. DOI:10.1007/978-94-017-7555-7_4.
[10] Jin H, Sun L, Tang L, et al. Expression of GARP Is Increased in Tumor-Infiltrating Regulatory T Cells and Is Correlated to Clinicopathology of Lung Cancer Patients[J]. Front Immunol, 2017, 8:138. DOI:10.3389/fimmu.2017.00138.
[11] Wang YY, Zhou N, Liu HS, et al. Circulating activated lymphocyte subsets as potential blood biomarkers of cancer progression[J]. Cancer Med, 2020, 9 (14):5086-5094. DOI:10.1002/cam4.3150.
[12] Li N, Zhang L, Song HL, et al. Prognostic impact of absolute lymphocyte count/absolute monocyte count ratio and prognostic score in patients with nasal-type, extranodal natural killer/T-cell lymphoma[J]. Tumour Biol, 2017, 39 (5):1010428317705503. DOI:10.1177/1010428317705503.
[13] Kuss I, Hathaway B, Ferris RL, et al. Decreased absolute counts of T lymphocyte subsets and their relation to disease in squamous cell carcinoma of the head and neck[J]. Clin Cancer Res, 2004, 10 (11):3755-3762. DOI:10.1158/1078-0432.CCR-04-0054.
[14] Milne K, Alexander C, Webb JR, et al. Absolute lymphocyte count is associated with survival in ovarian cancer independent of tumor-infiltrating lymphocytes[J]. J Transl Med, 2012, 10:33. DOI:10.1186/1479-5876-10-33.
[15] Ahrends T, Spanjaard A, Pilzecker B, et al. CD4(+) T Cell Help Confers a Cytotoxic T Cell Effector Program Including Coinhibitory Receptor Downregulation and Increased Tissue Invasiveness[J]. Immunity, 2017, 47 (5):848-861 e845. DOI:10.1016/j.immuni.2017.10.009.
[16] Borst J, Ahrends T, Babala N, et al. CD4(+) T cell help in cancer immunology and immunotherapy[J]. Nat Rev Immunol, 2018, 18 (10):635-647. DOI:10.1038/s41577-018-0044-0.
[17] Melssen M,Slingluff CL, Jr. Vaccines targeting helper T cells for cancer immunotherapy[J]. Curr Opin Immunol, 2017, 47:85-92. DOI:10.1016/j.coi.2017.07.004.
[18] Chang WC, Li CH, Huang SC, et al. Clinical significance of regulatory T cells and CD8+ effector populations in patients with human endometrial carcinoma[J]. Cancer, 2010, 116 (24):5777-5788. DOI:10.1002/cncr.25371.
[19] Dovsak T, Ihan A, Didanovic V, et al. Effect of surgery and radiotherapy on complete blood count, lymphocyte subsets and inflammatory response in patients with advanced oral cancer[J]. BMC Cancer, 2018, 18 (1):235. DOI:10.1186/s12885-018-4136-9.
[20] Riemann D, Cwikowski M, Turzer S, et al. Blood immune cell biomarkers in lung cancer[J]. Clin Exp Immunol, 2019, 195 (2):179-189. DOI:10.1111/cei.13219.
[21] Xu YF, Lu Y, Cheng H, et al. Abnormal distribution of peripheral lymphocyte subsets induced by PDAC modulates overall survival[J]. Pancreatology, 2014, 14 (4):295-301. DOI:10.1016/j.pan.2014.05.797.
[22] Oh SY, Heo J, Noh OK, et al. Absolute Lymphocyte Count in Preoperative Chemoradiotherapy for Rectal Cancer: Changes Over Time and Prognostic Significance[J]. Technol Cancer Res Treat, 2018, 17:1533033818780065. DOI:10.1177/1533033818780065.
*本課题受国家自然科学基金项目(81602020)资助
通讯作者:金昊
所有作者均声明不存在利益冲突
