新型脲酶抑制剂对土壤脲酶活性和土壤微生物量的影响
2021-11-08黄兆玮王趁义付佳佳陈仙仙
黄兆玮,董 磊,王趁义,付佳佳,陈仙仙
(浙江万里学院生物与环境学院,315100,浙江宁波)
脲酶抑制剂能延缓土壤中尿素的水解,减少氨的挥发损失[1],避免耕地板结,减轻气态氮氧化物释放等环境负效应[2],如Mira等[3]的研究指出,在热带区的绿色甘蔗地中,施用含脲酶抑制剂(N-丁基硫代磷酰三胺,NBPT) 530 mg/kg以上的尿素能提高尿素基肥利用率,降低氨气累积损失率。刘兆辉等[4]证明,添加脲酶抑制剂能使玉米、小麦和水稻三大粮食作物产量提高5.8%~22.8%,同时显著降低氨挥发、氧化亚氮排放。
在世界肥料市场上已经申请了专利的脲酶抑制剂有100多种,主要分为金属盐、有机物小分子和植物提取物等3大类,多数集中在德国、印度和美国[5]。但现有3大类脲酶抑制剂具有毒副作用高,生物活性差,性价比低等弊端[6],这些使尿素氮转化的脲酶抑制剂调控技术走进了瓶颈。目前仅有NBPT和氢醌(HQ)2种脲酶抑制剂得到实际应用和作为商品在市场上流通。
近年来国内外掀起了新型脲酶抑制剂的研发热潮,大多是利用Schiff碱有机小分子、植物生长必需的无机金属盐等作为分子建筑块单元,通过多种协同配体的基团修饰、灵活调控、活性筛选,构建出拥有双活性位点的第4类脲酶抑制剂抑制剂(the fourth type of urease inhibitors,FTUI)。相应的研究结果已经验证Schiff碱配合物具有良好的抑酶、抗病毒、杀菌、抗肿瘤等多种药理学和生物学活性[5-6],Schiff碱类配位化合物及其簇合物已经成为涉及农学、生物、材料、医药等领域共同关注的热点[7]。
现有的研究报道了一些传统脲酶抑制剂如NBPT和HQ,对土壤脲酶活性及土壤微生物种类和数量的影响。而针对第4类脲酶抑制剂对土壤脲酶活性和土壤微生物量的影响鲜有报道[8]。笔者通过对比FTUI和传统第2类脲酶抑制剂(acetohydroxamic acid,AHA)对脲酶活性的抑制性能,及其对土壤微生物的毒性测试,揭示FTUI的微生物学效应,为其安全标准的制定、降低使用时的生态风险等积累基础数据,提供理论指导。
1 材料与方法
1.1 试验材料
供试土壤为中国南方水稻土,地点位于浙江省宁波市鄞州区首南街道月浦稻田,5点法取土壤表层以下0~20 cm土样,经过风干、混匀、研磨,过2 mm筛备用。土壤基本理化性质为:pH 值5.98,电导率237 μs/cm,含水率13.31%,有机质2.56%,总氮2.23 g/kg,有效磷61.76 mg/kg。
第2类脲酶抑制剂乙酰氧肟酸(AHA)购于国药集团化学试剂有限公司;FTUI C15H14N3O2SClCu是由课题组[9]提供,合成路线如图1所示。
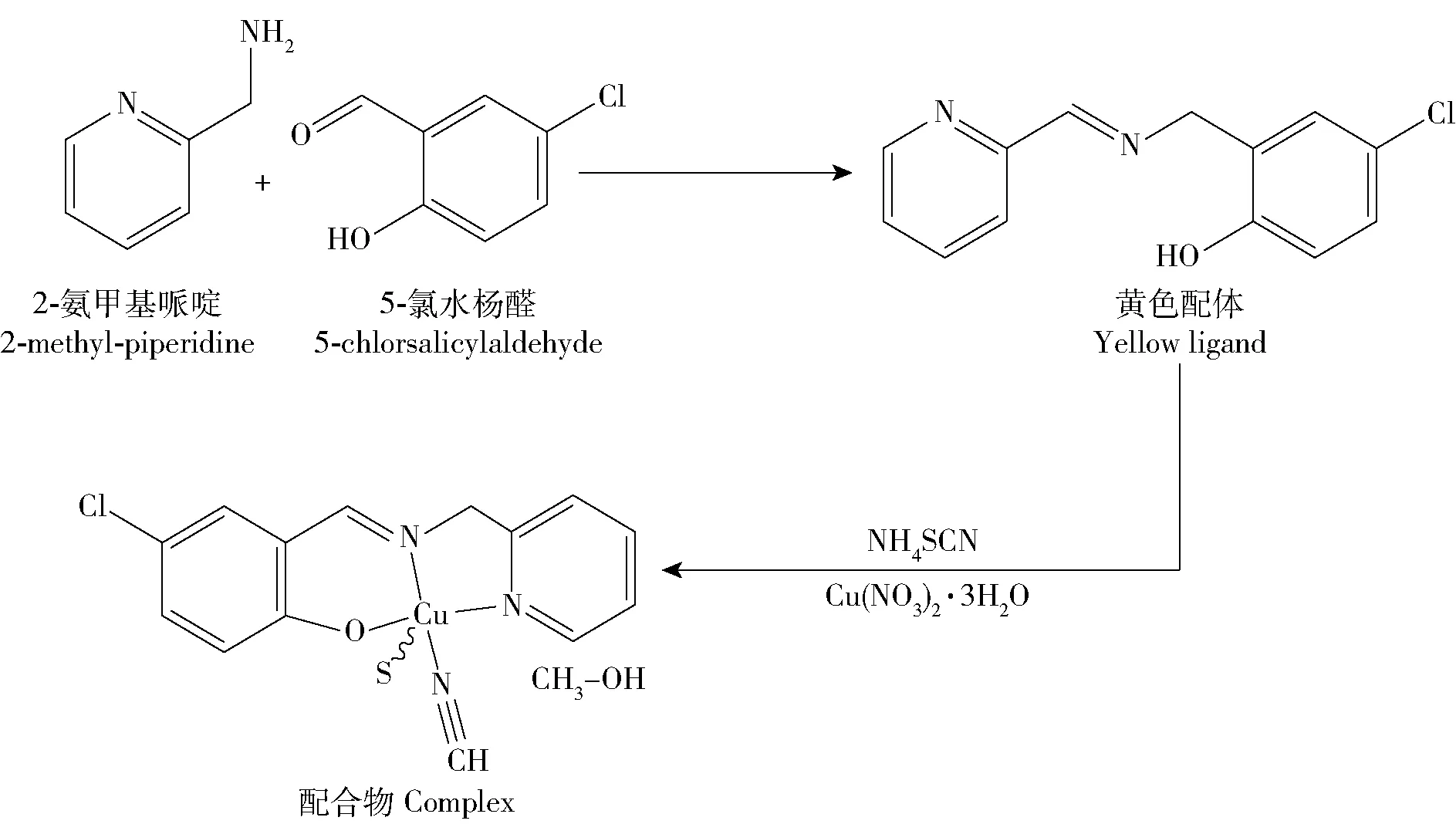
图1 FTUI的合成总路线图Fig.1 General route diagram of FTUI synthesis
1.2 试验与测试方法
1.2.1 抑制剂表征 利用MP430全自动视频熔点仪(济南海能仪器股份有限公司)测定样品熔点;采用溴化钾压片法,利用Bruker MPA型傅立叶变换近红外光谱仪(德国Bruker公司)测定FTUI的光谱特性;利用SATARAM Labsys EVO同步热差分析仪(法国SATARAM公司),升温速率为10 ℃/min,记录样品从室温22 ℃升高到1 000 ℃的差热和热失重曲线。
1.2.2 土样处理 按照本组方法[10],取6个10 cm×14 cm培养容器,每个容器中加入500 g土样,然后置于28 ℃人工气候箱中培养1周。将上述土壤分成6组,第1组作为对照组(CK),第2组加尿素5 g作为尿素对照组,第3~6组分别加入5 g的尿素和不同用量的FTUI,FTUI用量分别为尿素的0.1%、0.2%、1.0%和1.5%,相应的试验组分别记作U+0.1%、U+0.2%、U+1.0%和U+1.5%,每组进行3个重复。然后将6种不同处理的土壤置于20 ℃的人工气候培养箱中,每隔6 d取样测定1次微生物数量和土壤脲酶活性[8],试验期间每天通过称量法补水,保持土样含水量与田间一致。
1.2.3 抑制脲酶活性测定 刀豆脲酶购自阿拉丁公司,将30 kU/L脲酶和25 μL各种浓度的FTUI依次加入96孔板中,放入恒温培养箱37 ℃下振荡培养1 h。加入200 μL,pH=6.8的磷酸盐缓冲液(0.02 g酚红/100 mL),继续37 ℃培养,以市售的AHA为阳性对照,根据酚红指示剂的颜色变化,溶液通过酶标仪于570 nm处测量6.8上升至7.7(测试终点)的OD值,根据拟合方程,依次求出各自的IC50值。
参照文献[11]方法,从采样土壤中提取土壤脲酶,并采用靛酚蓝比色法测定抑制活性。
1.2.4 对土壤微生物的毒性测定 采用稀释涂布平板计数法[12-13],参照本组方法[10],称取土样1 g,放入99 mL无菌水中充分混合,制成10-2土壤悬液。从10-2土壤悬液中吸取1 mL土壤悬液加入9 mL无菌水中充分混匀,以此类推制成10-3、10-4和10-5等不同稀释度的土壤悬液。吸取土壤悬液0.2 mL加入已制备好的平板培养基中。其中,细菌采用牛肉膏蛋白胨培养基于培养箱中37 ℃培养2 d,稀释梯度选用10-4、10-5和10-6;放线菌采用高氏Ⅰ号培养基于培养箱中28 ℃培养4 d,稀释梯度选用10-3、10-4和10-5;真菌在孟加拉红琼脂培养中培养,在27 ℃条件下培养72 h,土壤悬浊液浓度为10-2~10-4。
1.2.5 数据分析 数据的统计分析采用Microsoft Excel 2016和SPSS软件,作图采用Origin 8.0。
2 结果与分析
2.1 FTUI的表征分析
2.1.1 熔点分析 通常纯的有机化合物都有固定熔点,在一定压力下,其熔程不超过1 ℃,如表1所示,说明合成的FTUI晶体纯度较高。
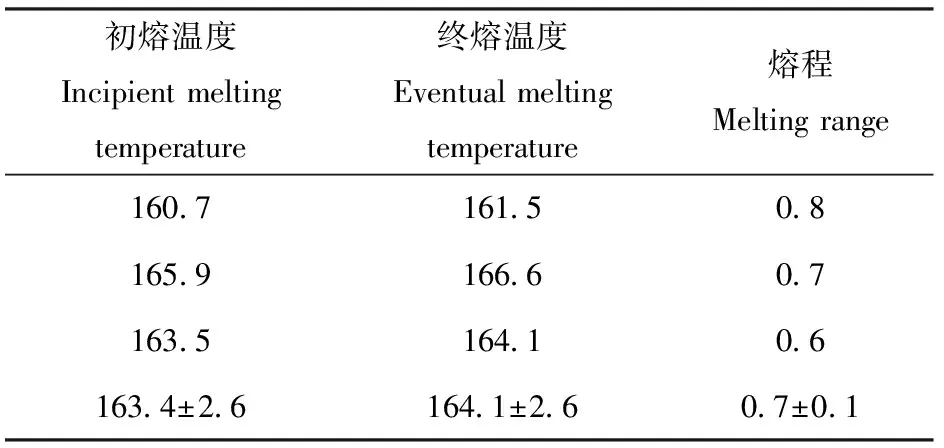
表1 FTUI晶体的熔点测定Tab.1 Determination of melting point of FTUI ℃


图2 FTUI的红外谱图Fig.2 Infrared spectra of FTUI
2.1.3 热重分析 热重分析(simultaneous thermogravimetric analyze,STA)曲线如图3可见,FTUI的失重分为2个阶段,在第1阶段(207~380 ℃)失去硫氰根基团和Schiff碱的甲基,该阶段失重15.94%,接近理论计算值(18.27%);第2阶段的温度明显大于熔点温度,处于连续失重状态,表明此时化合物骨架逐渐坍塌,导致FTUI迅速分解。
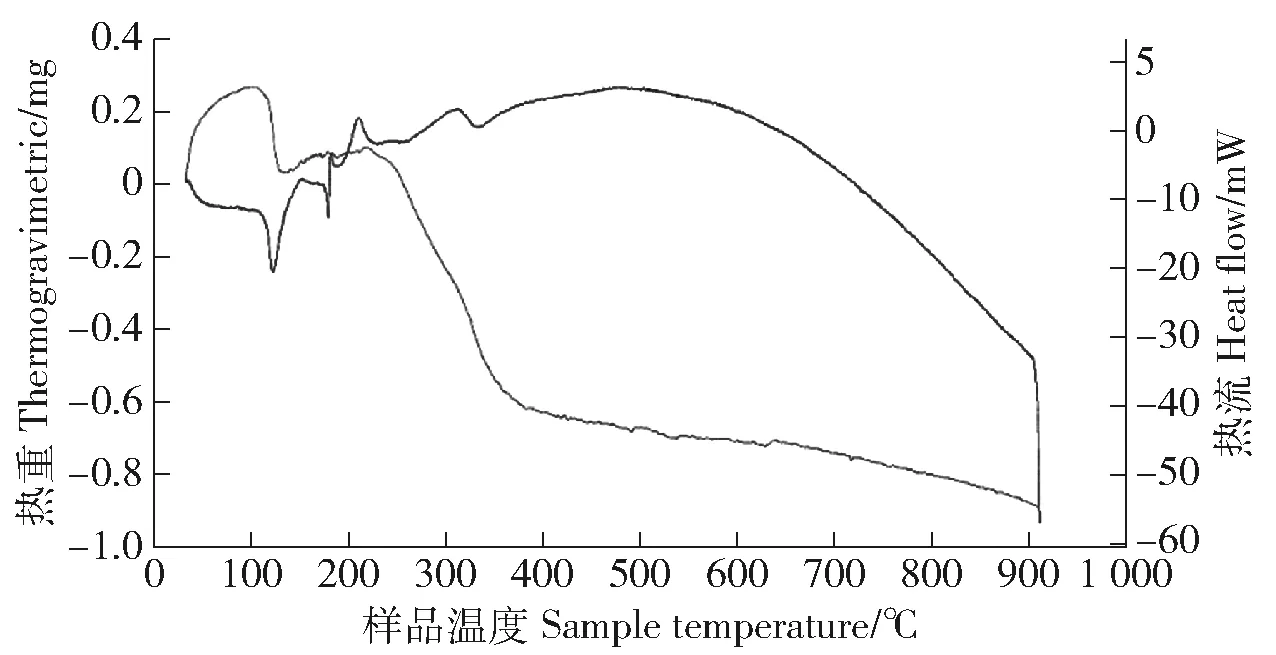
图3 FTUI的STA曲线Fig.3 STA curve of FTUI
2.2 FTUI抑制脲酶的作用分析
2.2.1 FTUI对刀豆脲酶的活性分析 以市售常用的AHA抑制剂为对照组,AHA和FTUI的抑制脲酶活性见图4。AHA的IC50(抑制一半时的抑制剂浓度,half maximal inhibitory concentrqtion)=2.56,FTUI的IC50=0.76,新型抑制剂FTUI的抑制能力显著优于对照组AHA,说明这种配合物类型的脲酶抑制剂具有良好发展前景。
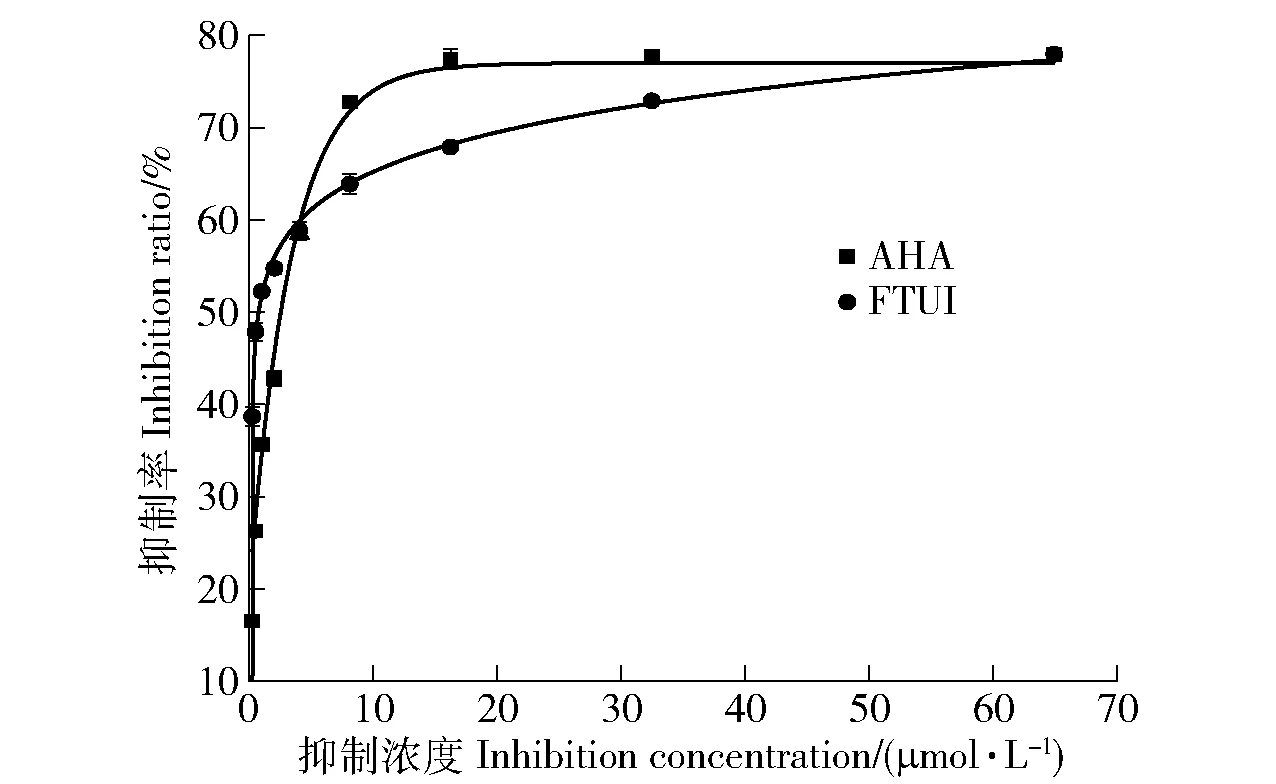
图4 第4类脲酶抑制剂(FTUI)与对照组(AHA)的 抑制脲酶活性比较Fig.4 Comparison of inhibiting urease activity between FTUI and control AHA
2.2.2 FTUI对土壤脲酶活性的调控作用 土壤酶活性反映了土壤中各种生物化学过程的强度和方向,其中脲酶活性强弱影响着土壤中尿素的水解速率[15],可以间接获得添加的FTUI对尿素的缓释效果。如图5所示,U、U+0.1%、U+0.2%、U+1.0%和U+1.5%处理组,在试验前期土壤脲酶活性较高,说明尿素能够被土壤中的脲酶快速分解[16],在6、12和18 d土壤脲酶活性受到抑制,相较于尿素组(U),U+0.2%、U+1.0%和U+1.5%组的脲酶活性在第12 d分别降低46.47%、69.60%和70.18%,第18 d分别降低54.80%、71.20%和70.13%,且均达到显著差异(P<0.05)。说明土壤脲酶活性抑制效果在一定范围内随着抑制剂浓度增大而逐渐增强,在1.0%时抑制效果最强,继续增大浓度抑制效果无明显变化,因此在后续实验中去除U+1.5%实验组。FTUI的抑制作用后期大于前期,可能原因是FTUI有良好的稳定性,因此在土壤中抑制作用时间更长,具体的作用机制有待进一步深入研究。

U:尿素,下同。U:Urea, the same below图5 不同处理组组随时间在土壤中的脲酶活性Fig.5 Urease activity of different treatments in soil over time
2.3 FTUI对土壤微生物的毒性分析
2.3.1 FTUI对细菌数量的影响 由图6可知,在整个培养期间,空白组细菌数量一直处于较低的水平;各处理组的土壤细菌数在第6天所对应的细菌数差异小,之后开始出现不同幅度的上升,在12 d达到最大,之后逐渐减少。仅加尿素处理的土壤细菌数比空白处理土壤的细菌数多,最大增长率达42.9%;FTUI处理组增长率明显超过仅加尿素处理组,其最大增长率为60.3%,达到显著差异(P<0.05)。这有2方面原因:一是FTUI能减缓尿素的快速水解,从而减少高浓度氨和铵对细菌的胁迫作用,保证后期有充足的氮源供细菌生长[17];另一个是FTUI使得土壤环境发生变化,比如pH上升,脲酶活性降低,细菌获得了良好的生长环境[18]。U+0.1%和U+0.2%处理组的细菌数量低于U+1.0%处理组,与图5中相应处理组土壤脲酶活性差距相似,说明土壤细菌数量可能与FTUI抑制脲酶活性强弱有关。第30 d时,各处理的土壤细菌数达到基本一致,说明尿素已全部水解完,细菌生长失去了氮源,氨气与铵根不再积累以致细菌生长不再受抑制[19]。
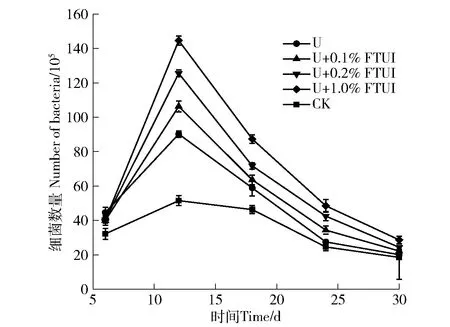
图6 FTUI对细菌数的影响Fig.6 Effect of FTUI on the number of bacteria
2.3.2 FTUI对放线菌数量的影响 由图7可知,各处理组的土壤放线菌数量变化趋势大致相同(先上升后下降),土壤放线菌在第18 d达到最高值,在第30 d时施用FTUI的处理组与仅加尿素处理组在放线菌数量上趋向一致。而空白组的放线菌数量远高于尿素处理组放线菌的数量,说明尿素对放线菌的生长有抑制作用,最大抑制率为47.6%,达到显著差异(P<0.05)。FTUI处理组放线菌数量高于尿素处理组,因为土壤脲酶活性被抑制后减缓尿素的水解,有利于放线菌的增生,FTUI对放线菌的生长有促进作用,在24 d,U+1.0%组达到最大促进率71.7%,相比于仅加入尿素处理组,达到显著差异(P<0.05)。第24 d后,FTUI处理组与尿素处理组放线菌数量开始逐渐接近,原因是脲酶抑制剂具有时效性,24 d后抑制剂开始降解,30 d时彻底失去抑制作用。可以采用包膜的措施来防止抑制剂与土壤微生物的直接接触,延缓抑制剂的使用寿命。
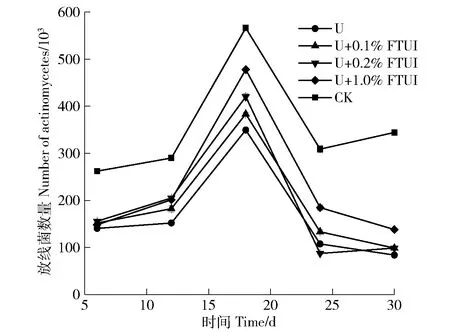
图7 FTUI对放线菌生长数量的影响Fig.7 Effect of FTUI on the growth quantity of actinomycetes
2.3.3 FTUI对真菌数量的影响 由图8可知,各个处理组真菌数量呈先增加后降低的趋势,在24 d达到最高峰,U、U+0.1%和U+0.2%处理组在42 d与空白组真菌数量相近,说明此时尿素已完全分解;U处理组数量低于空白处理组,说明尿素对真菌生长起抑制作用,最大抑制率达到86.14%,差异显著(P<0.05);U+0.1%和U+0.2%处理组相对于U处理组真菌数量有一定的提升效果,但无显著差异,说明低浓度FTUI对土壤真菌影响不大;U+1.0%处理组在各个时期真菌数量均高于其他各处理组,与U处理组相比最大增长率达到1 592.85%,差异显著(P<0.05),说明FTUI有促进土壤真菌生长的作用;U+1.0%处理组在42 d还有一定程度的增长,说明高浓度的FTUI抑制土壤脲酶活性的时间较长,对土壤真菌的影响时间也会提升。

图8 FTUI对真菌生长数量的影响Fig.8 Effect of FTUI on the growth quantity of fungi
3 讨论
土壤酶活性控制着土壤有机质分解速率和养分循环过程[20]。本课题组的前期研究已证明FTUI的施入能使土壤脲酶活性显著降低,减缓尿素的水解,延缓土壤中氨氮的氧化作用[5],与文献[21]报道的结论一致。这种效果主要归因于新型抑制剂的2种构筑单元(有机配体和金属中心元素)被限制在配合物骨架中,同时拥有了双活性位点(double active sites)[5-6]调控作用。既与脲酶活性中心的镍原子产生竞争配位作用,有机配体基团又可以阻断脲酶活性位点入口,致使脲酶变性失活,丧失酶促反应能力。
周旋等[22]研究发现市售常用的有机物脲酶抑制剂NBPT的最佳作用时间为前6~9 d,且抑制效果随施用时间的延长而减弱。隽英华等[23]研究了有机物脲酶抑制剂抑制剂氢醌(HQ)对中国东北土壤脲酶的影响,发现最大抑制效力为10 d左右;Ur-Rehman等[24]从芦荟树脂和枸杞茎甲醇提取物中的分离得到23种天然化合物作为脲酶抑制剂,IC50最佳为(14.0±0.8)μmol/L。而本试验施加FTUI处理的抑制效果随着施用时间的延长而增强,在18 d达到最强,这明显优于其他3类脲酶抑制剂,说明了FTUI在抑制时长,抑制强度方面均高于传统脲酶抑制剂。
土壤微生物参与土壤有机质分解,腐殖质合成、养分转化和土壤的发育和形成,是土壤生物中最活跃的部分,而细菌、放线菌、真菌等种群随着施肥处理的不同而显著不同。土壤放线菌对尿素比较敏感,会受到尿素的影响抑制其生长,这与土壤中尿素水解产生的铵过度积累有关。而细菌和真菌却相反,尿素可以促进其生长,这与尿素水解产生的氮源会给细菌和真菌生长提供氮源和碳源有关,当施肥量达到细菌和真菌生长繁殖所需的足够碳源,土壤细菌和真菌的生物量明显增加[25]。
尿素或铵肥施加于土壤时可能产生局部浓度非常高的氨氮,由于氨的毒性,容易导致土壤微生物被抑制或杀死[26]。但目前抑制剂在农田上的应用并未有统一的安全标准。本研究结果显示,FTUI在较长的时间范围内能促进细菌、放线菌和真菌的生长,一方面是FTUI能提高土壤氮素有效含量,另一方面说明其调控下的尿素释放方式利于为微生物创造良好的生存环境,刺激微生物的生长和活动[27]。探讨FTUI对土壤微生物的影响及其最佳用量,对于实现化肥零增长,保障粮食安全、减轻面源污染、发展高效生态农业、制订抑制剂施用标准具有重要的科学意义和可以预见的广泛应用价值。
4 结论
FTUI能有效地抑制土壤脲酶的活性,抑制脲酶活性强于参照组第2类抑制剂乙酰氧肟酸,且在土壤温度范围内稳定性较好;与尿素组相比,FTUI用量在0.1%~1.0%时,抑制作用显著增加,最高抑制率达71.20%。FTUI能够减少高浓度氨和铵对土壤微生物的胁迫作用,促进土壤细菌、放线菌和真菌的生长,相较于细菌和放线菌,FTUI对真菌的促进作用更大,抑制剂浓度为1.0%时促进作用最明显,为最佳用量,但尚需通过在种植作物的田间环境中来验证结论的有效性。
