翘嘴鳜雄性特异NLRP3基因cDNA的克隆及表达分析
2021-11-07欧阳号锋卢灏铭朱巧莹马泽昊蒲海琦李水生
欧阳号锋,韩 崇,卢灏铭,朱巧莹,马泽昊,蒲海琦,李水生,张 勇
(中山大学 生命科学学院水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室,广州 510275)
0 引言
鳜鱼(鲈形目,鮨科,鳜亚科,Sinipercachuatsi)是一类著名的珍贵淡水鱼,主要分布在中国、越南和韩国的河流中[1]。根据中国古代诗歌和书籍,鳜鱼在几千年前就已经被用作烹饪食材[2]。鳜鱼在中国养殖范围十分广泛,近年来,年产量已达到30万吨。然而,由于翘嘴鳜口感好、味道佳且必需氨基酸和不饱和脂肪酸含量高而广受消费者欢迎,一直处于供不应求的状态。因此,提高养殖鳜鱼的生产性能迫在眉睫。两性异形在鱼类中普遍存在,如泰国斗鱼(Bettasplendens)雄性色彩更加鲜艳[2]。根据多年养殖观察及相关文献报道,雌性鳜鱼的整体生长性能优于雄性[3]。因此,实现全雌鱼养殖将能显著提高鳜鱼养殖产量。此外,病害是鳜鱼养殖业最严重的威胁,其中,虹彩病毒病是限制鳜鱼养殖产量增加的重要因素。
炎症小体是由核苷酸结合结构域和富含亮氨酸重复序列家族成员以及pyrin和HIN结构域(PYHIN)家族成员形成的多蛋白复合物,主要包括PYD、NACHT、LRR 3 个部分[4]2284。 其中,NLRP3(NACHT,LRR and PYD domains-containing protein 3)炎症小体一直是免疫炎症领域中的重要研究对象,其在机体免疫和许多疾病的发生发展过程中发挥重要作用[4]2283。NLRP3是目前发现识别PAMPs和胞内危险信号种类最多的一种炎性小体,其介导的炎症反应与机体加强对体内外病原微生物的防御和维持自身稳态密切相关。NLRP3的激活因子结构多样、来源丰富,包括病毒RNA、过量ATP、真菌菌丝、透明质酸、活性氧自由基等;另外,细胞内外的阳离子的跨膜运输、尿酸盐结晶以及β-淀粉样蛋白等也能激活NLRP3,进而引起无菌性炎症[5]。目前,对鱼类中的NLRP3研究很少。有研究表明,斑马鱼NLRP3的整体结构架构与哺乳动物NLRP3相同,且通过引发经典的炎性半胱天冬酶的炎性小体组装激活和白细胞介素1成熟,确保IL-1的高效分泌来起始宿主先天免疫[6],[7]1121。
本研究以翘嘴鳜为研究对象,通过基因组及转录组水平筛选获得翘嘴鳜雄性特异NLRP3基因序列,基于该基因序列成功开发出两对翘嘴鳜雄性特异分子标记引物。另外,本研究还克隆得到翘嘴鳜雄性特异NLRP3基因全长蛋白编码区序列,并进一步通过荧光定量PCR分析方法,研究了NLRP3基因在翘嘴鳜中的组织差异性表达,发现翘嘴鳜NLRP3基因在胃肠中有较高的表达。在不同时期精巢中的差异性表达分析发现NLRP3基因在雄性翘嘴鳜性腺发育早期表达,后期几乎不表达。 本研究初步探究了NLRP3基因与翘嘴鳜性别决定与分化以及胃肠免疫过程存在的可能关联,为翘嘴鳜性别决定及免疫研究提供新的思路。
1 材料与方法
1.1 实验动物
实验用翘嘴鳜(Sinipercachuatsi)取自广东梁氏水产种业有限公司,通过土塘进行饲料。麻醉后,所有成熟鱼的表型性均通过收集其释放的配子或观察雌性或雄性性腺来单独确定。 解剖后,分别提取3条雄鱼的18个组织的样品,包括:嗅球、端脑、中脑、小脑、延脑、下丘、垂体、心脏、肝脏、肠、胃、性腺、头肾、肾脏、皮肤、肌肉、鳃、脾脏,液氮速冻保存带回实验室,存放于-80 ℃冰箱备用。 同时,提取处于发育不同时期性腺组织样品放液氮,即孵化后5、10、13、15、30、60、90、180 d。 另外,解剖鉴定性别后,取鳍条放入95%酒精中保存并记录性别。
1.2 翘嘴鳜雄性特异NLRP3标记验证及基因克隆分析
采用天根海洋动物基因组提取试剂盒从雌雄鳍条样本中提取雌雄鱼基因组DNA,DNA质量通过琼脂糖凝胶电泳进行检测,并用NanoDrop2000核酸蛋白检测仪对总DNA浓度测定。 根据实验室已有的基因组数据,通过NR注释得到雄性特异的NLRP3基因序列,根据特异区段进行雄性特异分子标记引物设计(表1)。 先在6雌鱼6雄鱼中进行PCR验证,然后扩大到16雌16雄进行再次验证。PCR扩增反应条件:95 ℃ 5 min预变性,然后是扩增反应循环95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环35个,72 ℃最终延伸5 min。反应体系为5 μL 2Taq Plus Master Mix II(Vazyme,China),每个引物0.5 μL(10 μmol·L-1),DNA模板0.5 μL,ddH2O 3.5 μL。 PCR产物通过1%琼脂糖凝胶电泳进行检测。
另外,使用Trizol reagent试剂(Invitrogen,USA)从性腺组织中提取总RNA,总RNA质量用1%琼脂糖凝胶电泳进行检测,并使用NanoDrop2000测定总RNA浓度。 根据HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)(诺唯赞,南京)反转录试剂盒说明书将1 μg总RNA反转录得到cDNA模板。 根据实验室已有的基因组和性腺转录组数据,获取了NLRP3的基因组和转录本序列,根据已知序列两端信息设计克隆引物,扩增出NLRP3完整蛋白编码区序列(表1)。 PCR扩增反应条件:95 ℃ 5 min预变性,然后是扩增反应循环95 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,循环35个,72 ℃最终延伸5 min,反应体系同上。将扩增得到的PCR产物送北京擎科新业生物技术有限公司进行测序分析。

表1 NLRP3克隆及定量的引物序列
1.3 NLRP3序列同源比对和系统发育分析
使用DNAMAN软件中多序列比对方法,对如下5种鱼类的NLRP3基因的氨基酸序列进行了同源性分析。 这5种鱼类分别是:黄鳍鲷(Acanthopagruslatus,XM_037091148)、大黄鱼(Larimichthyscrocea,XM_027279461)、尼罗罗非鱼(Oreochromisniloticus,XM_005477861)、斑马鱼(Daniorerio,MN088121)以及本研究中的翘嘴鳜(Sinipercachuatsi)。
系统发育分析选取16种鱼类,鲈形目的黄鳍鲷(Acanthopagruslatus,XM_037091148)、大黄鱼(Larimichthyscrocea,XM_027279461)、加州鲈(Micropterussalmoides,XM_038698023)、尼罗罗非鱼(Oreochromisniloticus,XM_005477861)、尼加拉瓜湖始丽鱼(Archocentruscentrarchus,XM_030752535)、河鲈(Percafluviatilis,XM_039776706)、金头鲷(Sparusaurata,XM_030410776)、白梭吻鲈(Sanderlucioperca,XM_035996640)、斑马拟丽鱼(Maylandiazebra,XM_004562477)、鲑形目的虹鳟(Oncorhynchusmykiss,XM_021587565)、鲱形目大西洋鲱鱼(Clupeaharengus,XM_031560888)、鲉形目的荫平鲉(Sebastesumbrosus,XM_037794798)、鳉形目的底鳉(Fundulusheteroclitus,XM_012852651)、黑点青鳉(Oryziasmelastigma,XM_024277246)、合鳃鱼目的大刺鳅(Mastacembelusarmatus,XP_026179754)以及外类群鲤形目的斑马鱼NLRP12(Daniorerio,XP_017211428),使用MEGA 7软件邻接法(neighbor-joining)对上述序列进行系统发育分析,构建翘嘴鳜NLRP3基因系统发育树,自展值设为1 000。
1.4 组织表达检测
先根据HiScript III RT SuperMix for qPCR(+gDNA wiper)(诺唯赞,南京)反转录试剂盒说明书将所需组织1 μg RNA反转录得到cDNA模板。 然后采用β-actin基因作为内参基因,对翘嘴鳜雄性特异NLRP3基因在18个组织的表达水平进行实时荧光定量PCR(qRT-PCR)检测。 qRT-PCR在LightCycle 480系统(Roche,使用AceQ qPCR SYBR Green Master Mix)(诺唯赞,南京)。 所有的PCR反应包含cDNA 1 μL,每个引物0.2 μL(10 μmol·L-1),AceQ qPCR SYBR Green Master Mix 5 μL,ddH2O 3.6 μL。热循环条件包含1个初始变性步骤95 ℃ 2 min,然后95 ℃ 10 s,60 ℃ 20 s,72 ℃持续20 s,循环40次。所有PCR反应均设3个重复,并进行溶解曲线分析确定扩增特异性。反应与检测方法参考黄景军[8]。
1.5 性腺表达检测
使用上述反转录试剂盒对早期性腺RNA模板进行反转录,在Roche Light Cycler 480(Roche,德国)实时荧光定量PCR 仪上进行qRT-PCR分析,检测NLRP3基因在性腺发育不同时期的表达,以β-actin 作为内参基因。反应体系和反应条件同上[8]。
1.6 数据处理
采用2-ΔΔCT方法计算NLRP3基因的相对表达量,实验数据通过SPSS 21.0软件单因素方差分析(One-way ANOVA),选择Duncan多重检验,进行差异显著性分析,P<0.05则表示差异显著。 所得数据结果用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 翘嘴鳜雄性特异NLRP3基因鉴定与cDNA克隆分析
通过基因组和转录组水平检索分析,本研究成功鉴定出1个雄性特异NLRP3基因序列,基于该序列设计得到2对雄性特异扩增引物M1和M2,首先在6雌6雄个体中实现雄性特异扩增,分别得到890 bp和951 bp的产物(图1),之后在16雌16雄进行扩大验证,结果证明,M1和M2只在雄性中特异扩增(图2),进一步说明该NLRP3基因是雄性特异的。

图1 6只雌、雄鱼的PCR检测和遗传性别鉴定

图2 16只雌、雄鱼的PCR检测和遗传性别鉴定
此外,通过PCR测序,本研究成功克隆得到NLRP3基因完整蛋白编码区序列(图3),从图3可知,该基因蛋白编码区全长3 915 bp,共编码1 305个氨基酸。等电点为6.35,相对分子质量为146 266.05 Da。

图3 翘嘴鳜雄性特异NLRP3基因的cDNA ORF核酸序列及对应的氨基酸序列
2.2 翘嘴鳜雄性特异NLRP3基因同源性分析
得到翘嘴鳜NLRP3编码蛋白的氨基酸序列后,通过Blast从NCBI数据库中找到多条其他鱼类中NLRP3基因的氨基酸序列,通过比对和结构域分析发现,翘嘴鳜雄性特异NLRP3存在pyrin结构域(PYD)、NACHT结构域、多个Leucine-rich repeats(LRR)结构域以及SPla and the RYanodine Receptor(SPRY)结构域(图4)。 其中,NACHT结构域保守性最高。

图4 5种鱼类中NLRP3蛋白氨基酸序列的多重比对
2.3 翘嘴鳜雄性特异NLRP3基因的进化树分析
通过邻接法(Neighbor joining)构建了多种鱼类NLRP3基因氨基酸序列的系统发育树,从图5可知,由NLRP3基因构建的系统发育树得出翘嘴鳜与鲈形目的加州鲈(Micropterussalmoides)最先聚为一支,后与白梭吻鲈和河鲈(Percafluviatilis)等聚到一起,之后与金头鲷(Sparusaurata)、黄鳍鲷(Acanthopagruslatus)等聚在一起,与传统分类基本一致。

图5 翘嘴鳜NLRP3基因的系统进化树
从GenBank中选出的其他物种基因的序列号:黄鳍鲷(Acanthopagruslatus,XM_037091148)、荫平鲉(Sebastesumbrosus,XM_037794798)、加州鲈(Micropterussalmoides,XM_038698023)、尼加拉瓜湖始丽鱼(Archocentruscentrarchus,XM_030752535)、河鲈(Percafluviatilis,XM_039776706)、金头鲷(Sparusaurata,XM_030410776)、白梭吻鲈(Sanderlucioperca,XM_035996640)、斑马拟丽鱼(Maylandiazebra,XM_004562477)、大黄鱼(Larimichthyscrocea,XM_027279461)、虹鳟(Oncorhynchusmykiss,XM_021587565)、大西洋鲱鱼(Clupeaharengus,XM_031560888)、底鳉(Fundulusheteroclitus,XM_012852651)、黑点青鳉(Oryziasmelastigma,XM_024277246)、尼罗罗非鱼(Oreochromisniloticus,XM_005477861)、大刺鳅(Mastacembelusarmatus,XP_026179754)、斑马鱼(Daniorerio,XP_017211428)。
2.4 翘嘴鳜雄性特异NLRP3基因在不同组织中的表达分析
通过组织分布定量检测,发现性成熟翘嘴鳜雄性特异NLRP3基因在所有组织均有检测到表达,但大多数组织中表达量很低,如小脑、延脑、头肾、精巢、皮肤、肾脏和脾脏等。而在胃、肠、肝脏以及肌肉中表达相对较高(图6)。

组织
2.5 翘嘴鳜雄性特异NLRP3基因在性腺发育不同阶段中的表达分析
通过对NLRP3基因在性腺发育不同阶段进行检测,结果发现,NLRP3基因仅在性腺发育早期有较高的表达,60 d后表达量极其微小,而且NLRP3基因在30 d前表达量呈现先逐渐上升后下降的趋势,而30 d之前为翘嘴鳜性别分化的关键时期。因此推测,NLRP3基因可能参与翘嘴鳜精巢早期发育过程(图7)。
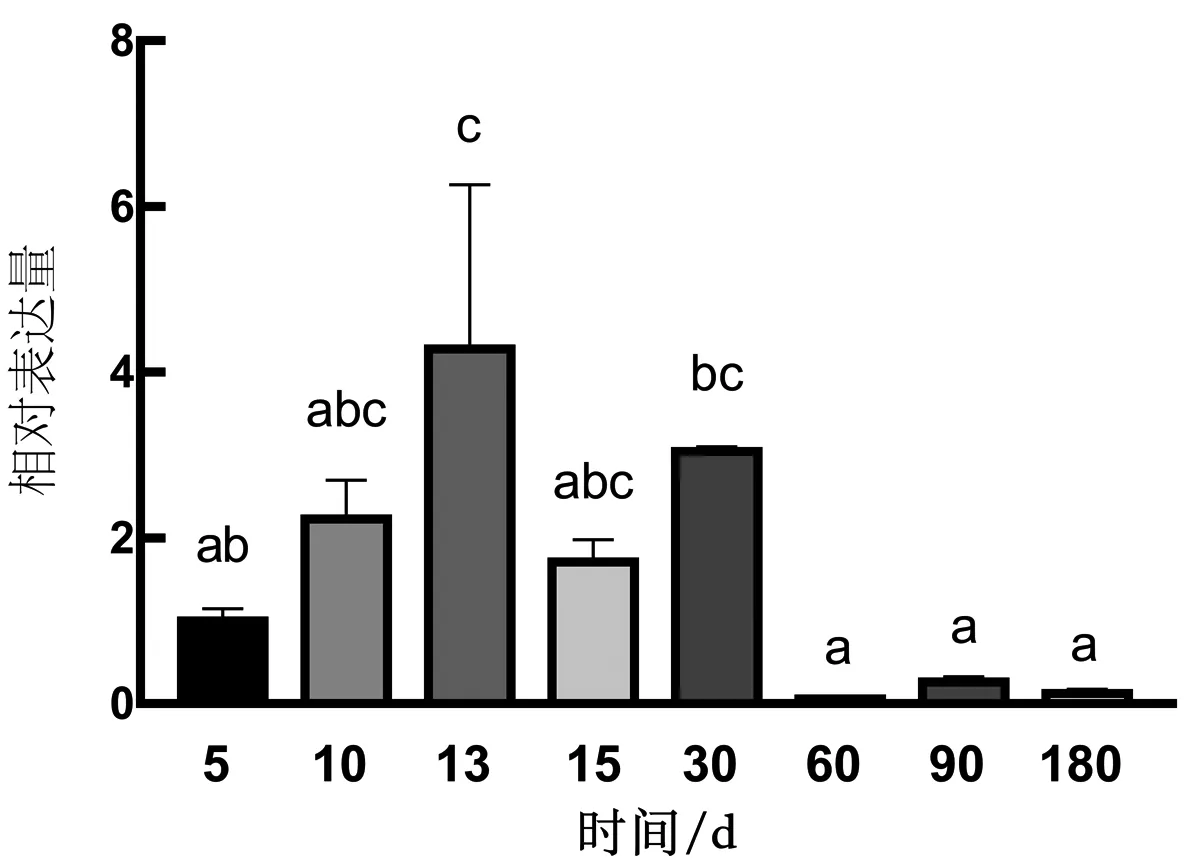
图7 翘嘴鳜NLRP3基因在雄鱼不同发育阶段的表达模式
3 讨论
我国是水产养殖大国,养殖产量约占全世界水产养殖产量的70%。近年来,随着鱼类养殖业的快速发展,优良水产养殖品种的缺乏已成为制约我国鱼类养殖健康可持续发展的重要障碍。鳜鱼是我国重要的淡水养殖鱼类,有生长快、肉质好等特点,深受广大养殖户及消费者的喜爱[1]。近年来,鳜鱼在国内养殖产业发展迅速,广东省养殖产量最大,约占全国产量的1/3。鳜鱼有1个重要特点,即生长呈现性别二态性,在成鱼养殖阶段,雌鱼生长比雄鱼快约10%~20%[9-10]。因此,探索鳜鱼性别生长二态性的调控机制,对于创制单性鳜鱼苗种以及提高鳜鱼养殖产量具有重要的理论和现实意义。
本研究基于已有的基因组和转录组数据,首次发现了1条翘嘴鳜雄性特异的NLRP3基因,并基于该基因序列成功开发出两对雄性特异分子标记,进一步支持翘嘴鳜性别决定系统为XY性别型[11]。 由于翘嘴鳜雌性生长快于雄性,因此,根据以往的鲤鱼[12]和黄姑鱼[13]全雌种群繁殖方法,最关键的就是培育并筛选遗传基因型为XX的生理雄鱼。LIU S等[14]指出雄激素投喂能够诱导翘嘴鳜XX雌鱼性逆转为生理雄鱼。因此,利用上述分子标记将XX生理雄鱼筛选出来,即可用于和XX正常雌鱼交配,从而培育得到全雌翘嘴鳜。
此外,本研究还在早期性腺样本克隆得到NLRP3基因的全长蛋白编码区序列,表明其在早期发育过程中能够正常表达。另外,通过序列比对分析发现该序列具有NACHT,LRR和PYD等多种结构域,NACHT 可将ATP水解为二磷酸腺苷ADP 并释放能量,调控NLRP3下游蛋白;PYD 结构域可以与其他蛋白PYD 结构域结合,从而激活下游反应;LRR 结构域具有高度保守的亮氨酸重复序列,激活后可通过离子能与无丝分裂基因A相关蛋白激酶7(NIMA related kinase 7,NEK7)结合,还能够介导炎症小体运输及病原识别[4]2284,[6],表明翘嘴鳜雄性特异NLRP3基因具有识别刺激因子并引发机体的炎症反应及抗病免疫反应过程的潜在能力[7]1135。系统发育分析也显示翘嘴鳜雄性特异NLRP3基因能够与鲈形目中加州鲈、白梭吻鲈、河鲈、金头鲷以及黄鳍鲷的NLRP3基因聚在一起,进一步说明NLRP3基因具有较高的保守性。
组织分布定量分析表明NLRP3基因在翘嘴鳜胃肠中表达量相对较高。同样,Masanort T等[15]指出,相比脾脏等免疫器官,猪的NLRP3基因在肠免疫组织表达量更高;另外,有研究表明,NLRP3在无脊椎动物刺身体腔中的表达量也比较高[16]。胃肠道作为第1道防线,直接接触病原微生物,因此笔者认为,翘嘴鳜NLRP3基因能够直接参与胃肠道抗菌免疫过程。然而,该基因为雄性特异基因,只在雄性翘嘴鳜中表达,这表明雄性翘嘴鳜或许在抗病免疫中相较于雌性具有一定优势,这需要进一步研究来证实。另外,不同发育阶段表达分析结果显示,NLRP3在性别分化早期呈现先上升后下降的表达趋势,在性腺发育后期几乎无表达。根据本实验室已有结果发现,翘嘴鳜在孵化后15 d,传统性别相关基因在雌雄鱼中表达水平出现明显分化,如Dmrt1和Amh在雄鱼中开始高表达,Foxl2和Cyp19a1a在雌鱼中高表达,而NLRP3表达高峰出现在孵化后13 d。因此,推测NLRP3可能参与了这些性别相关基因的早期调控,但具体如何调控尚不清晰。有研究表明,虹鳟免疫基因干扰素调节因子9(IRF9)是虹鳟的性别的决定基因,且只在性腺发育早期表达[17]。因此笔者推测,该雄性特异NLRP3基因虽然是免疫相关基因,但也可能参与翘嘴鳜早期性别分化及发育过程。
(责任编辑:潘学峰)
