HPLC-ELSD法同时测定天麻中天麻素、葡萄糖、果糖和蔗糖含量
2021-11-06吴国真王新茗王晓刘大会董红敬耿岩玲段文娟李佳
吴国真,王新茗,王晓,刘大会,董红敬*,耿岩玲,段文娟,李佳
(1.山东中医药大学药学院,山东济南250300;2.齐鲁工业大学(山东省科学院)山东省分析测试中心,山东济南250014;3.齐鲁工业大学(山东省科学院)药学院,山东济南250301;4.湖北中医药大学药学院,湖北武汉430065)
天麻(Gastrodia elata Blume)为兰科植物天麻的干燥块茎,又名“赤箭”,为药食两用植物,主要通过密环菌菌株进行人工栽培[1],当前已发展形成云南昭通、陕西汉中、贵州大方等天麻主流产区[2]。天麻在中医临床上具有息风止痉、平抑肝阳、祛风通络的传统功效[3],在民间具有悠久的食用历史,早在唐代著名诗人白居易《斋居》中就有“黄芪数匙粥,赤箭一瓯汤”的记载[4]。在现代,天麻具有天麻炖鸡、天麻泡酒、天麻火锅、天麻蜜饯等多种吃法,是云南、贵州等地居民的常用食材[5-6]。同时,天麻已被开发加工成天麻咀嚼片、天麻保健饮品、天麻保健酒等多种功能食品[7-9]。
天麻富含多酚以及糖类等多种生物功能性物质[10],其中天麻素为天麻中的主要多酚类成分,具有改善海马区多巴胺系统、保护神经元、减轻细胞损伤、改善记忆障碍等多种生物活性[11-13],常被用于评价天麻的品质。天麻中糖类成分主要有多糖、低聚糖、二糖和单糖等[14-15],不同的糖类成分会承载不同的甜味,同时单糖和二糖能够与基质中挥发性风味物质结合,可不同程度地抑制风味的释放,从而影响食品的最终风味[16-17]。因此除了关注天麻中天麻素等功能性成分的含量,天麻中单糖、二糖类成分的含量对评价不同产地天麻的口感、风味及品质的评价具有重要的意义。
当前研究多采用高效液相色谱法(high performance liquid chromatography,HPLC)测定天麻素成分的含量[18-19]、苯酚-硫酸法测定天麻多糖含量[20-21]评价天麻及相关产品的品质,未见天麻中单糖和二糖类成分含量测定的相关报道。本研究拟建立高效液相色谱-蒸发光散射检测法(high performance liquid chromatography-evaporative light scattering detector,HPLCELSD),同时检测天麻中天麻素、果糖、葡萄糖和蔗糖4种指标成分含量,并通过主成分分析(principal component analysis,PCA)及聚类分析(cluster analysis,CA)比较不同产地、批次天麻药材中的天麻素和糖类成分差异,以期为天麻及相关功能食品的品质、风味评价方法提供参考。
1 材料与试剂
1.1 材料
无水葡萄糖(纯度大于98%):国药集团化学试剂有限公司;天麻素(纯度大于98%):山东省中药质量控制技术重点实验室自制;果糖、蔗糖(纯度大于98%):成都德思特生物技术有限公司;甲醇(色谱纯)、乙腈(色谱纯):瑞典OCEANPAK化学公司。
天麻:收集于云南(YN)、贵州(GZ)、陕西(SX)和湖北(HB)4个产地,共25批,经湖北中医药大学刘大会教授鉴定均为兰科植物天麻的块茎。样品详细信息见表1。

表1 天麻药材样品信息Table 1 Sample information of Gastrodia elata Blume
1.2 仪器与设备
1260高效液相色谱仪、385蒸发光散射检测器:美国Agilent公司;SQP型电子天平:赛多利斯科学仪器(北京)有限公司;SB-5200DT超声波清洗机:宁波新芝生物科技股份有限公司;Direct-Q8UV-R纯水制备水系统:美国Millipore公司;FW100型高速万能粉碎机:天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 色谱条件
Capcell Pak NH2 UG80 S5色谱柱(250mm×4.6mm,5 μm);流动相为乙腈(A)-水(B):80%A-20%B,等度洗脱 25 min,流速 1.0 mL/min;柱温为 25℃;ELSD检测漂移管温度为50℃;载气为空气,流速1.2 L/min;进样量 10 μL。
1.3.2 溶液的配制
1.3.2.1 对照品溶液
精密称取天麻素10 mg、果糖10 mg、葡萄糖9 mg和蔗糖15 mg于10 mL容量瓶,分别加入10 mL 40%甲醇溶液配制成单一标准品储备液,用于线性关系考察及定量限和检测限分析。精密量取各单一标准品储备液适量,配制成天麻素、果糖、葡萄糖和蔗糖的质量浓度分别为 0.005、0.2、0.18、0.6 mg/mL 的混合对照品溶液,用于各样品中成分的含量测定。
1.3.2.2 供试品溶液
精密称取不同产地天麻样品粉末约1.0 g,置磨口带塞100 mL锥形瓶中,精密加入40%甲醇溶液50 mL,称重,超声(功率240 W,频率40 kHz)处理60 min,放冷至室温(25℃)后,再次称量,用40%甲醇溶液补足重量,摇匀,吸取上清液,过0.22 μm微孔滤膜过滤后,得滤液,精密吸取10 μL进行HPLC分析。
1.3.3 方法学考察
1.3.3.1 线性关系考察
分别精密量取“1.3.2.1”项下单一标准品储备液,梯度稀释配制成天麻素浓度为 0.01、0.016、0.032、0.064、0.08、0.1 mg/mL,果糖浓度为 0.02、0.1、0.2、0.4、0.8、1.0 mg/mL,葡萄糖浓度为 0.018、0.09、0.18、0.36、0.72、0.9 mg/mL,蔗糖浓度为 0.12、0.24、0.48、0.96、1.2、1.5 mg/mL的系列标准溶液,按照“1.3.1”项下色谱条件进行测定,记录峰面积。
1.3.3.2 精密度、重复性和稳定性试验
在按照“1.3.2.2”项下的方法制备供试品溶液、依照“1.3.1”项下色谱条件进样分析的条件下,精密称取天麻粉末约1.0 g,连续进样测定6次,记录峰面积,进行精密度考察;精密称取天麻粉末约1.0 g,共6份,分别进样分析,根据外标法计算样品中天麻素、果糖、葡萄糖和蔗糖的含量,进行重复性考察;精密称取天麻粉末约 1.0 g,置于室温(25 ℃),分别在 0、2、4、8、12、24 h时进样分析,并记录各色谱峰峰面积,进行稳定性考察。
1.3.3.3 加样回收率试验
精密称取已知含量的天麻约0.50 g,共6份,分别按已知含量的100%加入天麻素、果糖、葡萄糖和蔗糖对照品,按照“1.3.2.2”项下方法制备供试品溶液,再按“1.3.1”项下色谱条件进样测定,记录峰面积,根据外标法计算各成分的加样回收率。
1.3.3.4 定量限与检测限考察
稀释“1.3.2.1”项下单一标准品储备液,以S/N=10计算定量限(limit of quantitation,LOQ),以 S/N=3计算检测限(limit of detection,LOD)。
1.4 提取溶剂的选择
采用HPLC-ELSD测定不同浓度(20%、40%、60%、80%)甲醇溶剂下得到的样品中天麻素、果糖、葡萄糖和蔗糖的含量。当提取溶剂为20%和40%甲醇时,各待测成分含量较高,但差异并不明显。综合实际试验过程,当提取溶剂为20%甲醇时,天麻提取液成糊状,需要多次离心和滤膜过滤得到澄清溶液,操作较为繁琐,所以本试验选择40%甲醇为提取溶剂。
1.5 含量测定与分析
分别取表1中25批不同产地的天麻样品粉末约1.0 g,按照“1.3.2.2”项下方法制备供试品溶液,再按“1.3.1”项下色谱条件进样测定,记录峰面积,根据外标法计算各成分含量。
1.6 数据处理
以天麻中天麻素、果糖、葡萄糖和蔗糖含量为变量,采用SPSS 21.0软件对25批样品中的4种成分进行主成分分析(PCA)及聚类分析(CA)。
2 结果与分析
2.1 色谱条件
分别选取流动相乙腈(A)-水(B):90%A-10%B;80%A-20%B;60%A-40%B对样品进行梯度洗脱,发现采用80%A-20%B为流动相,等度洗脱25 min,天麻样品中天麻素、果糖、葡萄糖和蔗糖4种待测成分的色谱峰分离度较好,对照品及样品的HPLC色谱图如图1所示。


图1 混合对照品和样品溶液的HPLC-ELSD色谱分析图Fig.1 HPLC-ELSD chromatograms of mixed control solution and sample solution
2.2 线性关系考察
记录“1.3.2.1”项下的系列单一标准溶液在“1.3.1”项下色谱条件测定得到的峰面积,以峰面积积分值(Y)为纵坐标,标准溶液浓度(X)为横坐标,进行线性回归分析,得到目标化合物的标准曲线和浓度与峰面积相关系数(R2)。结果见表2。

表2 天麻中4种成分的回归方程、线性范围及相关系数Table 2 Regression equation,linear range and correlation coefficient of four components of gastrodia
由表2可知,天麻素、果糖、葡萄糖和蔗糖分别在质量浓度 0.01mg/mL~0.10mg/mL、0.02mg/mL~1.00 mg/mL、0.018 mg/mL~0.900 mg/mL、0.12 mg/mL~1.50 mg/mL 内线性范围良好,相关系数(R2)≥0.999。
2.3 精密度、重复性和稳定性试验
对天麻样品进行精密度考察中,天麻素、果糖、葡萄糖、蔗糖峰面积的相对标准偏差(relative standard deviation,RSD) 分别为 1.7%、1.5%、2.3%和 1.8%(n=6),结果表明仪器精密度良好,符合试验要求。重复性试验结果显示天麻素、果糖、葡萄糖和蔗糖4个成分的含量的RSD分别为1.9%、1.7%、0.7%和1.8%(n=6),表明该方法重复性良好。稳定性试验中测定得到的天麻素、果糖、葡萄糖和蔗糖的峰面积在24 h内的RSD 分别为 2.7%、2.1%、2.7%和 1.8%(n=6),表明供试品溶液在24 h内稳定。
2.4 加样回收率试验
对样品进行加样回收率试验,结果显示,天麻素、果糖、葡萄糖和蔗糖的平均加样回收率分别为99.10%、99.10%、97.10%和 103.7%,RSD分别为 2.4%、1.9%、1.6%和1.3%(n=6),表明本方法准确度较高。
2.5 定量限与检测限
按照定量限和检测限的测定方法,得到天麻素、果糖、葡萄糖和蔗糖的定量限分别为0.02、0.25、0.48、0.45 μg;检测限分别为 0.005、0.08、0.15、0.15 μg。
2.6含量测定与分析
2.6.1 含量测定
取不同产地的天麻样品进行含量测定,其中天麻素、果糖、葡萄糖、蔗糖的含量测定结果具体见表3。

表3 25批天麻药材中4种成分的含量测定Table 3 Determination of 4 components in 25 batches of gastrodia mg/g
由表3可知,4个产地25批天麻样品中天麻素、果糖、葡萄糖和蔗糖的含量分别为0.86 mg/g~4.89 mg/g、0.97 mg/g~43.20 mg/g、1.34 mg/g~31.90 mg/g、13.62 mg/g~72.19 mg/g,含量差异较大,含量分布范围较广。图2为各产地天麻中4种成分含量均值及同一产地中各成分的差异。分贵州产地天麻药材的标准。湖北产区虽然未被明显划分为一类,但是样品聚集效果较好,表明湖北地区样品质量差距较小;陕西、云南两地的样品较为分散,说明其样品质量差异较大。
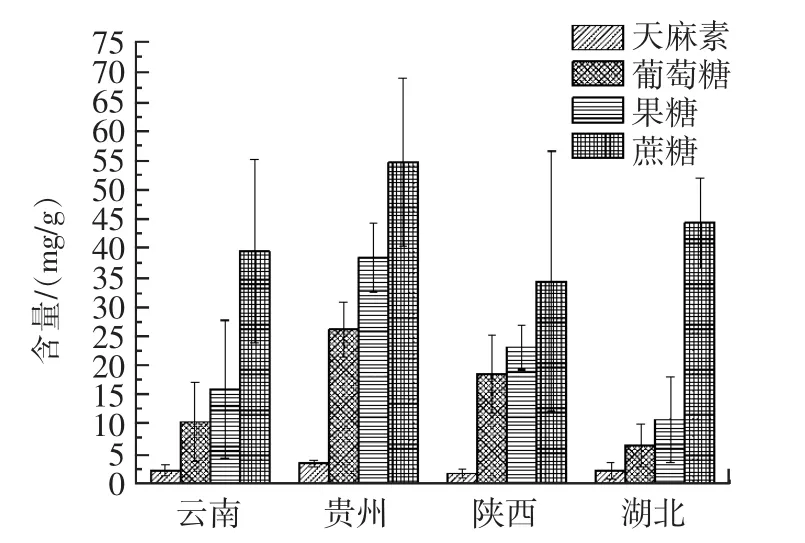
图2 同一产地间不同批次天麻中4种成分含量均值和差异分析Fig.2 Diagram of the average and difference of the contents of 4 components in different batches of gastrodia in the same production area
2.6.3 聚类分析(CA)
采用SPSS21.0软件,以天麻药材的天麻素、果糖、葡萄糖和蔗糖的含量为变量,采用组间联接方法对25批药材进行聚类分析,结果见图4。

图4 不同产地天麻药材中4种成分含量聚类图Fig.4 Cluster diagram of 4 components content in gastrodia from different origins
由图2可知,贵州产天麻中天麻素、果糖、葡萄糖及蔗糖的平均含量均较高,云南、湖北中蔗糖的平均含量次之,陕西产天麻中蔗糖平均含量最低;陕西、云南中果糖和葡萄糖的平均含量次之,湖北产天麻中果糖和葡萄糖含量最低;云南、湖北、陕西产天麻中天麻素含量无明显差异。
2.6.2 主成分分析(PCA)
以天麻中天麻素、果糖、葡萄糖和蔗糖含量为变量,采用SPSS 21.0软件对25批样品进行主成分分析,以主成分特征值大于1为提取原则,本试验提取了2个主成分,累计贡献率为79.6%,说明提取的2个主成分可以反应主要成分的大部分信息,得到样品主成分二维图谱,结果见图3。
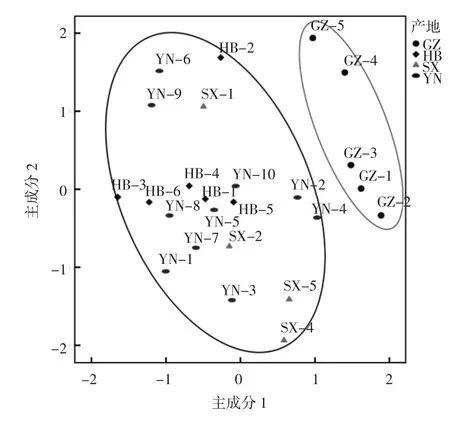
图3 25批天麻药材主成分分析图Fig.3 Principal component analysis diagram of 25 batches of gastrodia
由图3可知,贵州产地与其他3个产地相比被明显区分,说明本次研究测定的4种成分含量,可作为区
样品间判别距离越小,说明样品相似度越高,当判别条件距离为20时,25批天麻药材被分为两类,贵州产地样品(GZ-1~5)整体间距较小,说明贵州产地整体相似度较高,与云南产地样品(YN-2、YN-4)被分为一类(Ⅱ),与上述PCA分析图分布相一致;其余云南、湖北和陕西的18批药材被分为另一类(Ⅰ),其中湖北产地的 HB-3、HB-4、HB-6 与 HB-1、HB-2 间隔较小,说明湖北产地样品质量差异较小;云南产地和陕西产地中都只有部分样品相邻,表明整体相似度较低,药材成分含量分布不稳定。综合聚类分析结果发现,聚类分布与主成分分析结果相互印证,说明两种分析分类结果可靠。
3 结论
本研究建立了采用HPLC-ELSD同时测定天麻中天麻素、单糖(果糖和葡萄糖)和二糖(蔗糖)含量的方法,得到的ELSD色谱图中,干扰峰较少,有利于目标成分的含量测定,并且分析时间较短。采用建立的方法可简便高效的追踪天麻在生长、储藏、炮制加工过程中,天麻素和糖类物质的含量变化,可为天麻及相关产品的开发和功能食品质量控制提供更加全面参考依据。
