金线莲多糖纯化工艺及其抗氧化活性研究
2021-11-06赵丹洁唐鹏田冬梅付礼亚刘鑫钟小燕黄毅岚
赵丹洁,唐鹏,田冬梅,付礼亚,刘鑫,钟小燕,黄毅岚*
(1.西南医科大学药学院,四川泸州646000;2.成都市双流区第一人民医院药剂科,四川成都610000;3.成都大学附属医院药剂科,四川成都610000;4.西南医科大学附属医院药学部,四川泸州646000)
植物多糖是自然界广泛存在的一类天然有机大分子物质,也是机体的主要能量物质,具有较为重要的生物学功能,因其独特功效和低副作用而成为研究热点之一[1]。传统中药金线莲用于治疗高血压、糖尿病、心脏病、肺炎、急慢性肝炎、肾炎等疾病[2]。而多糖是金线莲的主要成分,研究显示,金线莲多糖(Anoectochilus roxburghii polysaccharides,ARPs)具有抗氧化[3-4]、提高免疫力[5-7]、调脂保肝[8-9]、降血糖[10-12]及抗肿瘤[13-15]等多种疗效,在医药保健品、化妆品、食品等领域广泛应用。因此,金线莲多糖潜在的保健功能受到越来越多学者关注。
目前对金线莲多糖的研究主要在提取工艺方面,而纯化方面的研究较少。已报道的纯化方法有高效逆流色谱法(high-speed countercurrent chromatography,HSCCC)[16-17]、超滤纯化法[18]和葡聚糖凝胶 G-100 柱层析法[19]等。这些方法效果虽好,但操作繁琐困难、成本较高,会使多糖损失较多,所以目前还未实现金线莲多糖的大规模纯化生产。大孔树脂是一种具有多孔微球立体结构的常见吸附材料,具有选择性好、吸附速度快、洗脱条件温和、干扰因素少、使用周期长、处理量大、稳定性高、可重复利用和节省费用等特点,被广泛应用于天然产物的分离与纯化[20]。一般情况下,物质的种类、大小及表面电性以及大孔树脂理化性质的差异会造成其吸附能力的不同。研究表示X-5、AB-8、HPD-400、D101等不同极性大孔树脂对多糖的分离纯化具有良好效果[20-23],如陈琛等[23]采用D101大孔树脂优化天麻多糖纯化工艺,使其多糖含量提高到65.7%。采用大孔树脂纯化金线莲粗多糖的工艺研究还未见相关报道。本研究从8种不同极性大孔树脂中筛选出最优大孔树脂,用其富集纯化金线莲粗多糖,探究最佳纯化工艺,并考察纯化前后金线莲多糖的抗氧化活性,以期为金线莲多糖的开发利用提供一定基础。
1 材料与方法
1.1 材料与试剂
金线莲全草:四川天植中药股份有限公司,产地福建;HPD-600、NKA-9、DM130、ADS-17、HPD-400、AB-8、D101、X-5大孔树脂(纯净级):沧州宝恩吸附材料有限公司;无水乙醇、苯酚、浓硫酸(分析纯):北京化工厂有限责任公司;葡萄糖标准品、牛血清白蛋白标准品:成都曼斯特生物科技有限公司。
1.2 仪器与设备
EYELAN-1300V-W旋转蒸发仪、FDU-2110冷冻干燥机:上海爱朗仪器有限公司;A560紫外分光光度计:翱艺仪器上海有限公司;ROTOFIX 32A型离心机:德国Hettich;Φ1.5 cm×30 cm层析柱:无锡华盛色谱科技有限公司;SY-88B型水浴恒温振荡器:常州国宇仪器制造有限公司。
1.3 试验方法
1.3.1 金线莲预处理
粉碎金线莲全草,过60目筛,于50℃烘干。称取30 g,加入ddH2O1500mL,于70℃水浴提取3h,抽滤、取滤渣继续加水提取,重复3次,合并各次滤液,过滤,旋转蒸发至100 mL,加入无水乙醇400 mL,4℃放置过夜,3 000 r/min离心20 min得多糖沉淀,用水复溶为一定体积后,冷冻干燥后得粗多糖[19]。
1.3.2 葡萄糖标准曲线的绘制
采用苯酚-硫酸[23-26]法测定多糖含量,准确配制1 mg/mL的葡萄糖标准溶液。分别精确移取1 mg/mL葡萄糖标准液 0.00、1.00、2.00、3.00、4.00、5.00、6.00、7.00 mL于8个10 mL容量瓶中,dd H2O定容。再加入浓度为5%的苯酚1mL,混合均匀后迅速加入浓硫酸5 mL,摇匀后置沸水浴中15 min,冷却至室温(20℃),在490 nm下测吸光度[27],以葡萄糖浓度(mg/mL)为横坐标绘制标准曲线。
样品多糖含量计算公式如式(1)所示。
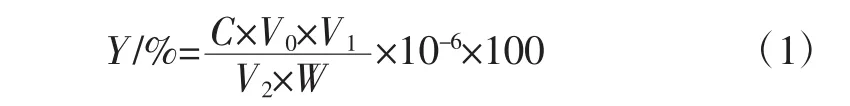
式中:Y为多糖含量,%;W为金线莲粉末的质量,g;C为待测液多糖浓度,μg/mL;V0为反应体系总体积,mL;V1为多糖溶液的体积,mL;V2为显色步骤中所加多糖样液的体积,mL。
1.3.3 蛋白质标准曲线的绘制
采用考马斯亮蓝染色法[28]测定多糖中蛋白质含量,取牛血清白蛋白标准品,准确配制浓度为1mg/mL的牛血清白蛋白标准品溶液,分别取 0.02、0.04、0.06、0.08、0.10、0.12 mL的标准品溶液依次加入试管中,分别加入dd H2O补足至1 mL,加入5 mL考马斯亮蓝试剂,充分混合后静置15 min,待蛋白被充分染色后,于595 nm波长下用紫外可见分光光度计测量吸光度。用dd H2O作为空白对照,并以595 nm处的吸光度为纵坐标,以牛血清白蛋白浓度(μg/mL)为横坐标绘制标准曲线。
按照标准曲线方法测定纯化前后样品蛋白含量。计算蛋白去除率,计算公式如式(2)所示。
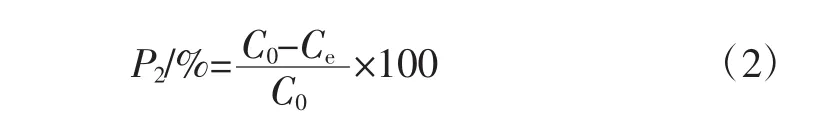
式中:P2为蛋白去除率,%;Ce为纯化后样品溶液中的蛋白浓度,μg/mL;C0为纯化前样品溶液中的蛋白浓度,μg/mL。
1.3.4 色素含量测定
因色素成分复杂,种类难以确定,使得含量测定较为困难,故采用全波长扫描法,在200 nm~800 nm波长范围内[20,29]扫描多糖溶液测定吸光度。选取最大吸收峰处波长λ0为检测波长,测此波长下吸光度,作为多糖溶液中色素的检测值,平行测定3次。计算样品多糖色素去除率,计算公式如式(3)所示。
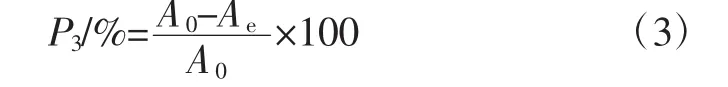
式中:P3为色素去除率,%;Ae为纯化后样品溶液在λ0下的吸光度;A0为纯化前样品溶液在λ0下的吸光度。
1.3.5 大孔树脂筛选
选取8种大孔树脂,通过对多糖吸附率、解吸率、蛋白去除率、色素去除率等方面的比较,筛选最优大孔树脂;测定吸附率、解吸率计算公式如式(4)、(5)所示。


式中:R1为吸附率,%;R2为解吸率,%;C0为吸附前母液多糖浓度,mg/mL;C1为流出液多糖浓度,mg/mL;V0为上样液体积,mL;V1为流出液体积,mL;C2为解吸液多糖浓度,mg/mL。
1.3.6 动态单因素试验
采用单因素试验,筛选出金线莲多糖最佳纯化工艺,并进行验证。
1.3.6.1 上样浓度对多糖动态吸附的影响
选取最优大孔树脂5份(10 cm3)装入柱中,用适量dd H2O冲洗至柱中无气泡,分别加入20 mL浓度为1、2、3、4、5 mg/mL 的样品溶液,以 2 BV/h 的流速上样。收集流出液,测定流出液中多糖的含量,计算吸附率。
1.3.6.2 上样流速对多糖动态吸附的影响
选取最优大孔树脂5份(10 cm3)装入柱中,冲洗后,分别加入20 mL浓度为4 mg/mL样品溶液,以1、2、3、4、5 BV/h的上样流速通过层析柱,收集流出液,测定流出液中多糖的含量,计算吸附率。
1.3.6.3 上样体积对多糖动态吸附的影响
选取最优大孔树脂1份(10 cm3)装入柱中,冲洗后,加入4 mg/mL的样品溶液,以2 BV/h的流速上样,总上样量为10 BV(100 mL),并分别在上样体积为1、2、3、4、5、6、7、8、9、10 BV 时测每个相应柱体积流出液中多糖的含量,计算吸附率。
1.3.6.4 洗脱剂浓度对多糖解吸率的影响
选取最优大孔树脂5份(10 cm3)装入柱中,冲洗后,分别加入4 mg/mL的样品溶液40 mL,以2 BV/h通过层析柱,分别加入40 mL dd H2O及浓度为20%、40%、60%、80%的乙醇溶液,以2 BV/h进行洗脱,收集洗脱液,测定每瓶洗脱液中多糖的含量,计算解吸率。
1.3.6.5 洗脱速度对多糖解吸率的影响
选取最优大孔树脂5份(10 cm3)装入柱中,冲洗后,分别加入4 mg/mL的样品溶液40 mL,以2 BV/h通过层析柱,吸附完全后,少量蒸馏水洗涤,再用40%乙醇溶液分别以 1、2、3、4、5 BV/h 的流速进行洗脱,并测定流出液中多糖的含量,计算解吸率。
1.3.6.6 洗脱体积对多糖解吸率的影响
选取最优大孔树脂5份(10 cm3)装入柱中,冲洗后,分别加入4 mg/mL的样品溶液40 mL,以2 BV/h通过层析柱,吸附完全后,用40%乙醇溶液以2BV/h的速度进行洗脱,前5BV(50mL)流出液每隔5mL检测一次多糖含量,后5 BV每隔10 mL检测一次,计算解吸率。
1.3.6.7 验证性试验
在上述单因素试验最佳条件下,以金线莲多糖的回收率、蛋白去除率和色素去除率为考察指标,进行3次平行试验。计算平均值和相对标准偏差(relative standard deviation,RSD)值。
1.3.7 金线莲多糖纯度的测定
将纯化后的金线莲多糖溶液冷冻干燥后,测定金线莲多糖含量,计算公式如式(6)所示。
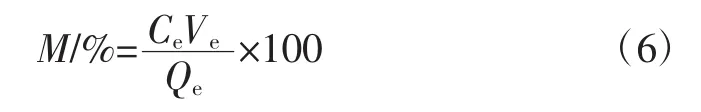
式中:M为多糖含量,%;Ce为洗脱液的多糖浓度,mg/mL;Ve为洗脱液的体积,mL;Qe为洗脱液干燥后的多糖质量,g。
1.3.8 抗氧化活性研究
根据马黄璜等[30],唐楠楠等[31]的方法,分别配制浓度为 0.05、0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 样品溶液,以VC作为对照组,分别在517 nm和510 nm波长处测定其吸光度,分析纯化前后金线莲多糖对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)和羟基自由基(·OH)的清除作用来探究其抗氧化活性。
1.4 数据处理
各理化指标测定3次,求取平均值和标准差。使用Origin 2018进行数据分析处理和绘制图表。
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
如图1所示,曲线的回归方程:y=1.38x,相关系数R2=0.999 4,在0~0.7 mg/mL范围内线性关系良好,适用于多糖含量的测定。
2.2 蛋白质标准曲线
蛋白质标准曲线见图2。
如图2所示,曲线的回归方程:y=5.38x+0.561,R2=0.999 5,在0.02 mg/mL~0.12 mg/mL范围内线性关系良好,适用于多糖中蛋白质含量测定。

图2 蛋白质标准曲线Fig.2 Standard curve of protein
2.3 色素检测波长的确定
金线莲多糖色素检测全波长扫描见图3。

图3 金线莲多糖色素检测全波长扫描图Fig.3 Full-wavelength scanning image of polysaccharide pigment detection of ARPs
由图3可知,多糖所含色素在415 nm处有最大吸收波长,且周围圆滑对称,故选用415 nm为检测波长,用来测定多糖中色素含量。
2.4 大孔树脂的筛选
大孔树脂的筛选结果见图4。

图4 不同类型树脂处理后的多糖吸附率、多糖解吸率、色素去除率和蛋白去除率Fig.4 Polysaccharides adsorption rate,polysaccharides desorption rate,pigment removal rate and protein removal rate after treatment with different types of resin
由图4可知,HPD-400的多糖解吸率高达99%,但吸附率太低,使树脂用量增加导致成本升高。大孔树脂X-5的多糖吸附率最高,解吸率也高于90%。因此,根据各项指标结果,选择X-5大孔树脂为纯化多糖的最佳树脂。
2.5 大孔树脂动态吸附多糖单因素的影响结果
2.5.1 上样浓度对多糖动态吸附的影响
上样浓度对多糖动态吸附影响见图5。

图5 上样浓度对多糖动态吸附的影响Fig.5 Effect of loading concentration on dynamic adsorption of resin
由图5可知,上样浓度对多糖吸附率影响较大,吸附率随上样浓度增大呈先升高后下降的趋势,上样浓度为4 mg/mL时吸附率最高,为74.02%;之后吸附率下降,可能是由于多糖中杂质增多,与多糖竞争吸附多糖位点。故最佳上样浓度为4 mg/mL。
2.5.2 上样流速对多糖动态吸附的影响
上样流速对多糖动态吸附影响见图6。
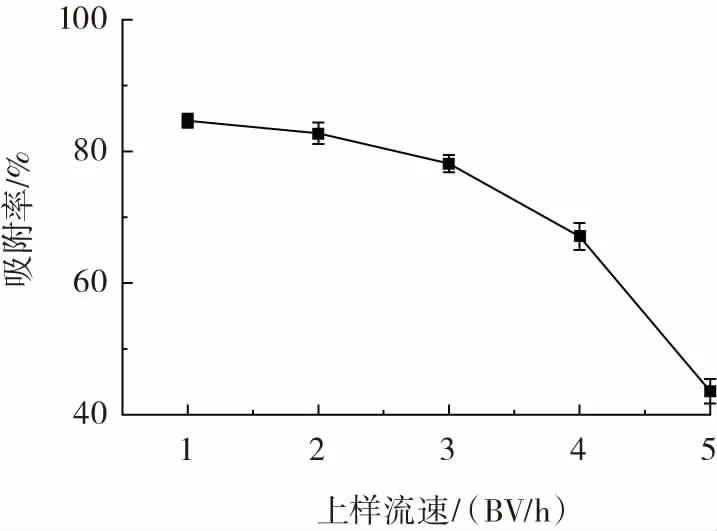
图6 上样流速对多糖动态吸附的影响Fig.6 Effect of loading velocity on dynamic adsorption of resin
由图6可知,上样流速对多糖吸附率的影响较大,上样流速越大,多糖的吸附率越小。上样流速过快,多糖未被充分吸附就流出层析柱,使吸附率减少;而流速较慢时,多糖可被充分吸附,使吸附率增加,但导致时间成本增加。由图6可知,2 BV/h的吸附率与1BV/h相差不大,都在80%以上,故上样流速为2 BV/h较适宜。
2.5.3 上样体积对多糖动态吸附的影响
上样体积对多糖动态吸附见图7。
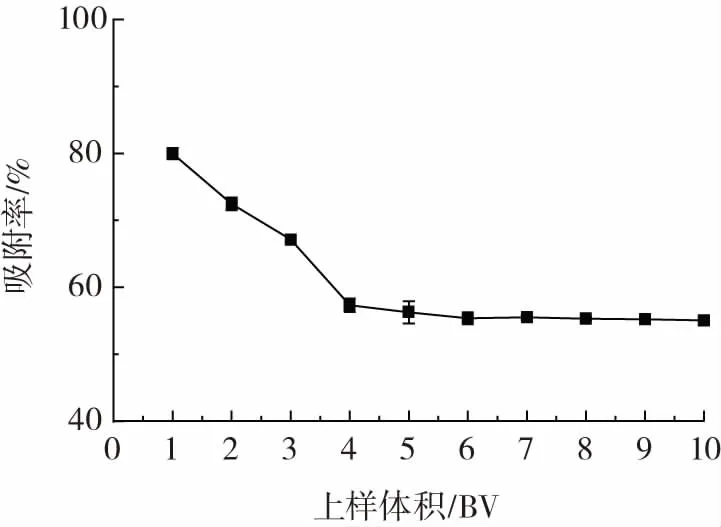
图7 上样体积对多糖动态吸附的影响Fig.7 Effect of loading volume on dynamic adsorption of resin
由图7可知,随着上样体积增大,每个相应柱体积的多糖吸附率逐渐降低并趋于平稳,上样量为1 BV时,吸附率最高,但树脂对多糖的吸附量较少(仅32mg);上样量为4BV时,树脂对多糖的吸附量较高(110.76mg);上样量大于4 BV时,虽然树脂会增加多糖的吸附量但其吸附率较低且趋于稳定,会使多糖损失量增加,由于原药材价格较高,从整个吸附量和成本考虑,上样量为4 BV时较为合适。
2.5.4 洗脱剂浓度对多糖解吸率的影响
洗脱剂浓度对多糖解吸率影响见图8。
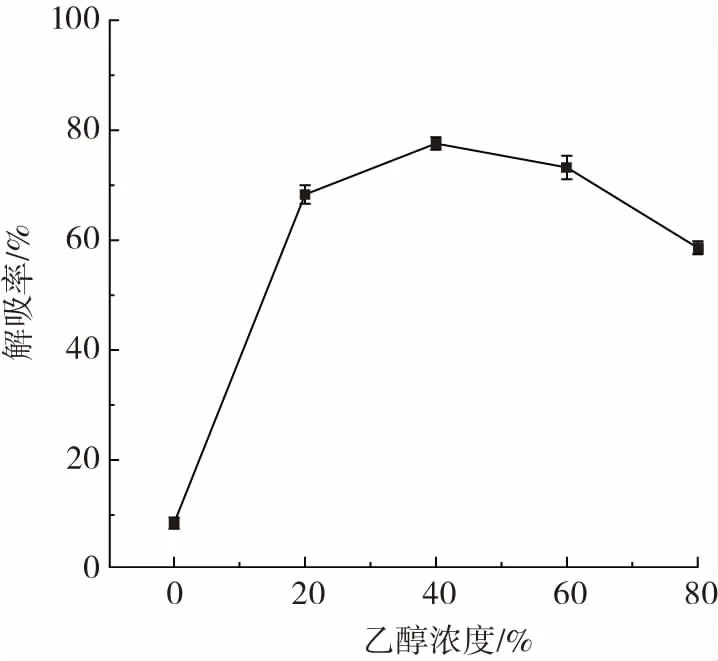
图8 洗脱剂浓度对多糖解吸率的影响Fig.8 Effect of ethanol concentration on dynamic desorption of resin
由图8可知,解吸的多糖主要集中在20%、40%、60%乙醇溶液中,且随着乙醇浓度的升高,解吸率出现先升高后下降的趋势,可能是由于高浓度乙醇会减弱多糖与树脂之间的作用力。当乙醇溶液为40%时,解吸率最大,为77.89%,故最佳洗脱剂浓度为40%乙醇溶液。
2.5.5 洗脱剂流速对多糖解吸率的影响
洗脱剂流速对多糖解吸率影响见图9。

图9 洗脱剂流速对多糖解吸率的影响Fig.9 Effect of elution velocity on dynamic desorption of resin
由图9可知,洗脱流速与多糖解吸率成反比,洗脱流速过快,导致洗脱液不能充分接触树脂使解吸率降低。在1 BV/h和2 BV/h洗脱流速下,两者解吸率在统计学上无显著性差异,考虑到流速过慢会延长纯化周期而增加成本;故洗脱流速为2 BV/h较适宜。
2.5.6 洗脱体积对多糖解吸率的影响
洗脱体积对解吸率影响见图10。

图10 洗脱体积对解吸率的影响Fig.10 Effect of elution dose on dynamic desorption of resin
图10所示,随洗脱体积增加,多糖解吸率逐渐增加并趋于平稳;解吸的多糖主要集中在前5 BV(50 mL)的洗脱液中,5 BV时解吸率达到91.17%,多糖基本被完全洗脱下来;当洗脱体积大于5 BV时,与前5 BV的解吸率在统计学上无显著性差异(P>0.05),且会造成溶剂浪费并增加洗脱时间,故洗脱体积为5 BV较适宜。
2.6 验证性试验
按照上述最佳条件纯化后,多糖回收率分别为66.05%、67.25%、65.24%,平均值为66.18%,RSD值为1.53%;蛋白去除率分别为71.01%、68.72%、69.43%,平均值为69.72%,RSD值为1.68%;色素去除率分别为57.41%,54.68%和56.41%,平均值为56.16%,RSD值为2.45%;表明重复性较好。
2.7 金线莲多糖含量的测定
经X-5大孔树脂纯化后,金线莲多糖含量由27.88%提高到76.07%。
2.8 抗氧化活性研究
2.8.1 纯化前后金线莲多糖对DPPH·清除能力的影响
金线莲多糖对DPPH·清除率影响见图11。
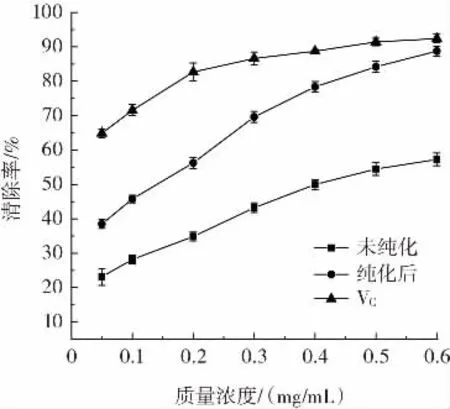
图11 金线莲多糖对DPPH·清除率的影响Fig.11 Polysaccharides from Anoectochilus roxburghii for scavenging effect of DPPH·
由图11所示,纯化前后的多糖对DPPH·有不同的清除能力,在质量浓度0.05 mg/mL~0.6 mg/mL范围内,多糖和VC随质量浓度的增加,对DPPH·清除能力先增强后趋于稳定。其中,纯化后多糖对DPPH·清除率远远高于纯化前,略低于VC;当纯化后多糖质量浓度为0.6 mg/mL时,纯化后多糖对DPPH·清除率为86.24%,基本趋于稳定。
2.8.2 纯化前后金线莲多糖对·OH清除能力的影响
金线莲多糖对·OH清除率影响见图12。

图12 金线莲多糖对·OH清除率的影响Fig.12 Polysaccharides from Anoectochilus roxburghii for scavenging effect of·OH
由图12所示,VC对·OH清除能力最强,且随浓度上升清除能力变化较小,多糖在质量浓度0.05 mg/mL~0.6 mg/mL范围内随浓度增加,对·OH的清除能力逐渐增强;当多糖的质量浓度为0.6 mg/mL,纯化后多糖对·OH清除率为88.63%,远高于纯化前,略低于VC,纯化后效果明显。
3 结论
本研究利用大孔树脂对色素、蛋白质、多糖吸附的差异,再通过洗脱达到纯化多糖的目的;通过静态吸附-解吸试验得出X-5为分离纯化金线莲多糖的最佳大孔树脂;纯化后金线莲多糖颜色由深褐色变为浅棕色,粉末也更加均匀,含量从27.88%提高到76.07%。此外,抗氧化活性结果还表明,金线莲多糖对DPPH·和·OH有一定的清除能力,虽不及VC,但纯化后的金线莲多糖清除能力显著增加:当浓度为0.6 mg/mL时,对DPPH·的清除率从57.27%提高至86.24%,对·OH的清除率从60.12%提高至88.63%,抗氧化活性明显提高。
经大孔树脂纯化后,金线莲多糖的含量虽有较大提高,但仍是总多糖,还需进一步探究在提高金线莲多糖含量的基础上如何分离出具有明确结构的单成分多糖。
