超声波-乙醇法提取藜麦黄酮类物质及其对金黄色葡萄球菌的抑制作用
2021-11-06孙永杰方小磊张兴华胡楠楠尤丽新
孙永杰,方小磊,张兴华,胡楠楠,尤丽新
(长春科技学院,吉林长春130600)
藜麦(Chenopodium quinoa Willd.)发源于安第斯山区,是一种营养丰富的食物。藜麦中黄酮类物质特别丰富,其中主要包括黄酮醇、槲皮素、山奈酚等[1]。由于其黄酮类物质含量的丰富性,越来越多的研究人员开始对其提取过程、工艺优化及其产品应用展开一系列研究。如张永花[2]以引种的山西藜麦为研究对象,对黎麦种子总黄酮进行了提取。但现有研究普遍存在黄酮类物质得率不高的问题。
金黄色葡萄球菌(Staphylococcus aureus)产生的毒性剧烈,对食品行业造成巨大威胁[3]。面对这样的现状,许多的研究人员开始转向对金黄色葡萄球菌天然抑菌剂的研究,陈国妮[4]在对马齿苋黄酮类化合物抑菌机理研究时发现,黄酮类化合物以促使细菌细胞膜裂解的方式,使细菌失去活性,产生抑菌效果。谭才邓等[5]对金黄色葡萄球菌抑菌试验的抑菌圈法进行比较研究时得出,通过对纸片法、打孔法、牛津杯法等定性试验方法进行比较,打孔法所得到的抑菌圈在清晰程度、重复性等方面具有明显优势,应该作为定性试验的优先选择方案。
本试验旨在改进藜麦黄酮类物质提取工艺的条件及参数以达到更高的黄酮类物质得率,并研究其提取物对金黄色葡萄球菌的抑制效果,以期为藜麦黄酮类物质的得率提升、天然活性抑菌剂的开发提供更多理论依据。
1 材料与方法
1.1 试验材料
金黄色葡萄球菌ATCC6538(Staphylococcus aureus):招远拓普生物工程有限公司。藜麦:吉林省通榆市藜麦种植基地。
无水乙醇:无锡东能化工科技有限公司;氢氧化钠:沧州峰林化工产品有限公司;亚硝酸钠:天津市致远化学试剂有限公司;硝酸铝:天津市永大化学试剂有限公司;芦丁标准品(纯度98%):上海金穗生物科技有限公司;蛋白胨:天津市龙腾化学试剂有限公司;牛肉膏:北京陆桥技术有限责任公司;氯化钠:潍坊玉鼎化工有限公司;氯化钾、磷酸二氢钾:上海华正化学试剂厂;琼脂、磷酸二氢钾:武汉丰竹林化学科技有限公司;磷酸二氢钾:潍坊市晨阳化工有限公司;硝酸钾:北京奥博星生物技术有限责任公司;牛肉粉:天津市华东试剂厂。以上试剂均为分析纯。
1.2 试验设备
DGG-914OA电热恒温鼓风干燥箱:郑州辰星仪器设备有限公司;DFY-1000C高速粉碎机:大德药机有限公司;SKY2103-1高速气流粉碎机:上海人和科学仪器有限公司;LANYI-650E超声波细胞粉碎机:上海兰仪实业有限公司;T6新世纪紫外可见光分光光度计:山东晨拓科学仪器有限公司;PHS-25精密数显酸度计:上海双旭电子有限公司;SPX-400生化培养箱:山东博科生物产业有限公司。
1.3 试验方法
1.3.1 藜麦黄酮类物质的提取
1.3.1.1 藜麦种子预处理
用电子天平称取若干份的藜麦种子各150g,在电热鼓风干燥箱65℃的温度条件下进行脱水干燥,期间多次观察检查,以确保脱水程度。干燥完成之后,置于常温干燥箱中。待其温度下降之后,用高速粉碎机将烘干的藜麦种子进行粉碎,控制粉碎程度。过80目筛,再进行高速气流粉碎[6-7]。将粉末按照编号组别收集完全,确保每组100g的粉末量,完成后立即放进硅胶干燥室备用。
1.3.1.2 超声波辅助提取与分离
将干燥室的藜麦粉末取出,用78%乙醇溶液,按1∶52(g/mL)的料液比,对粉末进行浸泡。将混悬液连同烧杯放入超声波细胞粉碎机,在230 W的功率条件下提取28 min。达标之后,打开抽气泵装置,将混悬液缓缓倒入进行分离,视分离出液体的澄清度适当调整分离次数,最终得到澄清的藜麦黄酮类物质提取液,在510 nm的波长下测定吸光度。
1.3.2 单因素试验
以料液比、超声波功率、乙醇浓度、超声波浸提时间作为主要影响因素,对各个因素选取5个不同水平[料液比 1∶44、1∶48、1∶52、1∶56、1∶60(g/mL),超声波功率 200、215、230、245、260 W,乙醇浓度 70%、74%、78%、82%、86%,超声波浸提时间 20、24、28、32、36 min]进行单因素试验。
1.3.3 正交试验
根据单因素试验的结果,以藜麦黄酮类物质的得率作为参考指标,对料液比、超声波功率、乙醇浓度、超声波浸提时间4个因素进行考察,进行L9(34)正交试验,以确定其最佳的工艺条件。因素水平见表1。

表1 正交试验水平Table 1 Orthogonal test leve
1.3.4 标准芦丁曲线绘制
准备已清洗干燥的30 mL试管6支,分别对6支试管进行编号,按顺序在各支试管中加入0.1 mg/mL的芦丁标准溶液 0、2.0、4.0、6.0、8.0、10.0 mL,再分别加78%的乙醇溶液至10 mL。在各支试管中分别加入等量的5%亚硝酸溶液0.6 mL,等待6 min,再分别加入0.6 mL的10%硝酸铝溶液,静置6 min,加入1.0 mol/L的氢氧化钠溶液8 mL,立即混匀,最后在各试管中加入78%的乙醇溶液0.8 mL,静置15 min,在510 nm的波长条件下,用紫外可见分光光度计测定其吸光度,绘制标准芦丁曲线[8]。根据下面公式测定藜麦黄酮类物质得率。

式中:C为样液浓度,μg/mL;V0为样液定容后的体积,mL;V1为测定吸光度用样液的体积,mL;V2为测定时稀释体积,mL;W为称取样品质量,g。
1.3.5 抑菌试验
1.3.5.1 菌种活化
在净化工作台无菌条件下,打开金黄色葡萄球菌冻干菌种管,加入10mL在高压蒸汽灭菌锅121℃、20min条件下灭菌的营养肉汤,用灭菌吸管反复吹打,使其分散均匀。用移液枪从中吸取10 μL,加入另一支5 mL营养肉汤培养基的试管并混匀,37℃培养18 h。培养结束后,用接种环取少量划线于营养琼脂培养基平板,在37℃培养18 h。用接种环挑取平板上生长良好的典型菌落,划线于另一支营养琼脂培养基斜面,37℃培养18 h后,得到其三代培养物。
1.3.5.2 菌液制备
选择培养后菌落生长形态良好的金黄色葡萄球菌第三代培养物斜面,在净化工作台无菌条件下,用10 mL的移液枪加入配制好的磷酸盐缓冲液(phosphate buffer saline,PBS)5 mL,浸没斜面以上,用接种环将斜面的金黄色葡萄球菌菌苔刮下,充分振荡。用灭菌吸管将混悬液吸出,移入另一只灭菌洁净试管,用电动混合器混合均匀。将初步制成的菌悬液比照0.5麦氏浊度,用PBS缓冲液进行10倍梯度稀释,以保证菌浓度在1×106cfu/mL左右。
1.3.5.3 藜麦黄酮提取液的准备
将初步提取得到的藜麦黄酮提取液通过60℃减压浓缩方式,分别浓缩 480、32、38、44 mg/100 mL 4组不同浓度,前一组用于微量二倍稀释法测最小抑菌浓度(minimum inhibitory concentration,MIC)值,后3组作为打孔法抑菌圈测定的3组不同浓度的提取液。浓缩完成后,分组收集于不同的三角瓶中,每组标上编号,用封口膜封口,放入4℃冰箱保存备用。
1.3.5.4 打孔法测量抑菌圈直径
将高压灭菌的培养基移入60℃水浴锅中冷却,擦拭酒精棉,移入超净台。平板中加入100 μL浓度为1×106cfu/mL的菌液,各加入15 mL左右的培养基,轻微振荡平板,以保证培养基与菌液充分混合,使金黄色葡萄球菌均匀地分散在培养基中。混匀后,使其自然冷却凝固,待其凝固完全后备用。用100 μL枪头在平板中垂直打孔,每板打孔3个,分为1组。打完孔后,向每孔注入0.5 mL准备好的藜麦黄酮提取液[9-10]。同时设置一组未加藜麦黄酮提取液的平板作为阳性对照组,37℃培养18 h。培养完成后,观察抑菌圈,用游标卡尺测量其抑菌圈的直径并记录。
1.3.5.5 微量二倍稀释法
在超净台无菌条件下,用移液枪在96孔板前5排均加入100 μL的肉汤,吸取制备好的藜麦黄酮提取液100μL加入第一排第一孔,再从中吸出一半加入第二孔,进行二倍稀释,依次由前一孔移出100μL到后一孔,最后一孔吸出100μL舍去,即每孔对应的藜麦黄酮提取液浓度分别为 240.000、120.000、60.000、30.000、15.000、7.500、3.750、1.875、0.938、0.469、0.234、0.117 mg/100 mL,最后分别加入1×106cfu/mL浓度的菌液10 μL,重复两排,所有操作同上。设第4排为阴性对照组,即除无菌液加入之外其他余操作同上,设第5排为阳性对照组,操作同上,第12列为每排的空白对照。于600 nm波长下测出各孔初始吸光度,全部完成之后,37℃条件下培养18 h。培养结束后,以同样的方式测出600 nm波长下各孔吸光度,前后的吸光度差值作为判定标准,ΔA>0.2视作有菌生长,最小无菌生长孔对应的藜麦黄酮提取液浓度则为其对金黄色葡萄球菌的最小抑菌浓度即MIC值。
2 结果与分析
2.1 标准芦丁曲线测定
标准曲线见图1。

图1 标准芦丁曲线Fig.1 Standard rutin curve
由图1可得,y=0.125 1x-0.126的拟合公式,其拟合系数R2已达到0.999 9,说明绘制而成的标准芦丁曲线具有较高的线性相关性。
2.2 单因素试验结果
2.2.1 料液比对藜麦黄酮类物质得率的影响
料液比对藜麦黄酮类物质得率的影响见图2。

图2 料液比对藜麦黄酮类物质得率的影响Fig.2 Effect of solid-liquid ratio on the yield of quinoa flavonoids
由图2可知,黄酮类物质得率和料液比呈现出正向关系,而在料液比到达1∶52(g/mL)之后,正向关系不再显著,即使料液比中提取液的比例再增加,其对黄酮类物质得率的提升作用并不明显。这可能是因为,试验选择的提取液为乙醇溶液,当藜麦黄酮类物质在提取液中的扩散达到平衡时,再增加提取液的加入量也无法对黄酮类物质的溶出产生明显的促进作用。因此基于经济节约的选择,最终选择料液比1∶52(g/mL)进行正交试验。
2.2.2 超声波功率对藜麦黄酮类物质得率的影响
超声波功率对藜麦黄酮类物质得率的影响见图3。

图3 超声波功率对藜麦黄酮类物质得率的影响Fig.3 Effect of ultrasonic power on the yield of quinoa flavonoids
由图3可知,功率从200 W到230 W的变化阶段,黄酮类物质得率明显升高,但功率到达230 W之后,黄酮类物质得率和超声波功率却开始出现负向关系。这可能是因为超声功率增大,其空化阈值也随之升高,空化不易产生,且已空化的气泡无充分时间发生爆裂,空化强度减弱。综合考虑,最终选择超声波功率230 W进行正交试验。
2.2.3 超声波浸提时间对藜麦黄酮类物质得率的影响
超声波浸提时间对藜麦黄酮类物质得率的影响见图4。
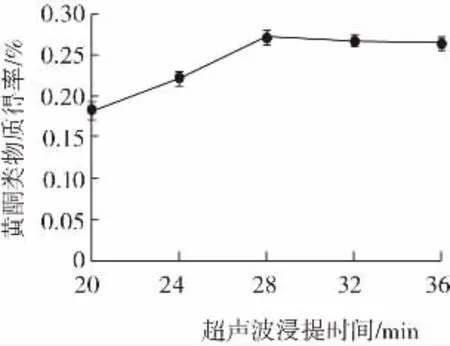
图4 超声波浸提时间对藜麦黄酮类物质得率的影响Fig.4 Effect of ultrasonic extraction time on the yield of quinoa flavonoids
由图4可知,超声波浸提时间与黄酮类物质得率呈现正向关系,而到达28 min之后,即使提取时间再延长,黄酮类物质得率不再上升,甚至后期略微有所下降。这可能是因为提取时间延长使得藜麦中的其他一些醇溶性物质溶出,如酚类、生物碱等,这些物质会竞争性的和乙醇溶液结合,而使黄酮类物质的结合位点减少。所以最终选择以超声波提取时间28 min进行正交试验。
2.2.4 乙醇浓度对藜麦黄酮类物质得率的影响
乙醇浓度对藜麦黄酮类物质得率的影响见图5。

图5 乙醇浓度对藜麦黄酮类物质得率的影响Fig.5 Effect of ethanol concentration on yield of flavonoids in quinoa
由图5可知,在乙醇浓度到达78%之前,两者呈现正向关系,而在78%后,乙醇浓度与黄酮类物质得率开始出现负向关系,呈现下降趋势。这可能是因为乙醇浓度过高使得藜麦中除了黄酮类物质以外的其他醇溶性生物活性物质大量溶出,使得黄酮类物质在提取液干物质中占比减少。综合考虑,以78%乙醇浓度进行正交试验。
2.3 正交试验结果分析
对4个因素,料液比、超声波功率、乙醇浓度、超声波浸提时间进行分析,每个因素分别选取3个水平进行L9(34)正交试验,以藜麦黄酮类物质的得率为参考依据,确定各因素的最佳参数条件,从而实现工艺优化,获得更高的得率。正交试验结果见表2。

表2 正交试验结果Table 2 Orthogonal test results
由表2,将各个因素的极差值大小进行对比,乙醇浓度对黄酮类物质得率影响最强,而超声波浸提时间对黄酮类物质得率的影响最弱,影响性排序为D>B>A>C。通过正交试验结果,最优组合为A2B3C2D2,然而该组合并未在9组正交试验范围内,所以需要对该组合进行进一步的验证试验。
2.4 验证试验
对由正交试验得出的最优组合A2B3C2D2进行验证试验,见表3。

表3 验证试验Table 3 Verification test
根据验证试验结果,比较A2B3C2D2、A2B3C1D2两种组合,以黄酮类物质得率为判定依据,最终选择A2B3C1D2组合,即料液比为 1∶52(g/mL),超声波功率245 W,乙醇浓度78%,超声波浸提时间24 min,在该参数条件下,黄酮类物质得率达到了0.280%。
2.5 藜麦黄酮类物质对金黄色葡萄球菌抑菌效果评价
2.5.1 抑菌圈测量结果
藜麦黄酮类物质抑菌圈直径测定见表4。
由表4可知,藜麦黄酮类物质具有明显的抑制作用,并且两者呈现正向关系,抑菌作用随着黄酮类物质浓度的增大而显著增强。

表4 藜麦黄酮类物质抑菌圈直径测定Table 4 Determination of bacteriostatic zone diameter of quinoa flavonoids mm
2.5.2 二倍稀释法测得MIC值
96U型孔板每孔吸光度前后差值见表5。

表5 96U型孔板每孔吸光度前后差值Table 5 Absorbance difference before and after each hole of 96U orifice plate
由表5可知,第6孔即藜麦黄酮类物质浓度在7.500 mg/mL时,ΔA值刚好<0.2,浓度升高其ΔA值减小,浓度降低其ΔA值增大,综上所述,藜麦黄酮类物质的提取液对金黄色葡萄球菌的最小抑菌浓度MIC值为7.500 mg/mL。藜麦黄酮类物质的提取液采用60℃减压浓缩方式进行制备,其中的乙醇溶液基本挥发完全,因此由乙醇产生的抑菌效应可以忽略不计。
3 结论
在料液比为 1∶52(g/mL),超声波功率 245 W,乙醇浓度78%、超声波浸提时间24min的工艺条件下,藜麦黄酮类物质的得率最高,达到了0.280%。通过打孔法对抑菌圈进行测定,藜麦黄酮类物质乙醇提取液与抑菌效果呈现出正向作用,抑菌效果随着黄酮类物质浓度的递增表现出明显的增强态势,在藜麦黄酮类物质浓度达到44 mg/100 g时,其抑菌圈直径可达11.3 mm。通过二倍稀释法测金黄色葡萄球菌的MIC值,得出藜麦黄酮类物质的乙醇提取液对金黄色葡萄球菌的最小抑菌浓度MIC值为7.500 mg/mL。
