G蛋白偶联受体在运动调控动脉舒张过程中的机制
2021-11-06于凤至刘淑卉
于凤至 ,孙 朋 *,刘淑卉
心血管疾病(cardiovascular disease,CVD)已成为导致人类死亡的主要诱因,每年CVD致死人数约占全球死亡人数的31%(Sanada et al.,2018)。据世界卫生组织(World Health Organization,WTO)评估预测,2030年约有2 500万人死于心血管疾病(Mahmood et al.,2014)。动脉僵硬度是预测心血管事件发生和死亡的独立风险因素,动脉僵硬度的增加主要由动脉壁结构异常引起。其中,内皮依赖性血管舒张功能受损是引发动脉硬化的关键因素(Gimbrone et al.,2016)。因此,改善动脉舒张功能是降低CVD发生率和死亡率的有效途径。
G蛋白偶联受体(G protein-coupled receptor,GPCR)是位于血管内皮细胞(vascular endothelial cell,VEC)与血管平滑肌细胞(vascular smooth muscle cell,VSMC)上的膜受体,是内皮源性因子的主要作用靶点。研究表明,运动既可通过GPCR调控内皮源性血管因子如一氧化氮(nitric oxide,NO)、前列环素(prostacyclin,PGI2)、内皮素-1(endothe lin-1,ET-1)和血管紧张素II(angiotensin II,Ang II)等的表达水平(Bunsawat et al.,2017;De Beer et al.,2011;Hasegawa et al.,2018),也可增强某些GPCR如α1肾上腺能受体(α1 adrenergic receptor,α1AR)、内皮素受体-A(andothelin receptor type A,ETA)和血管紧张素受体-1(angiotensin II type 1 receptor,AT1R)等的表达量和敏感性,继而调控内皮源性血管因子进入血管平滑肌细胞,引起动脉舒缩反应(Bar‐rett-O’keefe et al.,2015;Li et al.,2012,2017)。
1 GPCR结构功能与信号通路
1.1 结构与功能
GPCR又称为7次跨膜(7 transmembrane,7TM)螺旋受体,包括游离胞外N端和游离胞内C端,是人体最大的跨膜蛋白家族。人类基因组编码超过800个GPCR,其结构和功能多样化,涉及多种生理功能调控和病理发展进程,包括心血管系统(Kaur et al.,2017)、视觉(Jastrzebska et al.,2017)、味觉(Raka et al.,2019)、嗅觉(Katidou et al.,2018)、行为和情绪(Grammatopoulos,2017)、免疫系统(Sharma et al.,2013)、自主神经系统(Poole et al.,2016)、细胞密度和稳态(Hazell et al.,2012)以及肿瘤的生长和转移(Nassios et al.,2019)等。由于GPCR对多种化学调节剂具有亲和力,因此目前已上市的靶向GPCR的药物占所有人类蛋白质药物的12%,约占现代药物的34%(Hauser et al.,2017;Santos et al.,2017)。
1.2 信号通路
不同GPCR可识别不同的配体,包括离子、胺、核苷酸、多肽、蛋白质、脂类、有机气味剂和光子等(Weis et al.,2018)。GPCR胞质部分具有高度动态的胞内裂隙,可容纳信号伴侣,其中包括异源三聚体G蛋白、GPCR激酶(G pro‐tein coupled receptor kinase,GRK)和β-抑制蛋白(β-arres‐tin)在内的胞内蛋白可与GPCR结合,启动细胞内信号级联(Garcia-Nafria et al.,2018;Jean-Charles et al.,2017;Ko‐molov et al.,2018)。
异源三聚体G蛋白是GPCR信号传导中的关键蛋白家族,由α、β和γ亚基组成,后两者称为Gβγ二聚体(Wu et al.,2019)。无活性的G蛋白在其Gα亚基中结合GDP。活化的GPCR通过募集G蛋白并将与其结合的GDP转换为GTP,从而引起G蛋白的构象变化。随后Gα亚基与结合的GTP共同从Gβγ二聚体解离。游离Gα可激活效应分子,如腺苷酸环化酶(adenylate cyclase,AC),其在活化后可催化ATP转化为cAMP,cAMP是许多生物反应过程中重要的第二信使。Gβγ二聚体还可以激活钾通道或磷脂酶的效应因子用于下游信号传导(Wu et al.,2019)。GRK属于AGC家族(蛋白激酶A、G和C),GRK能够通过磷酸化GPCR胞内C端从而抑制GPCR胞内的下游信号通路(Gurevich et al.,2019)。β-arrestin是一类小蛋白质家族,是G蛋白信号转导终止和GPCR介导的抑制信号转导过程必需的蛋白分子(Peterson et al.,2017)。β-arrestin通过GRK的磷酸化激活GPCR使G蛋白信号转导终止。β-arrestin的募集和激活需要GPCR磷酸化,使G蛋白与受体分离并触发受体内化,引发 β-arrestin介导的信号级联反应(Gurevich et al.,2013)(图1)。
2 GPCR调控血管内皮功能的机制
GPCR作为心血管系统中一类多样性细胞膜受体,可响应不同的外部信号,如剪切应力、激素和内皮源性因子,继而调节内皮功能和血管张力。如β-AR和Ang II等受体的拮抗剂,被广泛用于治疗高血压、冠心病和心力衰竭等心血管疾病(Kauffenstein et al.,2012)。研究发现,GPCR广泛分布在VEC和VSMC膜上(Kaur et al.,2017)。不同的信号分子或配体与GPCR结合可调节G蛋白的活性,并激活下游相关通路。具体机制包括Gαs和Gαi影响AC活化以调节细胞内cAMP水平;Gαq可激活磷脂酶C(phospholi‐pases C,PLC),增加细胞内Ca2+浓度;β-arrestin/GRK途径可激活下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇三激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB即Akt)等信号通路,对动脉血管的生成、发育和舒缩产生直接或间接的影响(表1)。
2.1 GPCR调控内皮源性因子的机制
研究表明,VEC分泌的内皮源性舒血管因子(endothe‐lial-derived relaxation factor,EDRF)和内皮源性缩血管因子(endothelium-derived constriction factor,EDCF)是 GPCR 下游效应因子。此外,EDRF和EDCF又可在VSMC中作为上游激活因子,通过GPCR调控VSMC的舒缩功能。
2.1.1 EDRF
NO、PGI2和内皮源性超极化因子(endothelium-derived hyperpolarizing factor,EDHF)是由VEC分泌的具有血管舒张特性的内源性介质(Taneja et al.,2019)。VEC膜上GP‐CR(如P2Y、P2X和P1)信号的激活,能够促进EDRF的合成与释放(Burnstock,2016)。研究发现,位于VEC上的CaSR能够感知血流动力学变化,促进NO合成(Guo et al.,2018)。ET-1可与分布在VEC上的内皮素受体-B(endo‐thelin receptor type B,ETB)结合,促进NO的释放(Mosquei‐ra et al.,2019)。NO与可溶性鸟苷酸环化酶(guanylate cy‐clase,GC)结合,随后将GTP分解为cGMP,进一步激活蛋白激酶G(protein kinase G,PKG)的下信号,引起肌球蛋白轻链(myosin light chain,MLC)的去磷酸化,从而调节VSMC的舒张(Donald et al.,2015)。
PGI2的受体分为舒张型受体(IP、DP1、EP2和EP4)和收缩型受体(EP1、EP3、FP 和TP)(Del et al.,2017)。PGI2主要与分布在全身组织中并富集于血小板和VSMC上的IP受体结合(Mitchell et al.,2008)。IP受体激活后可引起AC活化,促进ATP转化为cAMP,其继续使PKA磷酸化,最终导致靶细胞(包括VSMC和血小板)中Ca2+减少,引起血管舒张(Humbert et al.,2016)。
EDHF相关信号通路包括中间电导钙激活钾通道(in‐termediate-conductance Ca2+activated K+channel,IKCa)和小电导钙激活钾通道(small conductance Ca2+activated K+channel,SKCa)。VEC上受体与激动剂结合或受到剪切应力刺激后,引起VEC中Ca2+浓度增加,导致IKCa和SKCa的激活,诱发VSMC超极化,从而使其松弛(Leung et al.,2017)。Kozlowska等(2007)认为,VEC和VSMC之间的缝隙连接也参与内皮依赖性超极化。Feletou等(2009)研究发现,哺乳动物大动脉的血管舒张主要依赖于NO/cGMP途径,但在微动脉和小动脉中,NO信号减弱,EDHF是介导内皮依赖性血管舒张的主要因素(图2)。2.1.2 EDCF
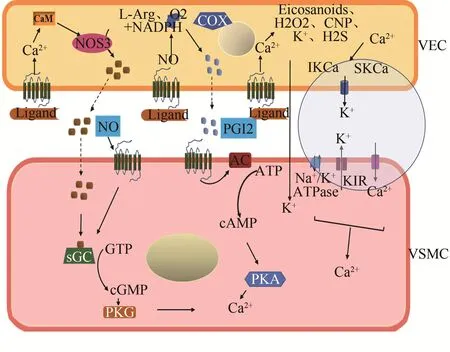
图2 GPCR与内皮源性舒血管因子(EDRF)相关信号通路Figure 2. GPCR and Endothelial-Derived Relaxation Factor(EDRF)-Related Signaling Pathway
ET-1通过肽酶(ET转换酶和其他肽酶)由非活性前体多肽加工而成,主要在VEC中合成,也在VSMC中少量合成(Vatter et al.,2011)。ET-1有两个细胞表面受体ETA和ETB,均属于GPCR超家族(Dhaun et al.,2019)。ET-1与VSMC上的ETA和ETB受体结合激活异源三聚体鸟嘌呤核苷酸结合蛋白,如Gαq是ETA受体的最佳表征信号转导物(Lin et al.,2014)。ETA和ETB的具体作用机制尚未完全阐明,但其重要功能包括诱导血管收缩,心肌肥厚和重构,细胞增殖,细胞外基质生成以及控制水钠代谢等(Rodriguez-Pascual et al.,2011)。
Ang II在肺中通过血管紧张素转换酶(angiotensin converting enzyme,ACE)由Ang I转化而来,是一种有效的血管收缩剂(Passos-Silva et al.,2013)。已知Ang II至少与两种不同的受体亚型结合,即AT1R和AT2R(Kaschi‐na et al.,2017),且两受体之间存在拮抗作用。Ang II与AT1R结合通过Gαq信号通路,激活磷脂酶C,导致MLC的Ca2+依赖性磷酸化(Patel et al.,2018),Ang II与AT1R结合还可激活MAPK通路,上调胞内Ca2+水平,从而引起血管收缩(Savoia et al.,2011)。
血栓素A2(thromboxane A2,TXA2)属于二十烷酸类,由磷脂产生,可促进血小板聚集,参与血管收缩和增殖过程(Smyth,2010)。TXA2的受体TP是GPCR超家族成员,在血小板、VEC、VSMC、单核细胞、巨噬细胞,肾脏、心脏和脾脏细胞等多种细胞中均有表达。目前已发现两种TP亚型,即TPα 和 TPβ(O’Sullivan et al.,2017)。接受刺激后,TP 受体可通过Gαq、G11、G12、G13、G15、G16、Gαi、Gαs和Gh等多种G蛋白诱导下游信号通路,调节效应因子,如PLC、AC和Rho蛋白(Nakahata,2008),参与多种信号级联,促进cAMP等第二信使合成,改变Ca2+浓度,引起血管收缩(图3)。
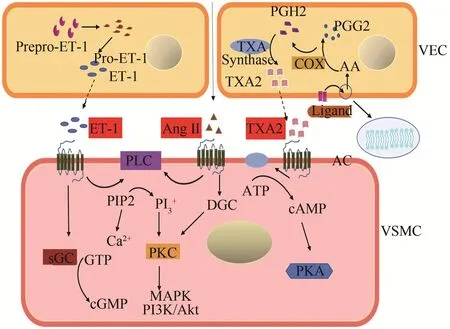
图3 GPCR与内皮源性缩血管因子(EDCF)相关信号通路Figure 3. GPCR and Endothelium-Derived Constriction Factor(EDCF)-Related Signaling Pathway
3 GPCR在运动调控动脉功能中的机制
3.1 运动调控动脉功能
血流量和剪切应力的变化会引起动脉重构,而这种反应依赖于完整功能内皮层的存在(Tinken et al.,2010),VEC在血管张力和血压调节中也发挥重要作用(Hellsten et al.,2012)。Green等(2017,2018)研究发现,运动引起的血流动力学变化能够对动脉舒缩产生直接或间接的影响,运动通过调控VEC和VSMC的功能引起动脉产生适应性变化。研究表明,运动可延缓与年龄相关的动脉病变发生,中低强度的有氧运动可防止久坐的中老年人大动脉硬化和血管内皮功能障碍,并降低动脉僵硬度,恢复血管内皮功能(Santos-Parker et al.,2014)。也有研究报道,运动训练能够降低动脉硬化人群的动脉僵硬度,增加动脉顺应性(Li et al.,2015)。孙朋等(2012,2014)研究发现,急性有氧运动能够引起颈动脉顺应性的降低,该变化存在性别间的差异。另有研究发现,大强度抗阻运动能够降低动脉顺应性,增加动脉僵硬度,低强度抗阻运动能显著提高动脉顺应性,并降低动脉僵硬度(Okamoto et al.,2014)。综上,不同形式的运动可导致动脉压力、血流和剪切应力发生改变,最终引起动脉舒张功能和僵硬度的相应变化(表2)。
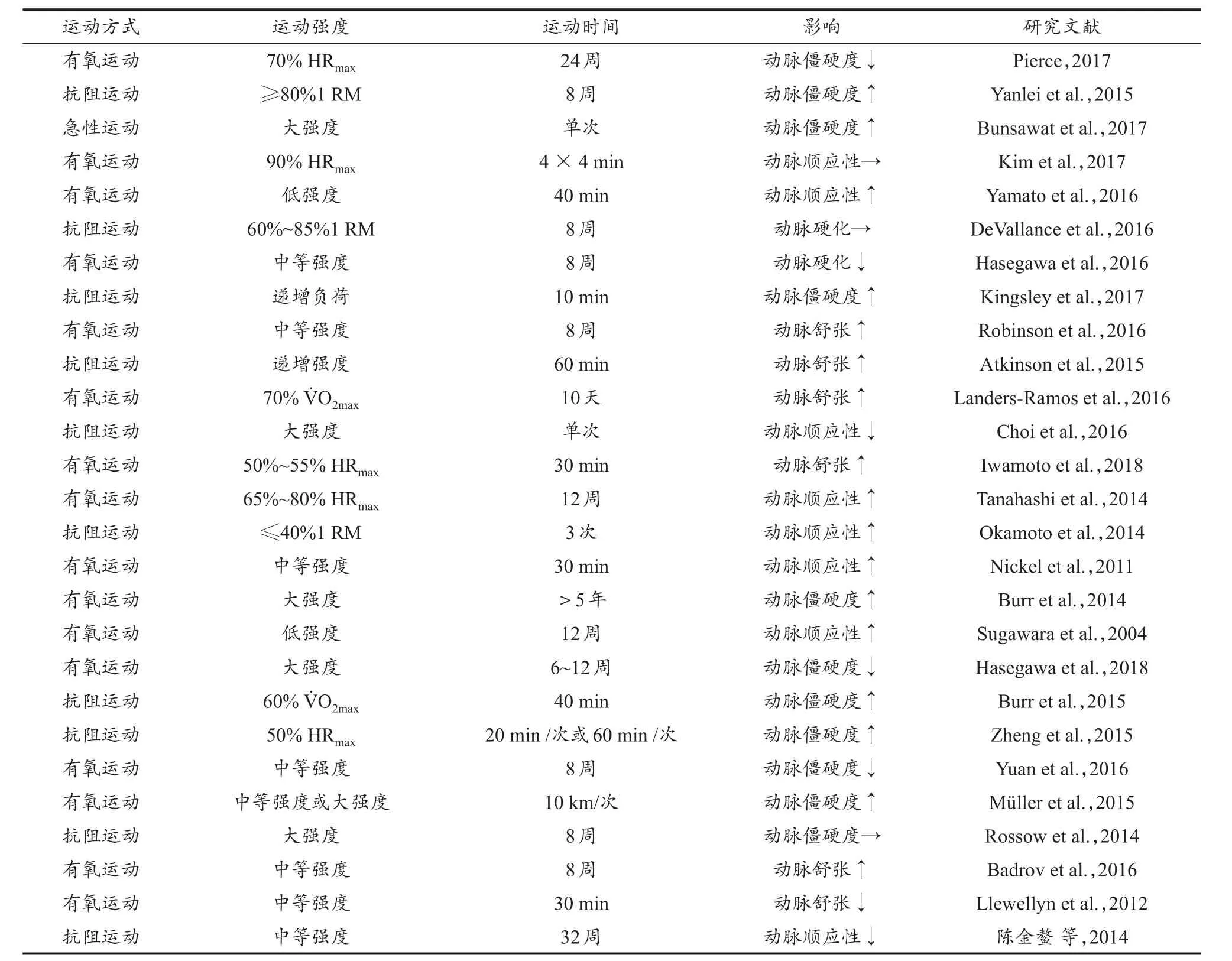
表2 运动对动脉功能的影响Table 2 Regulation ofArterial Function by Exercise
3.2 GPCR在运动调控动脉舒张功能中的作用
研究发现,运动可以通过调节激素水平和血流动力学等指标激活位于VEC和VSMC膜上的GPCR,使其与胞内的G蛋白偶联,进一步激活胞内下游通路,从而对动脉舒张功能进行调节(Paiva et al.,2016)(表 3)。Morland 等(2017)研究发现,高强度间歇运动(每周5天,连续7周)可引起循环血乳酸水平升高,上调小鼠脑血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)表达,并引起毛细血管密度的增加。Li等(2017)研究发现,8周中等强度跑台运动可导致大鼠动脉壁平滑肌和心肌细胞中Ang II mRNA表达量增加,AT1R表达量显著减少,从而引起冠状动脉扩张。Leosco等(2008)研究显示,10周跑台运动能够激活成年雄性心力衰竭大鼠心脏VEGF下游信号,同时促进血管生成,改善缺血后心力衰竭大鼠心脏中β-AR信号,引起血管舒张。Li等(2012)研究发现,成年雄性大鼠进行2周力竭性游泳运动,可抑制颈动脉P2X1受体活化引起的血管收缩反应,减少肺部、肠系膜动脉和主动脉中由于α1AR激活而导致的血管收缩。目前,鲜见运动通过GPCR调控动脉舒缩功能的研究较少,仍需后续实验进一步探究。
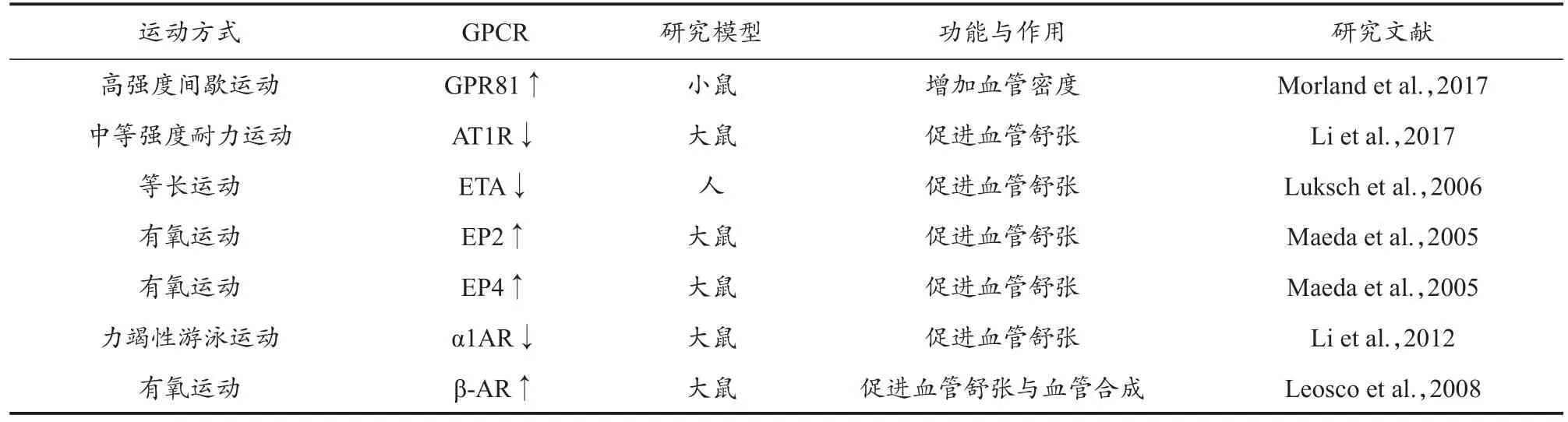
表3 运动对GPCR的调控Table 3 Exercise Regulation of GPCR
3.2.1 运动通过GPCR对EDRF的调控
运动能够通过引起心率或/和每搏输出量的增加,提高心输出量,从而引起血流动力学的改变,增强血流对血管壁的剪切应力,激活CaSR等压力感受器促进NO的释放并引起平滑肌舒张(Kimura et al.,2016)。Hasegawa等(2018)研究发现,6周高强度间歇运动和有氧运动均可激活健康成年男性和雄性大鼠的eNOS信号,增加NO的合成,并提高主动脉平滑肌细胞NO的生物利用率,降低中心动脉的僵硬度。研究表明,绝经后妇女血栓形成风险增加,定期有氧运动能够有效提高绝经后妇女血小板对PGI2的敏感性,抑制血小板聚集,运动可通过增强PGI2对血小板的作用,降低动脉硬化的程度(Lundberg et al.,2017)。Maeda等(2005)通过microarray基因表达分析结果发现,4周跑台运动能够显著上调PGI2受体EP2、EP4、C型钠尿肽和eNOS基因的表达量,促进下游cAMP的合成,增加Ca2+浓度,引起VSMC的极性舒张。血流介导的动脉舒张(flow-mediated dilation,FMD)被广泛用于评价内皮功能和NO释放率(Ashor et al.,2015)。Gunduz等(2011)研究表明,8周游泳运动能够显著改善自发性高血压大鼠FMD,但用四乙胺(TEA,EDHF抑制剂)处理后能够减弱该表型,提示运动训练增强血流引起的动脉舒张部分是通过EDHF相关机制介导的。石丽君等(2012)研究发现,长期规律有氧运动可以诱导大鼠胸主动脉平滑肌细胞BKCa通道活性增加,在运动强度和持续时间一致的情况下,表现出频次依赖特性。另有研究Ozkor等(2015)研究发现,握力训练可增加受试者前臂血管血流量,改善高胆固醇患者的血管舒张功能障碍。综上,有氧运动可显著提高EDRF水平及其受体敏感性,促进血管舒张,但抗阻运动对EDRF影响的具体分子机制目前尚不明确(图4)。
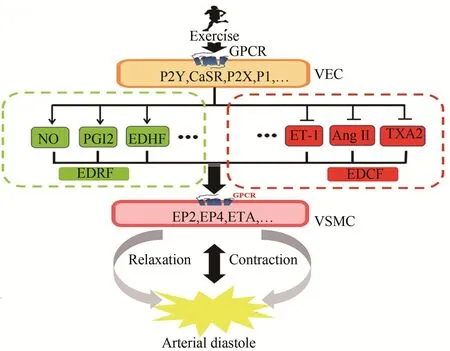
图4 GPCR在运动调控动脉舒张功能中的作用Figure 4. The Role of GPCR in Exercise Regulation ofArterial Diastolic Function
3.2.2 运动通过GPCR对EDCF的调控
Brunani等(2017)研究发现,急性运动可导致肥胖人群ET-1浓度显著降低。而3个月规律性有氧运动可抑制25名超重或肥胖成人ET-1介导的血管收缩,提示运动降低ET-1浓度可能是内皮依赖性血管舒张功能改善的重要机制(Dow et al.,2017)。研究表明,ET-1主要通过激活ETA介导静息外周血管收缩活动,Barrett-O’Keefe等(2015)对健康成年人进行半卧位功率自行车运动干预,并在过程中施用BQ-123(ETA阻滞剂),研究显示工作肌中动脉血流量显著增加,同时血管张力也明显增强。De Beer等(2011)研究发现,中等强度持续性运动可减少哺乳动物冠状动脉ET的产生量,减弱ET介导的冠状动脉收缩程度。此外,运动可抑制肾素-血管紧张素系统(re‐nin-angiotensin system,RAS)激活,减少血浆Ang II含量,下调左心室ACE-AngII-AT1R轴,减轻心肌细胞氧化应激,降低动脉血压(Silva et al.,2017)。Lee等(2015)研究发现,12周跑台运动可显著抑制大鼠增龄相关的AT1R和Nox2信号上调。Wray等(2008)发现,老年人单次功率自行车运动过程中VSMC对Ang II的敏感性降低,血管收缩活动减少,股总动脉直径增加,腿部血流量增加。Kara‐mouzis等(2001)采用微透析技术研究发现,有氧运动可引起健康成年人PGE2和PGI2的上调,以及TXA2的下调,且运动强度越大效果越为明显。Leal等(2011)研究发现,阻断TP受体可减弱模拟外周动脉疾病模型大鼠的运动压力反射。可知,运动可通过降低EDCF的生成与受体敏感性,抑制血管收缩(图4)。
4 总结
GPCR是广泛分布在动脉VEC与VSMC上的七次跨膜受体,是调节动脉收缩与舒张的重要蛋白。本研究系统综述了GPCR在运动调控VEC分泌内皮源性血管因子的相关机制,以及内皮源性血管因子调控VSMC膜上GP‐CR的相关通路,并进一步梳理了运动调节动脉舒张的可能机制。研究发现,不同运动形式可以通过直接和/或间接方式激活VEC膜上的GPCR,通过下游经典通路如Gαs、Gαq、Gαi和β-arrestin等引起胞内下游信号的转导,调控内皮源性舒血管因子NO、PGI2、EDHF和内皮源性缩血管因子ET-1、Ang II、TXA2等表达。相关内皮源性因子通过旁分泌功能与VSMC膜上的GPCR结合,引起GPCR构象的变化,并激活胞内下游信号,最终调节平滑肌的收缩和舒张功能。虽然近50%的现代药物都是以GPCR为靶点,其在现代药物开发中占据极其重要的地位,但是鲜见运动通过不同GPCR信号调控动脉功能的研究。不同运动处方通过不同GPCR信号通调控动脉功能的具体机制,需进一步探究和补充。
