可逆波循环伏安图的测定及碳纳米管修饰电极对维生素C的电催化检测
——介绍一个电化学综合实验
2021-11-05王琨琦任真纪晓娜左妍杨焕欣
王琨琦,任真,纪晓娜,左妍,杨焕欣
长春工程学院理学院,长春 130012
循环伏安法是最重要的电分析化学研究方法之一,其主要优点有:操作简单、快速、自动化程度高、重复和再现性好、测定结果准确、灵敏度高、仪器价格低廉,因此在电化学、无机化学、有机化学、生物化学等研究领域广泛应用。应用循环伏安技术,工作电极的修饰起着至关重要的作用,20世纪70年代中期,化学方法修饰电极作为一门新兴的技术快速发展起来,截至目前其也是电化学和电分析化学研究中最活跃的部分。它是通过化学修饰的方法在电极表面进行分子设计,将具有优良化学性质的分子、离子、聚合物固定在电极表面,造成某种微结构,赋予电极某种特定的化学和电化学性质,在分析测试过程中提高选择性和灵敏度两方面展现出独特的优越性[1]。在化学修饰电极备选材料中,碳纳米管由于其独特的电学性能、明显的量子效应、大的比表面积、高稳定性以及强吸附等特性被使用于化学修饰电极。本实验利用裸玻碳电极结合Randles-Sevcik公式,在1 mmol·L−1K3Fe(CN)6体系中获得了可逆波循环伏安图,同时计算电极的有效面积。采用滴涂法将多壁碳纳米管修饰于裸玻碳电极上,进一步完成碳纳米管修饰电极有效面积的测算,对比电极修饰前、后有效面积可知,碳纳米管修饰电极可将电极的有效面积提高1.5倍,利用该修饰电极对药片维C检测获得其纯度为85%。我们设计的这一电化学综合实验在实验内容上展现了循环伏安电化学理论到实践应用的巧妙构思,实验进程上展现出简单、易重复的鲜明特色,这两点对于本科综合实验课程来讲难能可贵,方便为其他本科院校开设综合实验课程提供思路参考。另外,通过本综合实验课程的学习,增加了学生的学习兴趣,坚定了学生的学习信心,提升了学生的实践实验操作水平,激发了学生从事科学研究的热情。依托本实验,学生发现问题、分析问题和解决问题的能力得以充分的培养。
1 实验目的
1) 学习和掌握循环伏安法的原理和实验技术。
2) 掌握可逆波循环伏安图的特性以及测算电极有效面积的方法。
3) 学习和掌握碳纳米管修饰电极的制备方法及利用其进行维生素C检测的实验技术。
4) 培养学生发现问题、分析问题和解决问题的能力,提高学生的科研热情。
2 实验原理
循环伏安法是一种常用的电化学研究方法,控制电极电势以不同的速率,将对称的三角波扫描电压加在固定面积的工作电极和参比电极之间,电势范围内使电极上交替发生不同的氧化和还原反应,记录工作电极上得到的电流与施加电位的关系曲线,即循环伏安图,如本实验在1 mmol·L−1K3Fe(CN)6体系中测得图1所示曲线。根据Randles-Sevcik公式[2](在25 °C时)计算电极的有效面积:

图1 可逆波循环伏安图

式(1)中,A为电极的有效面积,cm2;D0为反应物的扩散系数,cm2·s−1;n为电极反应的电子转移数;v为扫描速度,V·s−1;c0为反应物的浓度,mol·s−3;ip为峰电流,A。另外,由于碳纳米管表面带有较多的功能基团,可以对某些物质的电化学行为产生特有的催化效应,维生素C的检测就是基于此。
3 实验内容
1) 可逆波循环伏安图的测定及电极有效面积的测算。
2) 碳纳米管修饰电极对抗坏血酸的电催化响应。
3) 碳纳米管修饰电极对药片维生素C的电催化检测。
4 实验部分
4.1 仪器
CHI602A电化学工作站1台(上海晨华);铂片对电极1支(红色);玻碳工作电极1支(d= 4 mm) (天津艾达,绿色);饱和甘汞参比电极1支(天津艾达,白色);50 mL三孔电解槽1个;20 μL数字电动移液器(大龙仪器有限公司) ;抛光布1片;50 mL烧杯1个;100 mL容量瓶5个;洗瓶1个;KQ5200E型超声波清洗器(江苏省昆山市);电子天平1台;红外灯1台。
4.2 试剂
铁氰化钾(K3Fe(CN)6,分析纯,上海试剂一厂);氯化钾(KCl,分析纯,分北京化工厂);十二水合磷酸氢二钠(NaH2PO4·12H2O,分析纯,北京化工厂);二水合磷酸二氢钠(Na2HPO4·2H2O,分析纯,西陇化工股份有限公司);抗坏血酸(C6H806,分析纯,北京化工厂);N,N-二甲基甲酰胺(HCON(CH3)2,分析纯,天津天泰精细化学品有限公司);多壁碳纳米管(直径20–30 nm,先丰纳米XFNAN0,INC);三氧化二铝粉抛光粉;蒸馏水(优普系列超纯水机UPR-11-15TNZP制备);维生素C片(东北制药集团沈阳第一制药有限公司)。
5 实验步骤
5.1 溶液配制
5.1.1 配制1 mmol∙L−1K3Fe(CN)6和0.1 mol∙L−1KCl混合溶液
称取0.0329 g K3Fe(CN)6,0.7456 g KCl,蒸馏水溶解后定容到100 mL容量瓶。
5.1.2 配制100 mL 0.1 mol∙L−1pH = 5.8的磷酸盐(PBS)缓冲溶液
称取2.58 g NaH2PO4·2H2O,0.44 g Na2HPO4·12H2O,蒸馏水溶解后定容到100 mL容量瓶中。
5.1.3 配制1 mmol∙L−1的抗坏血酸溶液
称取0.176 g抗坏血酸,蒸馏水溶解后定容到100 mL容量瓶中,取出10 mL溶液稀释至100 mL容量瓶中。
5.1.4 配制维生素C溶液
取维生素C一片(50.0 mg),蒸馏水溶解后定容到100 mL容量瓶中。
5.1.5 配制碳纳米管分散液
5.0 mg碳纳米管溶于5 mLN,N-二甲基甲酰胺溶液,超声分散30 min,每次使用前超声分散均匀[3]。
5.2 电极处理
将新的玻碳电极表面先经金刚砂纸粗研和细磨后,再用不同粒径的Al2O3粉在抛光布上进行抛光。抛光后先洗去表面污物,再移入超声波中清洗,每次1–2 min,重复三次,直至清洗干净。
5.3 碳纳米管修饰电极的制备
取20 μL超声30 min的碳纳米管分散液滴在清洗干净的玻碳电极表面,用红外灯烤干。
5.4 搭建电化学三电极体系
按如图2所示,将1 mmol·L−1K3Fe(CN)6溶液移入50 mL三孔电解池中,依次连接裸玻碳工作电极(绿色),饱和甘汞参比电极(白色),铂片对电极(红色),并测定裸玻碳电极的氧化还原峰电位和电流值[3]。
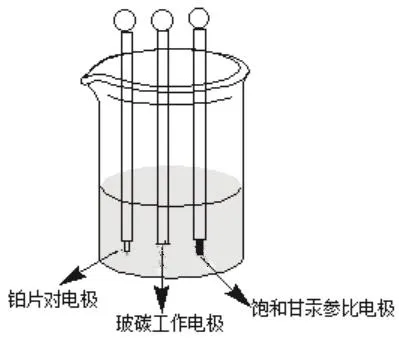
图2 电极装置图
5.5 操作电化学工作站
开启电化学工作站及计算机电源开关,启动电化学程序,选择循环伏安法CV,设定参数Parameter,输入表1中所示参数。
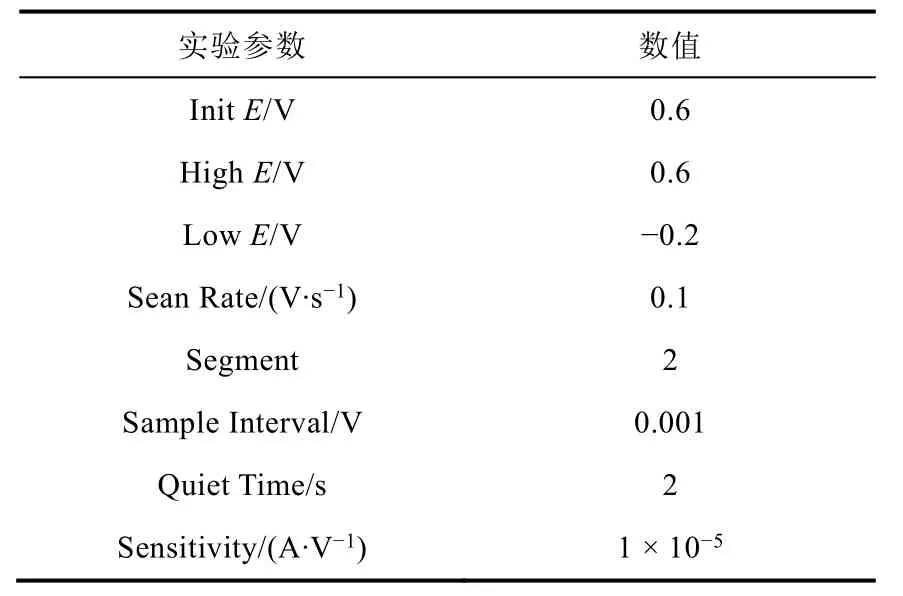
表1 电化学程序中参数设置
点击运行电化学工作站,开始扫描,将实验数据存盘后,记录氧化还原峰电位Epc、Epa及峰电流Ipc、Ipa。改变扫描速度为0.10、0.14、0.18、0.22、0.26和0.30 V·s−1,分别作循环伏安图,将上述循环伏安图叠加比较。
5.6 碳纳米管修饰电极的循环伏安曲线测定
将制备好的碳纳米管修饰电极取代玻碳电极按照上述实验步骤5.4–5.5进行循环伏安扫描,记录不同扫描速率下碳纳米管修饰电极的氧化还原峰电位Epc、Epa及峰电流Ipc、Ipa,并保存谱图。
5.7 碳纳米管修饰电极对抗坏血酸及药品维生素C片的测定
室温下,将50 mL三孔电解槽通入高纯氮气除氧15–25 min,采用碳纳米管修饰电极为工作电极,在−0.4 – 0.4 V范围内,100 mV·s−1的扫速下,于不用浓度的抗坏血酸PBS溶液及维生素C片-PBS溶液中进行循环伏安测试。
6 实验结果与讨论
6.1 可逆波循环伏安叠加图的绘制
以1 mmol·L−1K3Fe(CN)6溶液作为支持电解质,在电位窗为−0.2 – 0.7 V的范围内,裸玻碳电极分别在扫描速度为0.10、0.14、0.18、0.22、0.26和0.30 V·s−1时,进行循环伏安测试,将所得实验数据填入表2;曲线叠加于图3中。
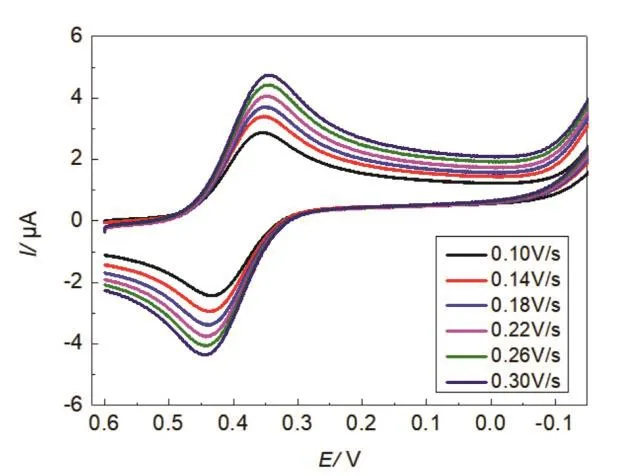
图3 扫描速度为0.10、0.14、0.18、0.22、0.26、0.30 V∙s−1的循环伏安叠加图

表2 裸玻碳电极循环伏安测试数据表
由表2数据和图3可知:尽管扫描速率发生了改变,但是每一条曲线其阴极、阳极峰都表现出互相对称的特性,且当扫描速率为0.10 V·s−1时,两峰电流值之比约等于1,Ipc/Ipa= 0.96 ≈ 1,电位差ΔEp= 77 mV,表明裸玻碳电极上发生了可逆的电化学反应,获得了一系列不同扫描速率的可逆波循环图。
6.2 计算裸玻碳电极和碳纳米管修饰电极的有效面积
根据Randles-Sevcik公式,ip= (2.69 × 105)n3/2AD01/2v1/2c0,其中K3Fe(CN)6的扩散系数D0= 1 × 10−5cm2·s−1;电子转移数n= 1[2],采用线性回归法分别计算出裸玻碳电极与碳纳米管修饰电极的有效面积分别是0.0940和0.1422 cm2,列入表2和表3中,裸玻碳电极经过碳纳米管修饰后其有效面积提高了1.5倍,裸玻碳电极、碳纳米管修饰电极峰电流与扫速平方根的线性回归关系如图4、图5所示。

表3 碳纳米管修饰电极循环伏安测试数据表
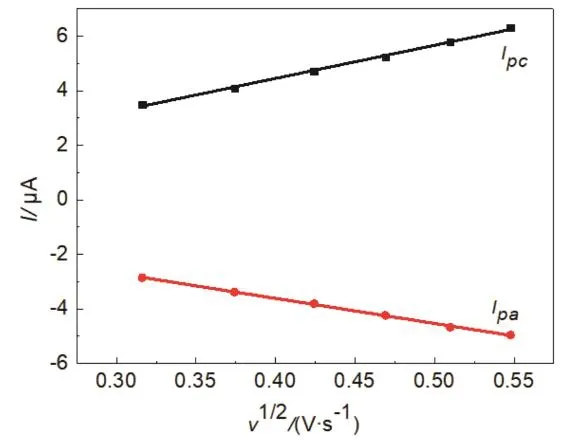
图4 裸玻碳电极峰电流与扫速平方根的线性关系
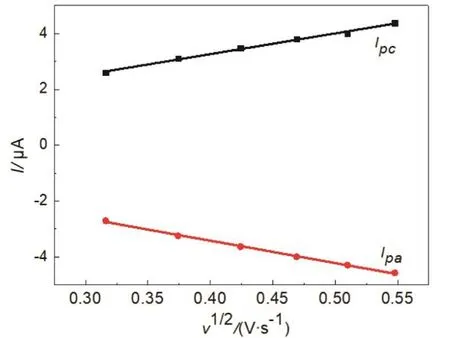
图5 碳纳米管修饰电极峰电流与扫速平方根的线性关系
6.3 碳纳米管修饰电极对抗坏血酸浓度及实际样品维生素C片的响应
碳纳米管修饰电极在0.1 mol·L−1PBS (pH = 5.8)的缓冲体系内,在电位窗为−0.4 – 0.44 V范围内,以0.1 V·s−1的扫描速度,改变抗坏血酸的浓度,进行循环伏安测试,所得峰电流与抗坏血酸浓度的关系如图6所示。其线性回归方程y= −5.47 × 10−5x− 1.01 × 10−5,其线性相关系数为0.984,线性范围为0.00–0.59 mmol·L−1,检出限为0.065 mmol·L−1。即峰电流与抗坏血酸浓度的线性相关。在上述实验条件下,对实际药品维生素C片进行检测,将检测结果回归于上述线性方程(见图6红色三角形),确定维生素C片的纯度为85.0%。
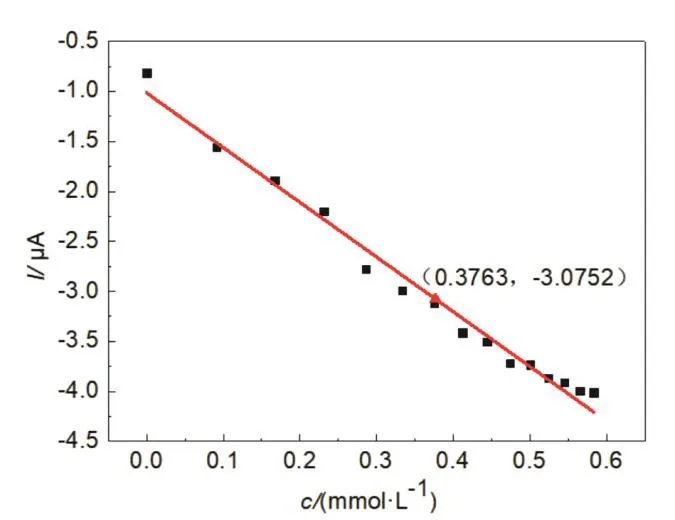
图6 峰电流与抗坏血酸浓度的线性关系
7 教学建议
1) 建议本综合实验分三个模块进行教学(大约8个小时)[4]:第一模块是清洗裸玻碳电极和测算裸玻碳电极的有效面积;第二模块是制备碳纳米管修饰电极和计算碳纳米管修饰电极的有效面积;第三模块是绘制维生素C标准曲线及对实际药品维生素C片的检测。
2) 本综合实验每个模块都可以成为一个独立的实验项目,也可以作为整体综合实验的一部分来进行,两种方式均可有效地培养学生综合实验能力。
3) 进行本综合实验时,要求学生自行设计实验方案,并以独立小组的方式进行实验,要求小组成员分工协作。在实验预习阶段,学生要先通过查阅期刊文献来了解循环伏安法的原理和特性以及测算电极有效面积的方法,其次了解碳纳米管修饰电极的制备方法,以便后续的实验能够顺利地开展,最后根据文献的调研成果,确定药品维生素C片检测的最优条件。
8 注意事项
1) 在使用超声波清洗玻碳电极时,时间应严格控制在1–2分钟内,超声时间不可过长。
2) 本实验使用药品和试剂都应为分析纯,实验用水应为蒸馏水,以防止杂质干扰电化学反应过程。
3) 碳纳米管修饰电极制备过程中,应保持碳纳米管分散体系均匀。
4) 实验中所用到的仪器都要严格按照操作说明书进行,并注意规范操作。
9 思考题
1) 如何通过循环伏安法测得的电极反应参数来判断电极反应的可逆程度?
2) 如何判断玻碳电极表面是否处理干净?
3) 为什么碳纳米管修饰电极在电分析化学中被广泛采用?
4) 未来哪些材料还可以用来制备电化学修饰电极?
5) 为什么电解槽在实验前要通入高纯度氮气15–25分钟?
10 结语
本文设计了一个电化学综合性实验,首先使用裸玻碳电极绘制出了可逆波循环伏安图,其次,利用Randles-Sevcik公式计算出裸玻碳电极和碳纳米管修饰电极的有效面积,通过碳纳米管修饰电极对维生素C的电催化作用,完成了对实际药品维生素C片的检测。实验发现:裸玻碳电极两峰的电流值近似相等(Ipc/Ipa= 0.96 ≈ 1),峰峰电位差ΔEp约为77 mV,循环伏安图的可逆效果良好。碳纳米管修饰电极的有效面积是裸玻碳电极有效面积的1.5倍。碳纳米管修饰电极对抗坏血酸可以产生线性响应,相关系数为0.984,实际药品维生素C片的纯度为85.0%。本实验综合性强,将电化学循环伏安法的原理、操作和应用知识充分融合,可以培养学生综合运用所学知识解决问题的能力,提高学生实践实验操作水平,激发学生科研热情,从而开拓学生创新性思维。
