紫外-可见分光光度法测定含铜废水中的铜离子
2021-11-05章子恒胡然马艺瑾孙兴蓉马思维朱忍曹秋娥周川华
章子恒,胡然,马艺瑾,孙兴蓉,马思维,朱忍,曹秋娥,周川华
云南大学化学科学与工程学院,化学化工国家级实验教学示范中心(云南大学),昆明 650091
在本科基础化学教学实验中,分析化学实验占有重要地位。其内容常包含分析化学基础实验与兼具应用性和综合性的创新实验[1]。目前,传统分析化学实验教学模式存在诸如学生学习被动、兴趣不强、缺乏创新意识等问题[2]。为紧跟学校教学改革的步伐,进行创新实验教学的初步探索,本文设计了一个仪器分析创新教学实验。该实验结合原有教学实验快速、准确的优点,并将新方法引入仪器分析实验教学中。这使其在呈现创新性的同时,也在一定程度上将相对新颖的科研成果与本科教学联系起来,令学生在学习及操作的过程中感受到科研的魅力,从而激发学生的学习热情与兴趣,进而充分提高学生的动手能力,培养具有科学思维方法和创新能力的人才[3]。
本实验基于芬顿反应(Fenton reaction),显色底物为3,3’,5,5’-四甲基联苯胺(TMB,3,3’,5,5’-Tetramethylbenzidine),采用紫外-可见分光光度法测定废水中铜离子的含量。
芬顿反应为无机人名反应之一,现今多用于污水处理、酶促反应、有机合成等诸多方面[4]。铁、铜、铝、铬等变价金属离子可作为芬顿反应的催化剂。其中,属铁基芬顿反应最为常见、应用最广;而铜基芬顿反应的反应速率更快,所适用的体系pH范围相对更宽[5]。基于该反应,可建立用于检测芬顿反应体系中各物质的分析方法,如:比色法[6];荧光光度法[7];化学发光法[8];分光光度法[9]等。
TMB常被用作酶促反应的显色底物[10],在临床生化检验等方面应用广泛。该物质安全绿色,适合本科实验使用。
金属铜是冶金工业、电镀工业的重要原料,该类行业常排放大量含铜废水[11]。废水中铜离子检测方法多样,如各类光谱法、色谱法等[12];电化学传感器[13]、荧光探针[14]等较为先进的手段亦可用于检测铜离子。本实验采用紫外-可见分光光度法检测铜离子,该方法是仪器分析教学的重要内容之一,且相对简单、易理解,适于本科教学。
根据芬顿反应氧化TMB,产生紫外-可见吸收的原理,本团队设计优化此实验,使之简单快捷,便于操作。该实验灵敏度较高、重现性好,满足本科教学实验基本要求。
本实验将催化反应引入本科教学实验,且无需使用价格昂贵、容易变性失活的生物酶,适用于本科教学。芬顿反应在实验设计上灵活多变,可以设计为检测不同物质(如过氧化氢、铜离子、铁离子等其他变价金属离子)的分析检测方法。不仅利于加深学生对于紫外-可见分光光度法的理解;还可作为设计实验,锻炼学生分析问题、解决问题的能力。本文将以铜离子检测为例,建立一种基于芬顿反应,采用紫外-可见分光光度法检测铜离子的本科教学实验。
1 实验部分
1.1 实验原理
1.1.1 铜基芬顿反应
Zhi Shan等[15]发现,氯离子可显著加速铜基芬顿反应,放大催化信号。在氯离子的加速作用下,铜离子催化过氧化氢,产生羟基自由基。

体系中羟基自由基将显色底物TMB氧化为蓝色的TMB+,后者在pH < 1的条件下,转变为稳定的TMB2+,如图1所示。TMB2+呈黄色,于452 nm附近有最大吸收。
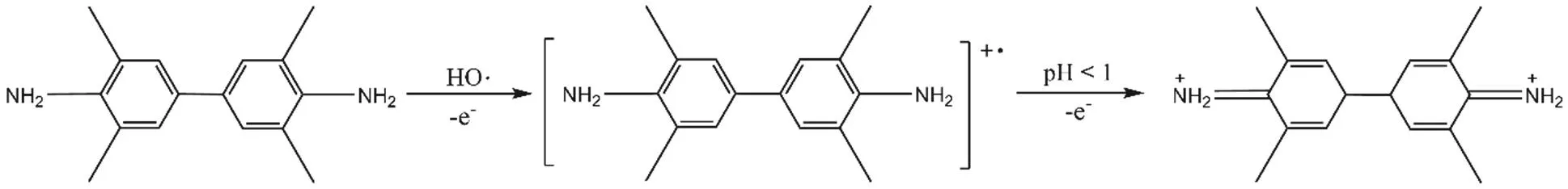
图1 TMB氧化机理示意图[16]
1.1.2 紫外-可见光度分析及定量原理
当平行单色光通过均匀、非散射的稀溶液时,溶液的吸光度与其浓度间的关系满足Lambert-Beer定律[17]。其中,κ为摩尔吸收系数,b为吸收池厚度。

在相同波长下,溶液中吸光物质一定时,吸光度A与溶液浓度c成正比。
配制系列铜离子标准溶液,将其与待测样品在相同底物条件下进行芬顿反应;反应完成后,测定各体系紫外-可见吸收光谱,记录最大吸收波长所对应的吸光度值;绘制标准曲线,将待测样品吸光度值代入工作曲线方程中,完成定量分析。
1.2 实验仪器与试剂
1.2.1 实验试剂
超纯水,无水乙醇(分析纯,天津化学试剂厂),硫酸铜储备液(以分析纯五水合硫酸铜配制,天津光复),氯化钾(分析纯,天津光复),3,3’,5,5’-四甲基联苯胺(分析纯,Adamas),过氧化氢(30%,西陇化工),硫酸(98%,西陇化工),0.1 mol∙L−1pH = 4.5 HAc-NaAc缓冲液(以分析纯冰乙酸及乙酸钠配制,天津化学试剂厂)。
1.2.2 实验仪器
UV-2600紫外-可见分光光度计(岛津,日本),SYG-2数显恒温水浴锅(朗越,中国),JP-010T超声波清洗机(洁盟,中国)。
1.3 实验步骤
1.3.1 反应试剂配制
1) 2.5、5.0、25.0 μmol∙L−1CuSO4∙5H2O储备液(由实验老师预先配制)。
2) 0.15 mol∙L−1KCl (aq)
准确称取1.1200 g KCl,在干燥的烧杯中加水溶解,转移至容量瓶,并用超纯水定容至100.00 mL,得0.15 mol∙L−1KCl (aq)。
3) 2.5 mmol∙L−1TMB
准确称取0.6000 g TMB于干燥烧杯中,加入适量无水乙醇,超声溶解,转移至100 mL容量瓶中,以无水乙醇定容,得25 mmol∙L−1TMB。再移取10.00 mL 25 mmol∙L−1TMB至100 mL容量瓶,以无水乙醇定容,最后得100.00 mL 2.5 mmol∙L−1TMB溶液。
4) 1.0 mol∙L−1H2O2
准确取10.00 mL 30% H2O2于容量瓶中,定容至100.00 mL,得1.0 mol∙L−1H2O2(aq)。
5) 5.5 mol∙L−1H2SO4
准确取30.00 mL 98% H2SO4于已加入了适量水的烧杯中,搅拌,冷至室温,转移至100 mL容量瓶,定容,最后得5.5 mol∙L−1H2SO4(aq)。
6) 模拟含铜废水样品(由实验老师预先配制,含铜6.0 μmol∙L−1)。
7) 0.1 mol∙L−1pH = 4.5 HAc-NaAc缓冲液(由实验老师预先配制)。
1.3.2 过氧化氢浓度对反应的影响
1) 取10个50 mL比色管,编号为空白、1–9。向各比色管中加入15.00 mL 5.0 μmol∙L−1Cu(II)、5.00 mL 0.15 mol∙L−1KCl (aq)、5.00 mL 2.5 mmol∙L−1TMB溶液,充分振荡摇匀。
2) 向1–9号中加入0.25、0.50、0.75、1.00、2.00、3.00、4.00、5.00、6.00 mL 1.0 mol∙L−1H2O2(aq),向空白组中加入5.00 mL超纯水,后快速以缓冲溶液定容至50.00 mL,充分摇匀。
3) 将各比色管置于40 °C下水浴加热30 min,每组独立计时。
4) 反应完成后立即取出各比色管,加入5.00 mL 5.5 mol∙L−1H2SO4(aq),终止反应,摇匀。
5) 测定各组紫外-可见吸收光谱,判断过氧化氢浓度对体系吸光度的影响情况。
1.3.3 反应动态过程测定
1) 取两个50 mL比色管,编号为1、2。向各比色管中加入15.00 mL 25 μmol∙L−1Cu(II)、5.00 mL 0.15 mol∙L−1KCl (aq)、5.00 mL 2.5 mmol∙L−1TMB溶液,充分振荡摇匀。
2) 向1号比色管中加入5.00 mL 1.0 mol∙L−1H2O2(aq),以缓冲溶液定容至50.00 mL,充分摇匀,并在室温下反应10 min后,测定紫外-可见吸收光谱,确定TMB+的最大吸收波长。
3) 向2号比色管中加入5.00 mL 1.0 mol∙L−1H2O2(aq),以缓冲溶液定容至50.00 mL,充分摇匀后,取1 mL该混合溶液加入比色皿中,测定混合溶液中TMB+最大吸收波长下的吸光度随时间变化曲线。
1.3.4 测定实验步骤
1) 取9个50 mL比色管,编号为空白、1–8,作为反应容器。其中,1–5号为标准系列(标准1–5);6、7、8号为三组平行样品(样品1–3)。
2) 向空白组中加入5.00 mL超纯水,1–5号分别加入5.00、10.00、15.00、20.00、25.00 mL,2.5 μmol∙L−1Cu(II)。
3) 向6–8组中各加入5.00 mL样品溶液。
4) 向各组中分别加入5.00 mL 0.15 mol∙L−1KCl (aq)。
5) 向各组中分别加入5.00 mL 2.5 mmol∙L−1TMB溶液,充分振荡摇匀。
6) 向各组中分别加入5.00 mL 1.0 mol∙L−1H2O2(aq),后快速以缓冲溶液定容至50.00 mL。
7) 上一步加入过氧化氢后,立即开始计时(每组独立计时,如表1所示),并逐组放入恒温水浴锅中,在40 °C下水浴加热30 min。

表1 实验计时方法
8) 各组反应完成后立即取出,迅速加入5.00 mL 5.5 mol∙L−1H2SO4(aq),以终止反应,充分摇匀。
9) 测定各组紫外-可见吸收光谱,绘制工作曲线,计算样品中铜离子含量。
1.3.5 计时方法实例
2 实验结果讨论
2.1 过氧化氢浓度的影响
铜基芬顿反应主要与反应温度、反应时间、过氧化氢浓度、TMB浓度以及Cu(II)的浓度等因素有关。本实验以过氧化氢为例,对实验影响因素进行优化。固定其他反应条件,测定不同浓度过氧化氢对芬顿反应的影响。实验结果如图2(a)所示,过氧化氢浓度在0.00至0.02 mol∙L−1范围内时,吸光度随浓度增加而增加;当过氧化氢浓度超过0.02 mol∙L−1后,体系吸光度基本保持稳定。
2.2 反应动力学曲线测定
TMB+的最大吸收波长为654 nm,在此波长下测定反应动力学曲线。实验结果如图2(b)所示,随着铜基芬顿反应的进行,体系中生成的TMB+逐渐增加,检测液654 nm处的吸光度逐渐增大。随时间的推移,动力学曲线的斜率缓慢降低,可能是由于随着催化反应的进行,底物H2O2的浓度降低,产物TMB+浓度增加,加速了逆反应的进行,因此催化反应速率有所下降。
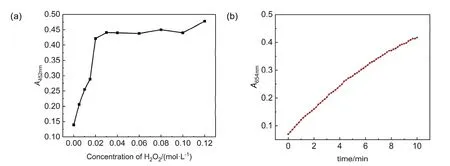
图2 过氧化氢浓度对体系吸光度的影响(a)及芬顿反应动力学曲线(b)
2.3 吸收曲线绘制(400–500 nm)
扫描1.3.4节中各组检测液的紫外-可见吸收光谱,实验结果如图3所示,检测液在452 nm处有最大吸收,且随检测液中铜离子含量增加,体系吸光度逐渐增大。
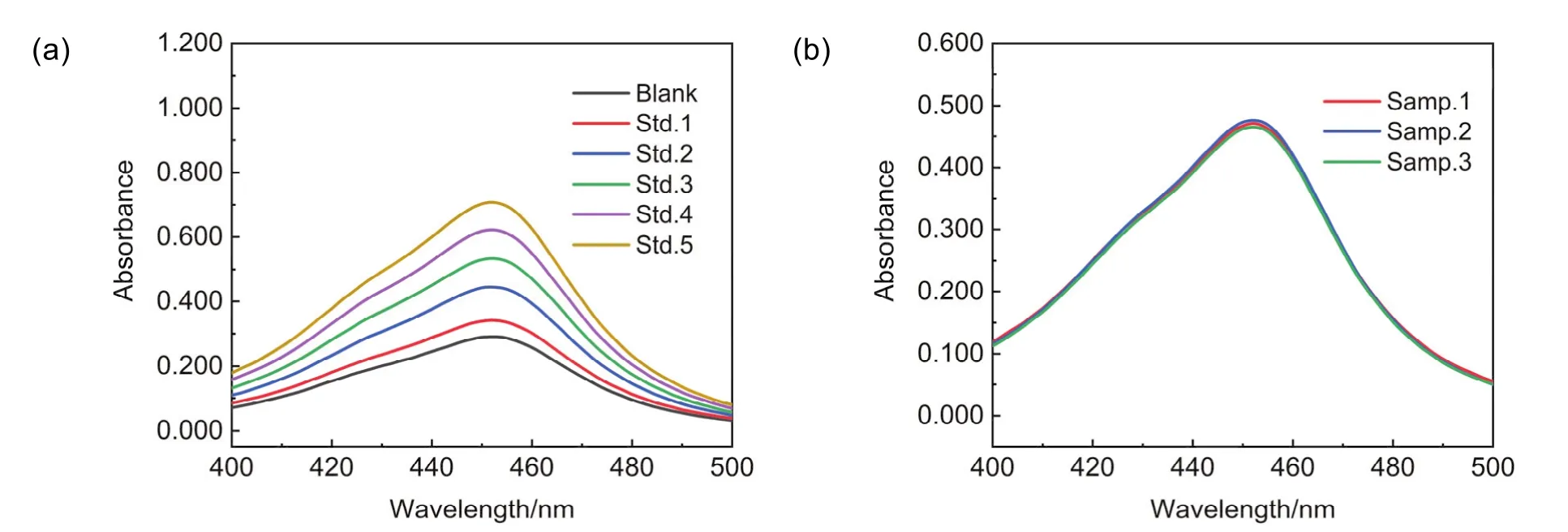
图3 采用芬顿反应体系检测不同铜离子标准溶液(a)及待测样品(b)的紫外-可见吸收光谱图
2.4 工作曲线绘制
由紫外-可见吸收光谱可知,体系最大吸收波长为452 nm。如表2所示,记录体系中铜离子终浓度(以体系为50.00 mL时计算)以及对应的检测液在452 nm处的吸光度值(A452nm)。并以A452nm作为纵坐标,铜离子浓度作为横坐标作图,绘制工作曲线(图4)。

图4 铜离子检测工作曲线

表2 标准溶液中铜离子浓度-吸光度数据表
工作曲线方程为y= 0.3636x+ 0.2575,相关指数R2= 0.9987,线性关系良好,实验稳定性较好。
2.5 样品浓度测定
记录452 nm下,样品体系吸光度值(表3),代入工作曲线方程,得出体系为50.00 mL时,样品中铜离子浓度,并据此计算稀释前原始样品中铜离子浓度(表4)。

表3 平行样品浓度计算

表4 样品原始浓度计算及误差分析
结果表明,模拟废水样品中铜离子平均原始浓度为5.86 μmol∙L−1,与预设值相近,相对误差为2.33%,测定结果较准确。三次检测的相对标准偏差为1.50%,满足仪器分析实验基本要求。
2.6 讨论
本实验误差主要来自以下方面:一是溶液配制误差,二是溶液移取误差,三是反应时长误差,四是仪器系统误差。实际操作本实验时,实验者需准确配制溶液及移取试剂,还需尽可能按照实验方法准确计时,以确保各组反应时长一致。
2.7 注意事项
1) 反应需尽量准确计时,以尽可能保证各组反应时长一致,减小误差;
2) 需注意TMB、H2O2的低温避光保存,最好现配现用;
3) 因盐酸溶液中,氯离子含量较高,本实验不宜换用盐酸来终止反应。
3 实验条件讨论
3.1 氯离子加速铜基芬顿反应
铜基芬顿反应体系中,氯离子的存在可以显著加速铜基芬顿反应[15]。我们比较了不同浓度氯离子对铜基芬顿反应的放大效果,实验结果如图5(a)所示,在1.5 μmol∙L−1铜离子的存在下,随着氯离子浓度的增加,检测液452 nm处的吸光度逐渐增大(红色柱状图);当体系中不含铜离子时,TMB2+452 nm处的吸光度较小(黑色柱状图),证明氯离子的存在可以加速铜基芬顿反应。
3.2 方法的选择性
为了考查方法的选择性,采用该方法对相同浓度的其他几种常见的金属离子进行检测,所得到的实验结果如图5(b)所示,这些干扰物所得到的检测信号较小,只有Cu(II)的存在才能够使检测液在452 nm处产生较大的信号。虽然Fe(II)等变价金属也能够催化芬顿反应,但是由于铜基芬顿反应的反应速率更快,且氯离子的存在进一步加速了铜基芬顿反应,所以该方法具有较好的选择性。
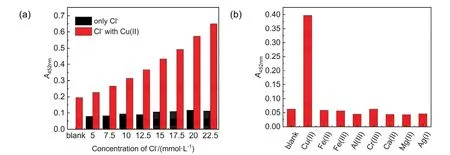
图5 不同浓度氯离子对反应的影响(a)及几种常见金属离子对反应的影响(b)
4 特点及特色声明
向本科生介绍了该种快速、简单、可操作性强的铜离子检测方法,使其认识、理解并实际操作芬顿反应,同时帮助学生学习掌握紫外-可见分光光度法。
1) 本实验安全,可重复性强,操作方便,适用于本科教学;
2) 实验稳定性好,重现性较强;
3) 反应试剂毒性较小,相对安全;
4) 经改进后,可设计成用于Fe2+、Cl−、H2O2等物质测定的检测实验。
5 结语
本实验简单快捷,重现性较好,对铜离子的检测相对准确。向本科生介绍芬顿反应-TMB显色体系,并实际应用其完成定量分析,拓宽实验者知识面。此外,本实验采用紫外-可见分光光度法进行测定,有利于帮助学生巩固课程知识,掌握仪器结构与操作[18],一定程度上有助于教学改革的落实[19]。本实验还可以拓展设计成用于检测芬顿反应体系中其他物质(如:过氧化氢、铁离子等)的本科教学实验。
