大枣水提液过膜后含糖量的比较研究*
2021-11-05马宝珠刘世军
马宝珠,刘世军△,李 慧,刘 永
1陕西中医药大学,陕西 咸阳712083;2陕西省中药资源产业化协同创新中心;3秦药特色资源研究开发国家重点实验室(培育);4陕西省创新药物研究中心
大枣为鼠李科植物枣Ziziphus jujubaMill.的干燥成熟果实[1],具有“补中益气,养血安神”的功效[2]。大枣作为药食同源的食品,被人们广泛使用。研究表明,大枣中含有三萜酸类、黄酮类、环核苷酸类、多酚类、多糖、低聚糖等多种成分[3-5],具有抗氧化、抗肿瘤、保肝、防治心血管疾病、提高免疫力等作用[6]。
目前,我国大枣产量虽高,但对大枣多样化产品的开发程度不够。大枣含糖量约50%~80%,其中一些糖分对人们有益,而另外一些糖分则不太受到人们的欢迎,如葡萄糖和果糖[7-8]。本实验利用不同的膜,依据“筛分”效应来试验大分子与小分子之间的分离,对大枣水提液中不同的糖进行分离。依据分离效果,找出最适合的膜。
1 材料
1.1 仪器LNG-HFM-101型中空纤维膜分离设备(膜型号LNG-HFM U6,LNG-HFM U0.2,上海郎级膜分离设备工程有限公司);LNG-HFM-101型中空陶瓷膜分离设备(膜型号LNG-CM 0.2 μm,LNG-CM0.05 μm,上海郎级膜分离设备工程有限公司);电热鼓风干燥箱(北京科伟永兴仪器有限公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司);UV-2600紫外可见分光光度计(日本岛津公司);电子分析天平(赛多利斯科科学仪器有限公司)。
1.2 试剂葡萄糖(分析纯,天津市大茂化学试剂厂);3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid)(化学纯,上海科丰实业有限公司);氢氧化钠(分析纯,天津市天力化学试剂有限公司);硫酸(分析纯,成都市科隆化学品有限公司);无水乙醇(分析纯,安徽安特食品股份有限公司);亚硫酸钠、苯酚、酒石酸钾钠(均为分析纯,天津市天力化学试剂有限公司)。
2 方法与结果
2.1 样品的制备将大枣洗净去核干燥处理,用12倍水煎煮3次,每次2 h,提取液过滤,浓缩为浸膏,冷藏备用。取80 mL浸膏加纯化水稀释至2000 mL,即为原样品溶液,生药含量约为0.1 g/mL。
2.2 样品的过膜经考察确定,过膜时陶瓷膜和中空纤维膜压力各为0.5 MPa,温度为30℃。将2000 mL的原样品溶液分别过0.2、0.05 μm的微滤陶瓷膜,剩余截留液为100 mL时停止过滤,所得截留液分别为Ⅰ号样品和Ⅱ号样品。将2000 mL的原样品溶液分别过U6的超滤纤维膜和U0.2的微滤纤维膜,剩余截留液为100 mL时停止过滤,所得截留液分别为Ⅲ号样品和Ⅳ号样品。
2.3 总糖含量测定方法[9]总糖标准曲线的绘制:分别精密抽取0.1 mg/mL的葡萄糖溶液0.2、0.4、0.6、0.8、1.0、1.2 mL于具塞试管中,加纯化水至2 mL,然后加入6%苯酚溶液(由80%苯酚现配)1.0 mL,摇匀,加入浓硫酸5.0 mL后,常温放置30 min,再冰水浴5 min,于490 nm处用紫外可见分光光度计测其吸光度值。空白对照则以2 mL纯化水代替葡萄糖溶液。标准曲线图则以浓度为横坐标,吸光度为纵坐标进行绘制,见图1。回归方程:y=17.674x-0.0556;相关系数:R2=0.9972。见图1。

图1 总糖测定中葡萄糖标准曲线
2.4 还原糖含量的测定方法[10-12]
2.4.1 DNS试剂的配置A液:称取6.3 gDNS,21.0 g氢氧化钠充分溶解于400 mL加热脱气后的纯化水中。B液:称取182.0 g酒石酸钾钠溶解于400 mL脱气后的温水中,再加入5.0 g苯酚,5.0 g亚硫酸钠,搅拌使其溶解,并放置至常温。最后将A液与B液混合均匀,倒入1000 mL的棕色容量瓶中并定容至刻度线,即为配制好的DNS试剂。将DNS试剂冷藏于冰箱中备用,至少放置7天后使用。
2.4.2 还原糖标准曲线的制备 精密移取1.00 mg/mL的葡萄糖溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL于25 mL容量瓶中,加纯化水至2 mL,再移取5.0 mLDNS试剂加入容量瓶中。摇匀,沸水浴5 min后,立即置于冰水中20 min,最后定容至刻度线,于493 nm处用紫外可见分光光度计测其吸光度。空白对照则以2 mL纯化水代替葡萄糖溶液。标准曲线图则以横坐标为浓度,纵坐标为吸光度进行绘制,见图2。回归方程:y=32.113x-0.0853;相关系数:R2=0.9989。见图2。

图2 还原糖测定中葡萄糖标准曲线
2.4.3 条件优化
2.4.3.1 显色条件 通过阅读文献发现,苯酚-硫酸法测总糖的方法比较稳定,而DNS法测还原糖时,显色条件有较大的不同。因此,针对还原糖的测定进行显色条件优化。
2.4.3.2 最大吸收波长 精密移取1.00 mg/mL的葡萄糖溶液1 mL于25 mL容量瓶中,加纯化水至2 mL。摇匀后加入5.00 mLDNS试剂,沸水浴3 min后,立即放入冰水中冷却20 min,最后定容至刻度线,于450~600 nm波长范围内用紫外可见分光光度计进行光谱扫描,测其吸光度。以2 mL纯化水代替葡萄糖溶液作空白对照。见图3。由图可知,波长为493 nm时有最大吸光度,故本实验还原糖测定时选用的波长为493 nm。
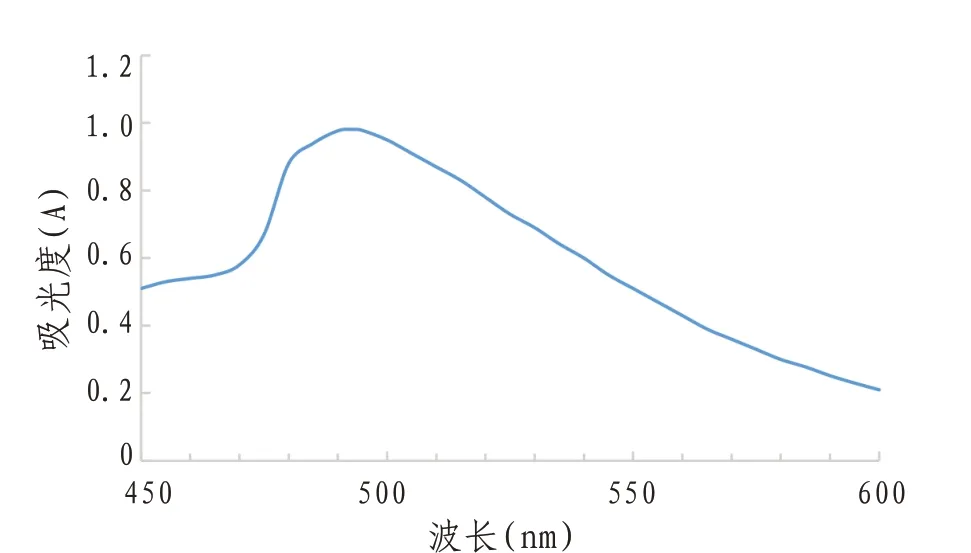
图3 光谱扫描图
2.4.3.3 显色剂用量 在6只25 mL容量瓶中,分别加入1 mg/mL的葡萄糖溶液1 mL,并补纯化水至2 mL。在分别依次加入2、3、4、5、6、7 mL的DNS溶液,摇匀后立即沸水浴3 min。取出,冰水浴20 min,再加纯化水定容至刻度线,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替葡萄糖标准溶液作空白对照。结果见图4。由图4可知,DNS用量为4~7 mL时,吸光度趋于稳定,DNS用量为5 mL时,吸光度最大,故选择加入显色剂的用量为5 mL。
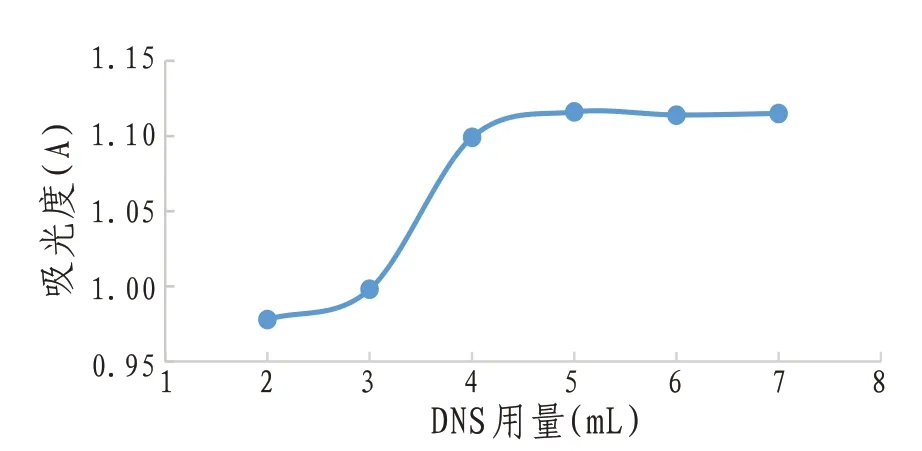
图4 显色剂用量对吸光度的影响
2.4.3.4 显色反应时间 分别加入1 mg/mL的葡萄糖溶液1 mL于5只25 mL容量瓶中,并补纯化水至2 mL。再各加入5 mL的DNS溶液,摇匀后分别沸水浴3、4、5、6、7 min显色,取出,冰水浴20 min,再加纯化水定容,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替葡萄糖标准溶液作空白对照。见图5。由图可知,显色反应时间为5 min时测定的吸光度最大,故选择显色反应时间为5 min。

图5 显色反应时间对吸光度的影响
2.4.4 方法学考察
2.4.4.1 精密度实验 分别精密移取0.5 mL的1 mg/mL葡萄糖溶液于6只25 mL容量瓶,按照还原糖标准曲线测定方法测定吸光度值,测得吸光度分别为0.567、0.559、0.572、0.565、0.563、0.577,RSD=1.14%。结果表明,吸光度无明显变化,说明方法精密度良好。
2.4.4.2 稳定性实验 分别精密移取0.5 mL的1 mg/mL葡萄糖溶液于6只25 mL容量瓶,按照还原糖标准曲线测定方法每隔5 min测一次吸光度,连续30 min考察稳定性。测得吸光度分别为0.560、0.576、0.564、0.576、0.559、0.561,RSD=1.40%。结果表明,吸光度值30 min内无明显变化,说明方法稳定性良好。
2.4.4.3 还原糖加样回收实验 精密移取已知还原糖(大枣粉末还原糖)含量为0.513 8 mg/mL的样品溶液0.5 mL,按还原糖含量的80%、100%、120%,加入对应葡萄糖浓度的溶液0.5 mL,按照“2.4.2”还原糖标准曲线测定方法测定吸光度值,计算回收率,结果见表1。结果显示,还原糖平均加样回收率为101.00%,RSD为4.48%。符合要求。见表1。

表1 还原糖加样回收实验
2.5样品中总糖和还原糖的测定将样品Ⅰ、Ⅱ、Ⅲ、Ⅳ号分别加纯化水稀释至合适的倍数,摇匀,即得样品溶液。测定前,将样品溶液摇匀,精密移取2 mL于具塞试管中,加入6%的苯酚溶液1 mL,摇匀后立即加入浓硫酸5 mL。常温放置30 min后冰水浴5 min,于490 nm处用紫外可见分光光度计测其吸光度值。空白对照则以2 mL纯化水代替葡萄糖溶液。最后根据“2.3”项所得的总糖标准曲线线性回归方程求得样品溶液中总糖浓度。见表2。

表2 样品过不同膜后含糖量测定
将样品Ⅰ、Ⅱ、Ⅲ、Ⅳ号分别加纯化水稀释至合适的倍数,摇匀,即得样品溶液。取1 mL样品溶液并加纯化水1 mL于25 mL容量瓶中。加入5 mL的DNS溶液,摇匀后沸水浴5 min显色,然后冰水浴20 min后,加纯化水定容至刻度线,摇匀,于493 nm处用紫外可见分光光度计测其吸光度。以2 mL纯化水代替样品溶液作空白对照。最后根据“2.4.2”项中还原糖标准曲线线性回归方程求得样品溶液中还原糖浓度。见表2。
大枣中的糖分为单糖、低聚糖和多糖,由于多糖和低聚糖的含量无法直接测定,因此以总糖和单糖(还原糖)之差来反映低聚糖和多糖的含量。见表2。
由表2可知,在压力为5 MPa,温度为30℃的情况下,通过比较0.2 μm和0.05 μm微滤陶瓷膜、U6和U0.2超滤纤维膜这4种膜。4种不同膜对大枣单糖(还原糖)的透过效果依次为:U6超滤纤维膜>U0.2微滤纤维膜>0.05 μm微滤陶瓷膜>0.2 μm微滤陶瓷膜。4种不同膜对大枣多糖及低聚糖的截留效果依次为:U6超滤纤维膜>U0.2微滤纤维膜>0.2 μm微滤陶瓷膜>0.05 μm微滤陶瓷膜。因此U6超滤纤维膜对大枣的过膜效果相对最好,过膜速度也较快。
3 讨论
本研究利用膜分离技术对大枣水提液的截留效果进行初步考察。结果表明,膜分离技术对大枣多糖和低聚糖有一定的截留效果,同时截留液中还原糖含量也有所降低。但就膜而言,过膜效率低,过膜时间久,膜的清洗也需花费大量时间;就大枣而言,大枣中含糖量高,同时糖类成分复杂、差异大。过膜要将其完全分开存在一定困难。因此,应根据生产中对大枣水提液含糖量的实际需要选择0.2、0.05 μm的微滤陶瓷膜或U6、U0.2的微滤纤维膜。
