海洋沉积物中金属依赖型甲烷厌氧氧化作用研究进展及展望
2021-11-05辛友志孙治雷王红梅陈烨徐翠玲耿威曹红张喜林张现荣李鑫闫大伟吴能友
辛友志,孙治雷,王红梅,陈烨,徐翠玲,耿威,曹红,张喜林,张现荣,李鑫,闫大伟,吴能友
1. 中国地质大学(武汉)地球科学学院,武汉 430074
2. 自然资源部天然气水合物重点实验室,中国地质调查局青岛海洋地质研究所,青岛 266237
3. 青岛海洋科学与技术试点国家实验室海洋矿产资源评价与探测技术功能实验室,青岛 266237
4. 中国地质大学(武汉)生物地质与环境地质国家重点实验室,武汉 430074
从20世纪70年代后期开始,随着海洋生态学的研究由生物的种群、群落结构等静态研究向生态功能和生态系统的物质转化与能量循环等动态研究的转变,越来越多的海洋微生物生态学的研究集中到微生物介导的元素循环上。海洋微生物不仅种类丰富、数量庞大,而且还具有多样化的代谢途径,在海洋碳、氮、硫等元素的生物地球化学循环中具有重要地位[1-2]。甲烷(CH4)是能够引起温室效应的主要气体之一,它的循环对于气候变化有重要调节作用[3]。据估计,全球海洋沉积物中约90%的甲烷气体会通过AOM消耗[4-5],从而使甲烷从沉积物向海水和大气的排放量保持在相当低的水平。
海洋环境是地球表面最大的生态系统之一,包括洋壳、海底沉积物以及冷泉、热液、海山等多种地质结构[2]。海洋沉积物是由海水中的颗粒物质和生物残骸不断沉降并在海底聚积形成的特殊生态环境[3]。经过漫长地质时期的积累,海洋沉积物平均厚度达500 m,约覆盖地球面积的48.6%[4],这为微生物的生存提供了巨大的场所。海洋沉积物中微生物的代谢活动取决于电子供体(可被氧化的单质或化合物)和电子受体(可被还原的单质或化合物)的可利用性和价态。考虑到数量和可利用性,硫酸盐(SO42−)是AOM主要的电子受体。因此,在厌氧的海底沉积物中,AOM主要发生于硫酸盐-甲烷转换带(sulfate-methane transition zone, SMTZ)[6-7]。但是在冷泉区,甲烷的上升通量很高,在SMTZ中并不能完全被消耗氧化。因此,海洋沉积物中微生物介导的AOM过程可能会涉及不同的电子受体,除硫酸盐以外,针对能够与AOM耦合的其他电子受体的研究也越来越多。目前,研究发现的类型包括硫酸盐依赖型AOM(Sulfate-AOM)、金属(铁、锰、铬)依赖型AOM(Fe-, Mn-, Cr-AOM)和硝酸盐、亚硝酸盐依赖型AOM(NO3−-, NO2−-AOM)[8-9](表1)。
早在1980年,Zehnder和Brock就提出了金属离子可能也会参与AOM的假设[10]。因为仅根据吉布斯自由能规律(表1),AOM与金属氧化物还原反应耦合要比与硫酸盐还原耦合更具优势[10]。沉积物渗漏实验(leakage experiments)表明[11],硫酸盐还原反应、铁还原反应、AOM和甲烷生成作用可同时在海洋沉积物中发生,并且铁氧化物的存在显著促进了细菌硫酸盐还原反应的速率。已有研究推测metal-AOM在地球早期缺氧、富铁、贫硫的环境中可能会十分繁盛,甚至还推动了地质历史演化[12]。锰和铁的固体氧化物在深海沉积物中的氧化还原地球化学中起着重要作用。同时,金属氧化物也存在多样化的来源。例如,海底深部流体的排放过程既发生在空间受限的快速对流体中(如沿洋中脊分布的热液喷口),也发生在大面积的海底(包括冷泉渗流等),其温度低,扩散程度更大[2]。如果热液和冷泉两种截然不同的海洋生态环境相互毗邻,那么两者之间的关联互作必然会影响metal-AOM的发生。
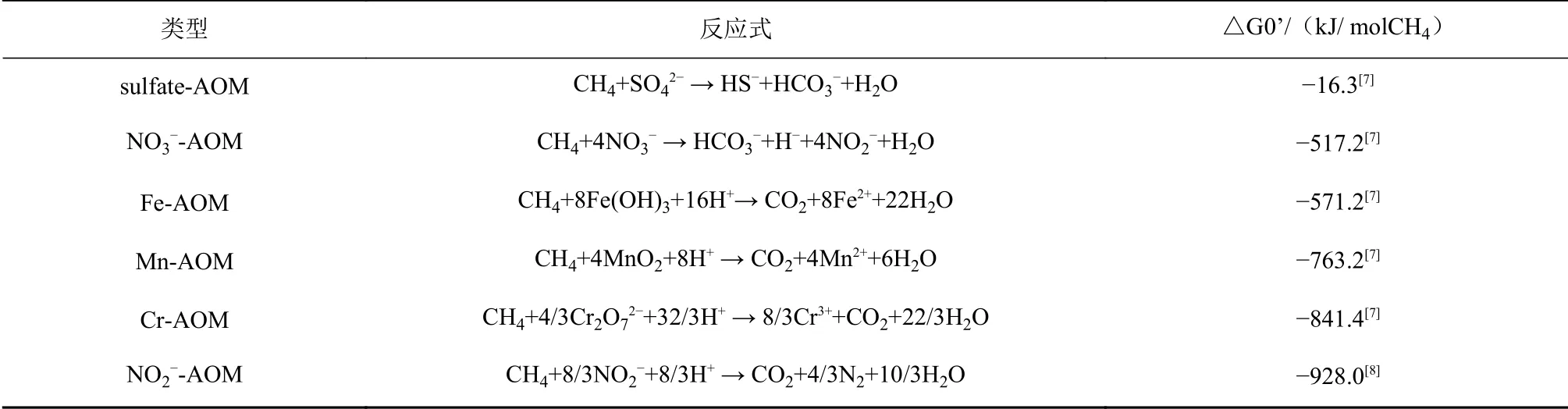
表 1 甲烷厌氧氧化作用类型及其标准吉布斯自由能(△G0’)Table 1 Standard Gibbs free energies(△G0’)of different AOMs
总而言之,在海洋极端环境中,控制微生物群落的环境梯度存在于从微米到千米的空间尺度,也存在于从毫秒到千年的时间尺度。目前对能够介导metal-AOM的微生物类群依然认识不清,其介导的metal-AOM发生机制和重要意义还需要更加深入的研究。因此,本文从微生物生态学角度,综述了海洋沉积物metal-AOM的研究进展,总结了具有介导metal-AOM潜能的微生物类群,概括了metal-AOM发生的地球化学证据,并以当前已经展开较多相关研究的西太平洋冲绳海槽为例,探讨metal-AOM的发生机制模型,以期为未来研究提供方向和思路。
1 海洋沉积物中具有介导metal-AOM潜能的微生物
如果大量甲烷从海洋沉积物释放到大气,将会对全球气候产生巨大温室效应[13]。微生物既是海洋沉积物中甲烷的生产者同时又是甲烷的利用者。在缺氧的沉积环境,地球化学证据表明甲烷的消耗与硫酸盐的消耗存在正向关联[14]。同时,对微生物遗传物质和脂类的研究,表明该互养关系(syntrophic relationship)是由硫酸盐还原菌(sulfate-reducing bacteria,SRB)和甲烷厌氧氧化古菌(anaerobic methane-oxidizing archaea, ANME)介 导 的[15],并 且ANMEs(ANME-1,ANME - 2, ANME -3)和多个SRB类群都参与该过程[16]。海洋微生物催化AOM可将海底产生的75%的甲烷转化为碳酸盐沉淀,从而大大降低了向海洋水体释放[17-18]。然而通过对墨西哥湾北部冷泉沉积物孔隙水的地球化学定量研究发现,现代海洋沉积物中AOM和硫酸盐还原(sulfate reduction, SR)之间存在很大的不平衡[19]。实际上,尽管AOM与SR耦合已得到充分的证明,但近期的研究表明,在海洋热液沉积物[20]等一系列自然环境中,可能存在由硝酸盐、亚硝酸盐和金属氧化物(铁、锰、铬)还原驱动的AOM[21-28]。但是,迄今为止,在自然海洋环境中与metal-AOM相关联的信息还十分匮乏。
目前已知的能够执行AOM的微生物大多数属于古菌域的ANMEs。基于16S rRNA基因系统发育研究表明,所有ANMEs都属于广古菌门(Euryarchaeota),并且与可纯培养的产甲烷菌在进化上十分相近[29]。研究发现,甲烷八叠球菌目(Methanosarcinales)以及甲基杆菌属(Methylobacter)微生物可能参与Kinneret湖泊沉积物Fe-AOM[27]。淡水生态系统NO3−-AOM主要是ANME-2d类群参与[29-30],后来发现该类群也能够催化Fe-AOM[31]。近期,通过宏基因组高通量测序技术在ANME-2d类群中鉴定了一个新的微生物种属(Candidatus Methanoperedems ferrireducens),该类微生物也可以生活在淡水沉积物,并参与Fe-AOM[32]。同样,在对低硫、富铁的湖泊沉积物进行富集培养和RNA稳定同位素探针(RNA stable isotope probing, RNA-SIP)研究中,再次表明ANME-2d类群是淡水生态系统Fe-AOM的主要参与者[33]。而在海洋沉积物中,ANMEs的生态位也有分化,ANME-2a / b通常在上部和中部占主导地位,而ANME-2c或ANME-1占据较深区域[34],这表明了ANMEs代谢能力的多样性和特异性,也为海洋沉积物metal-AOM的发生提供了先决条件。
在海洋生态系统,证明微生物参与metal-AOM的证据之一是来自对Eel River Basin冷泉沉积物的研究。原始样品和对照组相比,在使用锰(水钠锰矿)作为电子受体进行富集培养10个月后,微生物群落结构发生了变化,该研究的作者认为,ANME-1或ANME-3及各自结伴细菌可能参与Mn-AOM[35]。之后通过荧光原位杂交和次级离子质谱测定联用(fluorescence in situ hybridization coupled to secondary ion mass spectrometry, FISH-SIMS)技术,从形态学进一步确认ANME-2类群可能参与Mn-AOM富集培养过程[36]。此外,对Helgoland Mud 地区表层沉积物的研究表明,JS1细菌、产甲烷菌和ANME-3(甲烷盐菌属Methanohalobium)类群的古菌与沉积物中溶解铁的分布存在正向相关性[37]。然而最近对Helgoland Mud 地区深部沉积物的富集培养研究表明,ANME-2a也可能在metal-AOM过程发挥关键作用[38]。对圣塔莫尼卡盆地冷泉沉积物的研究表明,向富集培养样品添加Fe(III)化合物(柠檬酸铁和乙二胺四乙酸钠铁)后,样品中ANME-2a和ANME-2c丰度升高,而ANME-1丰度相对降低[39]。除了在冷泉区的研究,也有对高温下热液沉积物AOM进行的研究,富集培养结果表明ANME-1c类群可能是在有机质贫乏、含有金属氧化物的热液沉积物中Fe-AOM的主要参与者[20]。目前对metal-AOM的研究较多开展于淡水生态系统和海洋生态系统。在陆地泥火山环境中,也发现了ANME-2a和脱硫单胞菌属(Desulfuromonas)/居泥杆菌属(Pelobacter)占主导地位的metal-AOM[40]。
2 海洋沉积物中metal-AOM机理
自从在深部沉积地层发现存在微生物以来,有关支撑微生物生命能量来源和深部生物圈代谢状态的疑问就一直备受关注。在海洋沉积环境,电子受体的利用能力通常体现为其最大电子接受潜能,当耦合的氧化还原反应在热力学上有利并产生足够的能量用于三磷酸腺苷酶(ATP)生成,微生物就能获得能量。微生物根据热力学能量定律来选择环境中电子受体的利用顺序,针对同一电子供体,具有最高还原势能的电子受体会首先被消耗[2]。目前对海洋沉积物中电子供体的可利用性还不十分清楚。一般认为,海洋沉积物中微生物群落的丰度与沉积物有机碳含量呈正相关,这与在其他生境中观察到的模式一致(即富含有机质的沉积物含有较高的细胞密度)[41]。除了有机碳,其他电子供体对海洋微生物也具有重要作用[42]。
在海洋沉积物中,已证实电子受体会按次序发生还原反应,具有较高还原势能的电子受体会在沉积物浅层被消耗,并且这种规律也适用于其他深海环境。氧(由光合作用产生,从真光层通过全球海水循环输送)通常是沉积环境中首选末端电子受体,其后分别是硝酸盐(主要是在有机质降解过程中通过铵盐的硝化作用形成)、亚硝酸盐(通常由硝酸盐或铵盐产生)、锰和铁的氧化物(Mn(IV)、Fe(III);源自热液、河流或粉尘输入)和氧化的硫化合物(硫酸盐,主要来自大陆侵蚀;元素硫和硫代硫酸盐,来自H2S的再氧化)[2](图1)。其中,铁氧化物在海洋沉积物主要通过两种可能的途径被还原,即铁氧化物还原与有机质降解(organic matter degradation,OMD)过程耦合(Fe-OMD)和铁氧化物还原与AOM耦合(Fe-AOM)。前者可能是最古老的呼吸形式之一,由Fe3+充当电子受体[43]。然而,这种途径在很大程度上受到沉积物剩余总有机质的可利用性低和活性差的限制[44]。例如,在冲绳海槽北部,研究发现富铁碳酸盐岩周围沉积物中活性有机碳含量非常低(0.5%),表明Fe-OMD可能受到很大限制[45-46]。同样,对南海神狐海域的沉积物柱研究也证实存在类似的过程[47]。

图 1 电子受体在海洋沉积物中按序利用示意图POM(particular aerobic oxidation of methane):甲烷有氧氧化,OMD(organic matter degradation):有机质降解;修改自文献[2]。Fig.1 Sequential utilization of electron acceptors in marine sedimentsPOM :Particular aerobic oxidation of methane, OMD: Organic matter degradation; adapted from reference [2].
尽管在海洋沉积物中已发现金属氧化物(铁氧化物、锰氧化物)还原驱动的AOM[48],但微生物通过AOM偶联金属氧化物的还原反应来获得能量依然面临巨大挑战。因为在海洋沉积物中,金属氧化物以固态矿物的形式存在,难溶且难以被利用[49]。相对容易利用的金属氧化物在富含甲烷区域之上就会被还原,而“幸存的”金属氧化物则呈惰性形式,例如结合在层状硅酸盐中的含铁矿物,可以保存数千年[50]。但是,在海洋沉积物柱样品的深部甲烷生成区能够观察到还原形式的金属离子(例如Fe2+和Mn2+)浓度增加,这表明该层已经发生金属氧化物的还原反应[51]。此外,微生物在呼吸过程中将电子输送到液态和固态金属氧化物的机制也各不相同,有些微生物利用细胞壁上的酶通道,还有一些微生物则通过导电的细胞外分泌附属物转移电子[43, 51]。
ANME古菌均可以进行“反向产甲烷”途径代谢,但电子转移到金属氧化物的过程仍是未知的。在大多数ANME类群中,多血红素c型细胞色素(multi-heme c-type cytochromes, MHCs)发挥了传导电子的作用。例如,在淡水沉积物富集培养过程添加Mn(IV)氧化物(水钠锰矿)后,通过宏基因组和宏转录组分析技术发现,参与甲烷氧化和MHCs通路的许多关键基因都发生了上调表达[52]。铁还原菌Geobacter sulfurreducens在Fe(III)氧化物和Mn(IV)氧化物还原过程中也是通过MHCs转移电子[53],因此,也有可能参与metal-AOM。在实验室培养环境,将异化铁还原菌(奥奈达希瓦氏菌ShewanellaoneidensisMR-1)加入到反硝化甲烷厌氧氧化体系中(ANME-2d为其中主要类群)共培养,并以水铁矿(ferrihydrite)为惟一电子受体条件下,也会发生AOM[54]。通过单细胞表征技术还发现,MHCs在ANME-2a/b和ANME-2d古菌细胞中的体积要大于G. sulfurreducens和S. oneidensis[55]。有研究推测,ANME-2d和Ferroglobus placidus可以将CxxCH蛋白塑造成细胞外导电结构或菌毛,从而进行固体铁氧化物的还原[56]。这些研究表明,ANME-2d具有将AOM与硝酸盐以外的其他电子受体还原反应偶联的潜能,甚至包括不溶性金属氧化物。此外,“Photoferrotrophy”被认为在早期地质历史时期维持了Fe-AOM的发生[57]。除了直接与AOM偶联,金属氧化物还可以间接影响与其他电子受体还原反应耦合的AOM过程。研究发现,向水合物及冷泉沉积物添加赤铁矿会导致铁还原反应与sulfate-AOM速率同时增加[58]。然而,metal-AOM是由单个微生物类群介导发生的,还是由多个微生物类群协作完成的,仍需进一步的研究。
综上所述,在不同生态环境发生的metal-AOM,可能存在不同的微生物功能群和代谢过程(表2)。但是目前还无法确定能够介导metal-AOM的微生物类群,其具体的生物学过程及代谢机制也无法确定。对metal-AOM发生机理的研究在很大程度上还是受到现有技术方法的限制。近期在第三代测序和单细胞分选等技术上的突破将为海洋微生物研究提供新的方式,有助于揭示海洋极端环境中微生物代谢途径和生存策略的多样性。

表 2 不同生态环境中metal-AOM潜在功能群Table 2 Potential microbial communities of metal-AOM from different ecosystems
3 海洋沉积物中metal-AOM机制模型
就metal-AOM在沉积物不同层位发生的机制问题,目前已提出4种不同的模式(图2A—D)。在富铁的Matano湖有氧-厌氧界面以下,缺乏硫酸盐、硝酸盐和亚硝酸盐,但富含铁氧化物和锰氧化物,这为metal-AOM提供了金属氧化物来源[23](图2A)。此外,Sivan等[21]发现,如果金属氧化物的还原反应在很大程度上受到了动力学和生物地球化学的限制,那么大量金属氧化物就会被埋藏在深部缺氧区,同时,在产甲烷区以下只存在微量的硝酸盐和硫酸盐,metal-AOM则可在该区域内发生(图2B)。相反,在丹麦日德兰半岛Ørn湖泊沉积物顶部22 cm就发现了AOM信号,并且硫酸盐和Fe(III)共存于此处[24](图2C)。然而,上述3种metal-AOM发生类型尚未在海洋生态系统得到证实。
发生metal-AOM的基本前提是在其他电子受体亏损体系中同时存在大量可利用的CH4和金属氧化物。在SMTZ以下,硫酸盐、硝酸盐和亚硝酸盐的浓度通常非常低,因此,金属氧化物可能成为AOM在该区域内惟一电子受体。以Aromokeye等[38]在Helgoland Mud地区的研究为例,孔隙水剖面数据显示在低于SMTZ的样品中检测不到硫酸盐(SMTZ深度:30~85 cm;检测限:50 mM),而甲烷和可溶性铁的浓度分别可高达6和380 mM。该研究结果可与之前Oni等[37]在该区域的研究互相印证,而且,对波罗的海沉积物的地球化学分析结果[59]也支持这种假设。可溶性铁浓度升高可以指示铁还原反应持续发生,铁还原反应广泛发生在海岸带浅层沉积物(例如波斯尼亚海)和大陆架边缘深部海底(例如阿根廷盆地)[38],该过程很可能与Fe-AOM相关。这些环境通常具有高沉积速率特征,从而便于将活性氧化铁埋藏在SMTZ下。除了较高的沉积速率,人类活动造成的富营养化也会导致海岸带沉积物中SMTZ抬升并将金属氧化物埋藏在还原区内。根据富集培养实验结果和数值模型估算得出Bothnian 海沉积物中Fe-AOM速率可达1.32 ±0.09 μmol·cm−3·a−1,约消耗甲烷总量的3%[60]。在对冷泉区碳酸盐岩的研究中发现,通过同位素探针技术(包括 δ13C、δ34S和δ56Fe)发现metal-AOM应该是造成该区域沉积物中高浓度铁、锰的主要途径,并且富含金属元素的矿物形成于SMTZ以下[45-47]。根据上述这些针对特定区域内metal-AOM研究的结果,可以发现,在海洋生态系统中,metal-AOM通常发生在SMTZ以下(图2D)。然而,海洋沉积物中metal-AOM区是否也存在多种不同机制,还需要更多的研究来证明。总之,metal-AOM很可能是海洋沉积物中甲烷的另一个重要的汇。
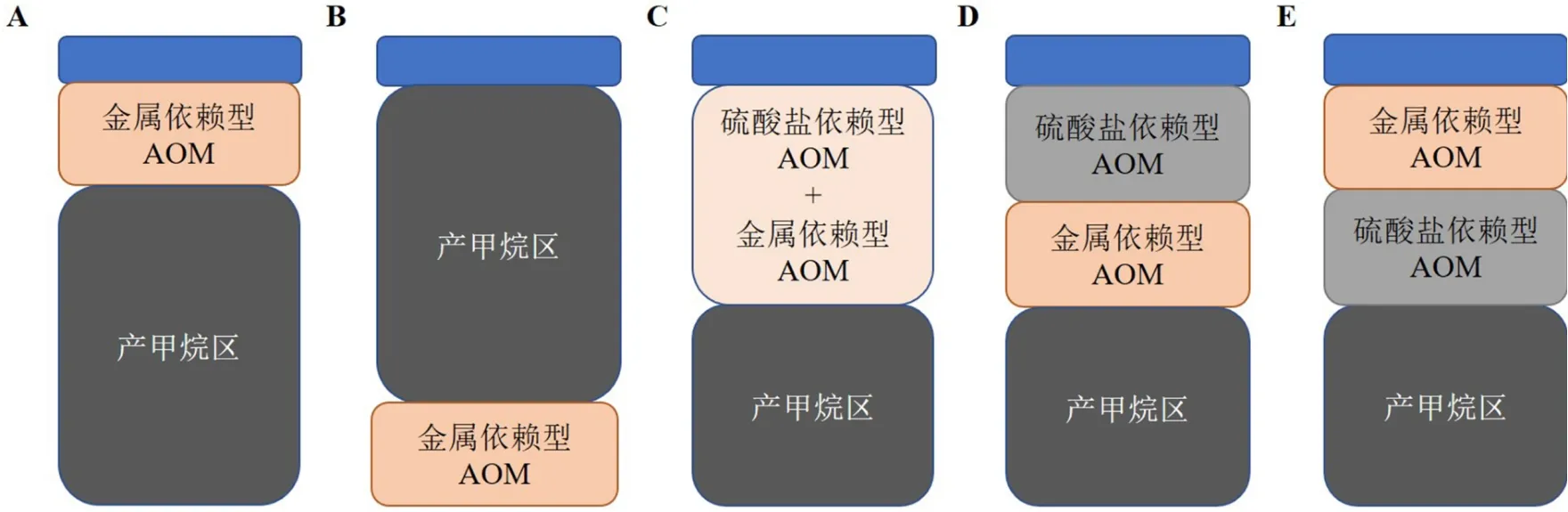
图 2 沉积物中metal-AOM潜在发生区模型[12]A.位于产甲烷区以上(例:文献[23]),B. 位于产甲烷区以下(例:文献[21]),C. 位于SMTZ之中(例:文献[24]),D. 位于SMTZ以下(例:文献[37-38, 45-47, 59-60]),E. 位于SMTZ以上(本文依据冲绳海槽相关研究提出的假设);AOM(anaerobic oxidation of methane):甲烷厌氧氧化。Fig.2 Models of metal-AOM potential zones in sediments[12]A.metal-AOM occurs over the zone of methanogenesis(drawn based on the descriptions in reference [23]), B. metal-AOM occurs under the zone of methanogenesis(drawn based on the descriptions in reference [21]), C.metal-AOM occurs in the SMTZ(drawn based on the descriptions in reference [24]),D. metal-AOM occurs under the SMTZ(drawn based on the descriptions in reference [37-38, 45-47, 59-60])E. metal-AOM occurs above the SMTZ(drawn based on the researches of Okinawa Trough in this study); AOM(Anaerobic oxidation of methane).
研究海洋沉积物中metal-AOM发生机制的一个关键点在于活性金属氧化物的来源问题。与其他水生生态系统相比,海洋中金属氧化物存在多种外部输入,包括粉尘、河流和热液喷口等,它们还可以通过成岩作用在沉积物中累积[2,61-62]。Luo等[61]曾提出,来源于火山灰的铁元素对Hikurangi margin沉积物中的碳循环有重大影响。在海洋沉积物SMTZ以下,以还原性含水形式存在的锰和铁的浓度通常非常低。而在硝酸盐还原区以下直到硫酸盐还原区以上,还原性的锰、铁浓度增加,反映出金属氧化物的减少。产生的还原性锰、铁又可在较浅的沉积物中被重新氧化或在较深的区域中与SR偶联生成硫化物沉淀(如黄铁矿)。在热液流体与冷的氧化海水混合过程中也会产生锰和铁的氧化物,这些氧化物可以促进热液区周围沉积物中微生物的代谢[63]。因此,海洋沉积物中活性金属氧化物主要有两种来源:深部沉积物和热液羽流。先前的研究表明,在深部沉积物中,浊积作用可以促进铁氧化物的输入,将活性铁氧化物埋藏在硫酸盐还原带以下[47]。这种事件在大陆坡等非稳态系统中应该是普遍存在的。然而,不可忽视的是,海洋环境中铁氧化物的高输入量很可能与热液活动相关,特别是在热液活动十分繁盛的地区,例如冲绳海槽。
冲绳海槽作为西太平洋一个典型的弧后盆地,发育了繁盛的热液和冷泉活动[64-65]。2018年,青岛海洋地质研究所利用FCV3000型水下遥控机器人在冲绳海槽内相距约50 km的冷泉和热液喷口附近,分别发现了化能自养生态群落,并采集到在形貌上具有非常高相似度的贻贝、管虫等。这两地之间没有任何的地形起伏和天然阻挡,难免会借助海水或相互连通的沉积物媒介发生交流或相互影响。同时调查发现,随着采样点和热液喷口之间距离的减小,沉积物中铁、锰、铜和铬的浓度增加了2~7倍,并且当热液喷口成簇出现时,活性金属的输出通量由于叠加而明显增强[64]。因此,研究者认为,由于半封闭的地形特征以及冷泉和热液系统的独特共存,冲绳海槽扩张中心的现代热液活动为其覆盖的冷泉区沉积物提供了丰富的活性金属[64-65]。冲绳海槽海底冷泉区沉积物中metal-AOM的发生很可能受到热液输入活性金属的影响,并通过生物地球化学循环将两个生态系统有机地联系起来。
基于这些研究,本论文提出在冲绳海槽该特殊海洋生态环境沉积物中metal-AOM发生的机制模型(图2E),其主要内容可概括为下述过程:热液羽状流携带大量的还原性金属物质进入邻近冷泉区,经海水氧化沉淀后形成活性金属氧化物,并不断在海底沉积;其次,冷泉区流体向上运移,那么冷泉流体中的甲烷将会和正常向下扩散的热液活性金属氧化物相遇,并在SMTZ上发生metal-AOM(图2E)。热液和冷泉地区分布有不同类型的电子供体和电子受体[66],这些差异直接导致了海洋微生物多样性和生物地理分区研究常常是独立进行的。一直以来,海底热液和冷泉系统在生态学上通常被认为属于“岛状生境(island-like habitats)”[67]。然而,热液物质通过羽流源源不断输入冷泉区后很可能会发生一系列氧化还原反应,从而使热液和冷泉区的元素循环过程发生耦合,而这一过程势必会引起该区域微生物的生态响应,其过程和机制需要进一步的探索。
4 总结与展望
AOM在控制全球甲烷排放过程中起着至关重要的作用,海洋沉积物中metal-AOM在该过程中所扮演的角色仍需要详细阐明。海底深部生物圈孕育了类型和生物量巨大并且代谢独特的微生物[68-69]。海洋沉积物中微生物群落组成随氧含量、碳含量、沉积物深度和热液影响而变化。综合前人研究,参与淡水生态系统中metal-AOM的微生物类群主要是ANME-2d,其介导metal-AOM的代谢机制也得到了初步鉴定。但是,巨大的空间以及生物地球化学过程和循环在空间和时间上的异质性对海洋微生物研究提出了重大挑战。发掘海洋沉积物中能够介导metal-AOM的微生物类群及其代谢机制仍需不断完善研究技术。除了依靠传统的纯培养技术,新兴的海底原位拉曼激光和流式单细胞分选技术也可能为海洋极端环境微生物研究打开突破口。
当前对metal-AOM发生机制的解释多以淡水生态系统中的研究为主。这是由于海洋生态系统具有更加复杂的环境条件。同时,metal-AOM的产物(Mn(II)、Fe(II)和CO2)也会参与到其他金属、硫和磷等元素的地球化学循环以及矿化过程。因此,metal-AOM对其所在生态系统及全球海洋元素循环的重要影响有待进一步的揭示。冲绳海槽具有热液和冷泉系统共存的独特特征,来源于热液的相对还原的流体通过循环可为周围贫电子受体的海底沉积物提供氧化剂,刺激微生物的活动。为沉积物中metal-AOM的发生提供了有利条件。为了进一步证实冲绳海槽海底沉积物中可能存在的metal-AOM发生机制,青岛海洋地质研究所搭乘2020年“海洋地质9号”科考船对该区域进行了多方位取样调查。同时,借助第三代微生物高通量测序技术及原位模拟富集培养技术,以发掘可能参与metal-AOM的微生物及相关代谢过程。
以冲绳海槽为代表的热液-冷泉系统流体相互作用创新性理论的提出,从更广阔的视角研究海洋生态系统之间相互作用及物质和能量的循环模式,为探究海洋沉积物中metal-AOM的发生机制提供了新的思路,并对海洋极端环境微生物的代谢途径耦合和生命演化理论具有重要指导意义。不仅如此,除了在冲绳海槽等弧后盆地环境中存在metal-AOM,在开阔海和其他大陆边缘,包括极地,都有可能存在metal-AOM。因此,今后的研究还应关注不同海洋环境中微生物的亲缘关系、生态群落特征的对比,以及对不同地理和理化环境的适应性。
