萝卜硫素对L- NAME诱导的人胎盘滋养细胞株HTR- 8/SV- neo氧化应激与凋亡的影响及其可能机制初探
2021-11-05程丽陈梅
程丽,陈梅
(潜江市妇幼保健计划生育服务中心,湖北 潜江 433100)
妊娠期高血压疾病(hypertension disorder complicating pregnancy, HDCP)是孕妇所特有而常见疾病之一,其临床特点主要包括高血压、蛋白尿、水肿、昏迷以及心肾功能衰竭,严重时甚至引发死亡[1- 3]。HDCP病因和发病机制复杂,胎盘是母体与胎儿间进行物质交换的器官,胎盘滋养细胞功能异常会导致胎盘形成受阻,引发妊娠相关疾病[4- 5]。萝卜硫素(sulforaphane)是一种具有抗氧化损伤作用的活性物质,主要成分为异硫氰酸酯[6],能够预防各种类型的癌症,降低心血管疾病发生风险,并具有抗氧化、抗炎与免疫调节等作用[7- 9]。然而萝卜硫素在妊娠相关疾病,尤其是HDCP中的作用至今未见报道。已知N- 硝基- L- 精氨酸甲酯(L- nitro- arginine methyl ester,L- NAME) 作为一氧化氮合酶抑制剂可干预人胎盘滋养细胞,从而能够模拟HDCP微环境进行相关体外研究。本研究通过L- NAME干预HTR- 8/SVneo细胞模拟 HDCP微环境,观察萝卜硫素对HDCP胎盘滋养细胞氧化应激损伤、炎症反应及细胞凋亡的影响,初步探究其作用的信号通路,以期为HDCP的研究与诊治提供实验基础。
1 材料与方法
1.1 主要材料与试剂
人胎盘滋养细胞株HTR- 8/SV- neo购自美国ATCC细胞库,萝卜硫素(纯度≥98%)购自杭州林格贝公司(批号20171106- 2),c- Jun氨基末端激酶/p38丝裂原活化蛋白激酶(JNK/p38 MAPK)信号通路阻断剂SB203580和L- NAME购自Sigma公司,胎牛血清、青霉素、链霉素及DMEM/F12培养基购自美国Gibco公司,细胞计数试剂盒- 8(CCK- 8)和Annexin V- FITC/PI细胞凋亡检测试剂盒购自北京全式金生物科技公司,丙二醛(MDA)和谷胱甘肽(GSH)检测试剂盒购自南京建成生物工程研究所,超氧化物歧化酶(SOD)检测试剂盒购自北京默沙克公司,肿瘤坏死因子- α(TNF- α)、白细胞介素(IL)- 1β、IL- 6酶联免疫吸附测定(ELISA)试剂盒购自武汉华美生物有限公司,原位缺口末端标记法(TUNEL)检测试剂盒、细胞裂解液、二喹啉甲酸(BCA)蛋白测定试剂盒和聚偏二氟乙烯(PVDF)膜购自上海碧云天生物技术有限公司,磷酸化JNK(p- JNK)抗体、JNK抗体、磷酸化p38 MAPK(p- p38 MAPK)抗体、p38 MAPK抗体购自美国Abcam公司,甘油醛- 3- 磷酸脱氢酶(GAPDH)和辣根过氧化物酶标记的山羊抗兔购自武汉博士德生物工程有限公司。
1.2 细胞培养与处理
HTR- 8/SV- neo细胞株复苏后,添加含10%胎牛血清、青霉素(100 U·ml-1)/链霉素(100 μg·ml-1)双抗液的DMEM/F12 培养基,置于37 ℃、5%CO2细胞培养基培养,每 2 d换液 1 次,待细胞融合度达到80%~90%时进行传代,本实验使用第3~5代细胞。
1.3 分组与药物处理
将处于对数生长期的HTR- 8/SV- neo细胞调整浓度为4×104个·ml-1,取100 μl接种到96 孔板。实验分组包括对照组、模型组、3个剂量(10、20、40 μmol·L-1)萝卜硫素组和阻断剂组。细胞过夜培养后,对照组细胞正常培养,不同剂量萝卜硫素组细胞分别使用终浓度为10、20、40 μmol·L-1的萝卜硫素培养72 h,阻断剂组细胞使用终浓度为15 μmol·L-1的SB203580培养24 h,接着,除对照组外的其余各组细胞均继续使用100 μmol·L-1的L- NAME干预48 h,收集细胞。
1.4 CCK- 8实验
将HTR- 8/SV- neo细胞按照1.3所述分组与处理后,每孔加入10 μl CCK- 8试剂,混合均匀后置于细胞培养箱中反应 1 h,上酶标仪测定 490 nm 处的吸光度值,实验重复3 次。
1.5 Annexin V- FITC/PI双染法
将HTR- 8/SV- neo细胞按照1.3所述分组与处理后,使用胰蛋白酶消化,收集细胞,以PBS洗涤2次,加入500 μl结合缓冲液重悬细胞后,参照细胞凋亡检测试剂盒说明书操作,依次加入5 μl 的Annexin V- FITC和PI试剂,混匀后在室温下避光反应15 min,然后上流式细胞仪检测细胞凋亡情况,实验重复3次。
1.6 MDA、SOD 和 GSH水平检测
收集处理后的各组HTR- 8/SV- neo细胞,裂解细胞获取上清液,采用硫代巴比妥酸比色法检测MDA含量,化学比色法检测SOD、GSH活性,具体按试剂盒说明书操作。
1.7 ELISA法
收集处理后的各组HTR- 8/SV- neo细胞,裂解细胞并提取上清液,使用大鼠特异性ELISA试剂盒检测上清液中TNF- α、IL- 1β、IL- 6含量,操作严格按试剂盒说明书进行,用酶标仪检测450 nm处吸光度值。
1.8 TUNEL染色
收集处理后的各组HTR- 8/SV- neo细胞,PBS洗涤后使用4%多聚甲醛固定细胞30 min,含0.3% Triton X- 100的PBS重悬细胞,室温孵育5 min,加入TUNEL检测液,充分混匀,37 ℃避光孵育60 min,PBS洗涤细胞后进行涂片,通过荧光显微镜观察细胞凋亡情况。
1.9 蛋白质印迹法
收集处理后的各组HTR- 8/SV- neo细胞,加入细胞裂解液置于冰上进行裂解,以10 000×g 离心20 min后取上清,BCA法对蛋白含量定量。每孔加入20 μg总蛋白样品进行10%SDS- PAGE 凝胶电泳,将分离蛋白电转印至PVDF膜,室温下使用5%脱脂牛奶封闭2 h 后,加入稀释的抗体p- JNK(1∶1 000)、JNK抗体(1∶1 000)、p- p38MAPK抗体(1∶1 000)、p38MAPK抗体(1∶1 000)或GAPDH抗体(1∶1 000),4 ℃孵育过夜,次日,TBST液洗膜后加入辣根过氧化物酶标记二抗(1∶5 000),室温孵育 2 h 后滴加ECL超敏发光液显色,凝胶成像仪中曝光成像,BandScan 5.0软件分析各条带灰度值,计算各条带的相对灰度值。
1.10 统计学处理
2 结 果
2.1 各组HTR- 8/SV- neo细胞存活率比较
HTR- 8/SV- neo细胞存活率检测结果显示,6组间细胞存活率差异有统计学意义。与对照组相比,模型组细胞存活率显著下降(P<0.05);与模型组比较,10、20、40 μmol·L-1萝卜硫素作用的细胞存活率显著升高(P<0.05),而经15 μmol·L-1SB203580作用的细胞存活率也显著升高(P<0.05)。见表1。
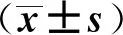
表1 各组HTR- 8/SV- neo细胞存活率比较
2.2 各组HTR- 8/SV- neo细胞凋亡率比较
流式细胞术检测显示,6组间HTR- 8/SV- neo细胞凋亡率差异有统计学意义。与对照组相比,模型组细胞凋亡率显著升高(P<0.05);与模型组比较,经10、20、40 μmol·L-1萝卜硫素和15 μmol·L-1SB203580作用的细胞凋亡率均显著下降(P<0.05)。见图1。
a 与对照组比较,P<0.05; b 与模型组比较,P<0.05
TUNEL染色结果显示,6组间HTR- 8/SV- neo细胞TUNEL阳性率差异有统计学意义。对照组细胞凋亡数较少,模型组细胞TUNEL染色增加,细胞凋亡较对照组显著增加(P<0.05);与模型组比较,经10、20、40 μmol·L-1萝卜硫素和15 μmol·L-1SB203580作用的细胞TUNEL染色减少,细胞凋亡数显著减少(P<0.05)。见图2。
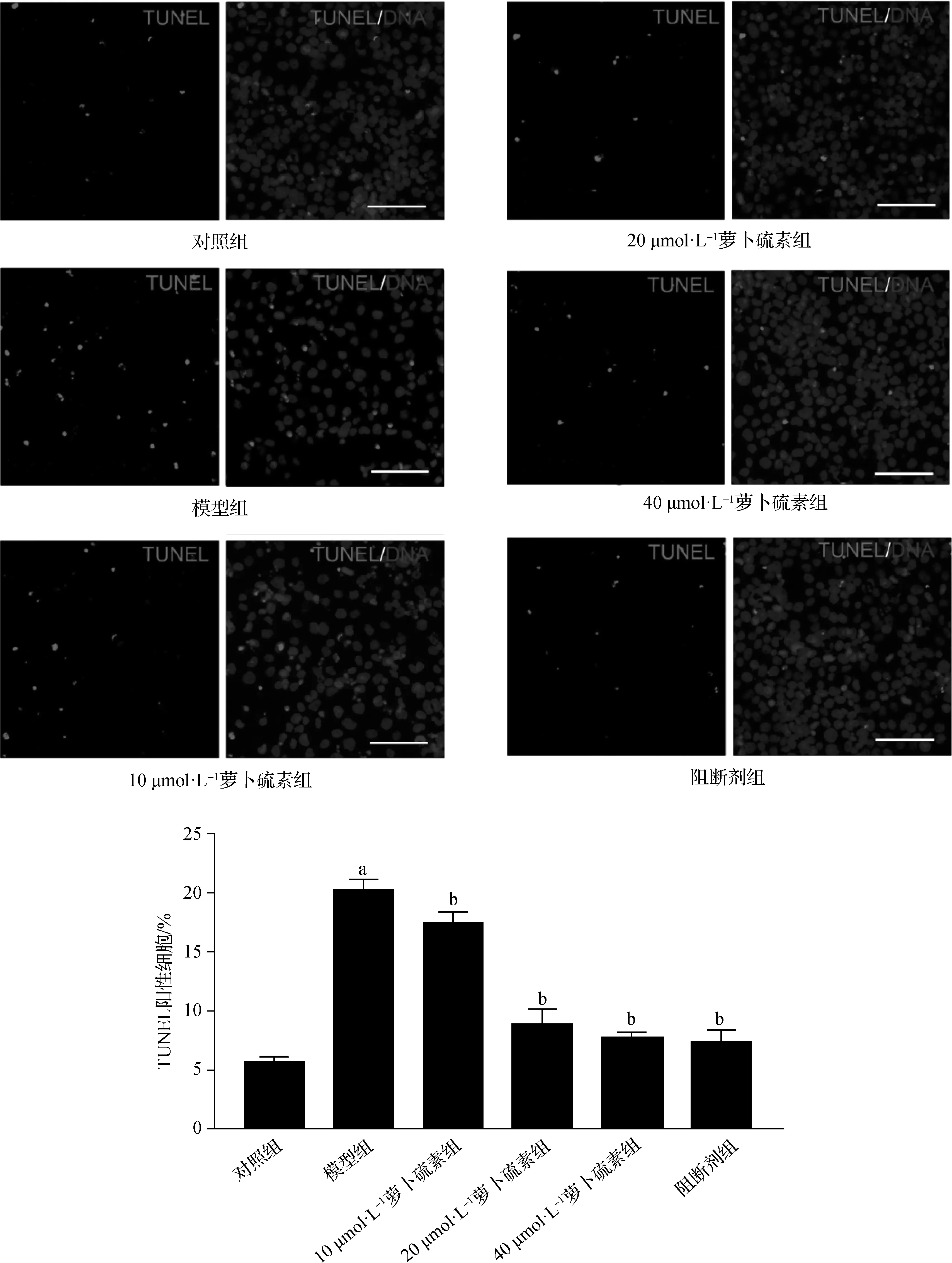
a 与对照组比较,P<0.05; b与模型组比较,P<0.05
2.3 各组HTR- 8/SV- neo细胞MDA含量及SOD、GSH活性比较
HTR- 8/SV- neo细胞中MDA含量及SOD、GSH活性检测结果显示,各组间细胞中同一指标差异均有统计学意义。与对照组比较,模型组细胞中MDA含量显著增加,SOD、GSH活性显著下降(P<0.05);与模型组比较,10、20、40 μmol·L-1萝卜硫素和15 μmol·L-1SB203580作用的细胞中MDA含量显著减少,而SOD、GSH活性显著升高(P<0.05)。见表2。

表2 各组HTR- 8/SV- neo细胞中MDA含量和SOD、GSH活性
2.4 各组HTR- 8/SV- neo细胞TNF- α、IL- 1β和IL- 6含量比较
ELISA检测结果显示,6组间HTR- 8/SV- neo细胞中TNF- α、IL- 1β和IL- 6含量差异均有统计学意义。模型组细胞中TNF- α、IL- 1β和IL- 6含量较对照组显著增加(P<0.05);与模型组比较,经10、20、40 μmol·L-1萝卜硫素和15 μmol·L-1SB203580作用的细胞,TNF- α、IL- 1β和IL- 6含量显著减少(P<0.05)。见表3。

表3 各组HTR- 8/SV- neo细胞TNF- α、IL- 1β和IL- 6水平
2.5 各组HTR- 8/SV- neo细胞JNK/p38MAPK信号通路相关蛋白表达比较
蛋白质印迹法检测结果显示,6组间HTR- 8/SV- neo细胞中各蛋白表达水平差异均有统计学意义。与对照组比较,模型组细胞中 p- JNK与p- p38MAPK蛋白表达水平均显著升高(P<0.05);与模型组比较,10、20、40 μmol·L-1萝卜硫素组作用的细胞中p- JNK蛋白表达水平显著降低(P<0.05),20、40 μmol·L-1萝卜硫素组作用的细胞中p- p38MAPK蛋白表达水平显著降低(P<0.05),15 μmol·L-1SB203580作用细胞后也显著抑制了p- JNK与p- p38MAPK蛋白表达(P<0.05)。见图3与表4。
表4 各组HTR- 8/SV- neo细胞p- JNK、JNK、p- p38MAPK及p38MAPK蛋白表达水平

图3 蛋白质印迹法检测p- JNK、JNK、p- p38MAPK及p38MAPK蛋白表达 A.对照组; B.模型组; C.10 μmol·L-1萝卜硫素组; D.20 μmol·L-1萝卜硫素组; E.40 μmol·L-1萝卜硫素组; F.阻断剂组
3 讨 论
HDCP占妊娠者的大约10%,是目前妇产科处理最棘手的问题。在过去的几十年,HDCP的发病率呈增加趋势,主要归因于产妇肥胖、高龄和合并症等因素。HDCP使得产妇患脑血管疾病、胎儿生长受限、早产以及产妇、围产儿死亡的风险大大增加。HDCP的发病机制源于胎盘异常,其中心环节是滋养细胞功能异常所致的胎盘功能障碍[3]。然而胎盘的正常生长和发育是成功植入和妊娠的关键,并且需要调节胎盘滋养细胞的侵袭能力及其在蜕膜中的分化和增殖[10]。此外,在妊娠期间胎盘功能障碍、先兆子痫和宫内生长受限是导致许多围生儿死亡的主要原因。因此,胎盘滋养细胞的功能在HDCP发病中起着关键作用。本研究结果显示,经L- NAME干预诱导的HTR- 8/SV- neo细胞存活率明显下降,细胞凋亡增加,说明L- NAME干预导致了HTR- 8/SV- neo细胞异常生物学行为的发生。
萝卜硫素能通过调节相关酶来保护细胞免受DNA损伤,改变与细胞周期、凋亡及血管生成有关蛋白质的表达及活性,这在癌症的治疗中起着至关重要的作用[11]。此外,还有研究表明萝卜硫素能够影响核因子E2相关因子2(NRF2)的活化以及对核因子- κB(NF- κB)信号传导途径发挥间接抑制作用,从而抑制组织中的炎症反应[12]。在本研究中,先经10、20、40 μmol·L-1萝卜硫素处理的HTR- 8/SV- neo细胞再经L- NAME干预,提高了细胞存活率,并有效抑制了细胞的凋亡,由此推测,萝卜硫素能够改善HDCP中胎盘滋养细胞的异常凋亡现象。
越来越多的证据表明,高血压是由补体、炎性体的激活以及循环免疫细胞中髓样细胞表型改变所引起[13],因此炎症反应也是高血压的发病机制之一。各炎症过程之间相互依赖,最终通过涉及氧化应激、内源蛋白质修饰以及抗原加工和呈递机制的改变参与适应性免疫反应。同样,在HDCP患者血清中检测到多种炎症因子出现不同程度的变化,并且能够反映HDCP病情严重程度[14]。本研究结果显示,L- NAME干预的HTR- 8/SV- neo细胞中TNF- α、IL- 1β和IL- 6含量增加,该结果也表明在L- NAME诱导模拟的HDCP微环境中出现了炎症反应,而经10、20、40 μmol·L- 1萝卜硫素作用的细胞,TNF- α、IL- 1β和IL- 6含量均明显减少,由此表明萝卜硫素可能会抑制HDCP中胎盘滋养细胞的炎症反应。
氧化应激反应是由活性氧与抗氧化能力之间的不平衡所导致的,是妊娠病理生理过程中的重要因素。当胎盘中的氧化应激超过抗氧化剂防御机制的能力时,氧化损伤会扩散到其他组织。由氧化应激引起的内皮功能障碍与妊娠并发症,包括先兆子痫、早产和反复流产的发病机制有关[15- 17]。SOD和GSH具有抗氧化物酶性质,能够通过协同清除ROS和自由基来减轻氧化性损伤;MDA是脂质过氧化产物,含量的高低可体现氧化反应的状态[18]。本研究结果显示,L- NAME干预的HTR- 8/SV- neo细胞中SOD、GSH活性降低,而MDA含量增加,10、20、40 μmol·L-1萝卜硫素作用后再经NAME干预,细胞中SOD、GSH活性明显升高,MDA含量则减少,这表明萝卜硫素可能会对HDCP内氧化应激反应起到有效的抑制作用。
JNK/p38MAPK信号通路激活后,可通过与底物结合参与炎症反应、细胞增殖与凋亡等过程[19]。本研究结果显示,经L- NAME干预的HTR- 8/SV- neo细胞中p- JNK与p- p38MAPK 蛋白表达水平均升高,而预先使用20、40 μmol·L-1萝卜硫素处理能够抑制p- JNK和p- p38MAPK的蛋白表达水平。此外,进一步研究发现,在L- NAME干预的HTR- 8/SV- neo细胞中预先加入JNK/p38MAPK信号通路阻断剂SB203580处理,结果与萝卜硫素处理细胞再经L- NAME干预的效果一致,即阻断JNK/p38MAPK信号通路能够抑制L- NAME诱导的HTR- 8/SV- neo细胞内氧化应激水平和炎症反应,减少细胞凋亡。这一结果提示,萝卜硫素可能通过抑制JNK/p38MAPK信号通路的激活从而发挥对HDCP中胎盘滋养细胞的保护作用。
综上,萝卜硫素可能通过抑制JNK/p38MAPK信号通路的激活来降低L- NAME诱导的HTR- 8/SV- neo细胞中氧化应激水平,并抑制炎症反应及细胞凋亡。本研究通过在体外利用L- NAME诱导HTR- 8/SV- neo细胞模拟HDCP微环境,阐明了萝卜硫素的作用及其机制,这为临床治疗HDCP的药物研发与应用提供了理论依据。
