前列地尔注射液有关物质检查方法研究
2021-11-04秦向辉常海民甘莉王彦闫超
秦向辉 常海民 甘莉 王彦 闫超
摘 要 目的:建立高效液相色谱方法测定前列地尔注射液中的有关物质。方法:以辛烷基硅烷键合硅胶为填充剂的色谱柱(4.0 mm×250 mm,4 mm)、0.025 mol/L磷酸二氢钠溶液(pH 2.5)为流动相A、乙腈为流动相B,梯度洗脱,流速1 mL/min,检测波长200 nm,柱温35 ℃。结果:前列地尔在0.2~1.6 mg/mL的浓度范围内线性关系良好,检测限为0.06 mg/mL,定量限为0.2 mg/mL,回收率为84.19%~103.30%,RSD为8.4%(n=9)。结论:前列地尔主成分色谱峰可与有关杂质完全分离,方法专属性强,重复性好,可用于前列地尔注射剂有关物质的检查。
关键词 前列地尔 有关物质 注射剂 高效液相色谱
中图分类号:R972.4; R917 文献标志码:A 文章编号:1006-1533(2021)19-0074-05
Study on the determination method for the related substances in alprostadil injections
QIN Xianghui1, CHANG Haimin2, GAN Li3, WANG Yan1, YAN Chao1[ 1. School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China; 2. F.B.C. (Shanghai) Pharmaceutical Technology Co., LTD., Shanghai 201210, China; 3. School of Chemical & Environmental Engineering, Shanghai Institute of Technology, Shanghai 201418, China]
ABSTRACT Objective: To establish an HPLC method for the determination of related substances in alprostadil injections. Methods: HPLC was run on a Merck Superspher 60 RP-Select B column (4.0 mm×250 mm, 4 μm) at the flow rate of 1 mL/min, the detection wave length of 200 nm and column temperature 35 ℃ by gradient elution using 0.025 mol/L sodium dihydrogen phosphate solution (pH 2.5) and acetonitrile as mobile phase A and B. Results: The alprostadil showed good linearity over the range of 0.2-1.6 mg/mL with detection limit 0.06 mg/mL and quantitation limit 0.2 mg/mL, recovery 84.19%-103.30% and RSD (n=9) 8.4%. Conclusion: The chromatographic peaks of main components in alprostadil can be completely separated from the related impurities. The established method is highly specific and reproducible and can be used for the inspection of related substances in alprostadil injection.
KEy wORDS alprostadil; related substances; injections; HPLC
前列地爾是广泛存在于体内的生物活性物质[1],前列地尔注射液是1988年在日本上市的前列地尔脂肪乳制剂[2],临床上主要用于治疗慢性动脉闭塞症、血栓闭塞性脉管炎、闭塞性动脉硬化症等引起的四肢溃疡及微小血管循环障碍引起的四肢静息疼痛,有效改善心脑血管微循环障碍和器官移植后抗栓治疗,用以抑制血栓形成,防止移植后的器官和血管内的血栓形成和血运障碍[3]。
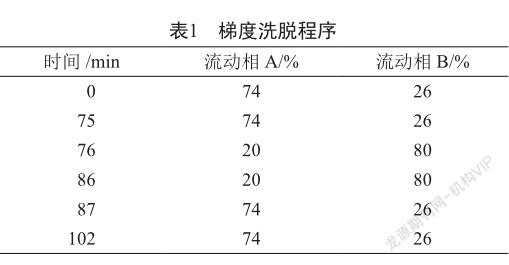
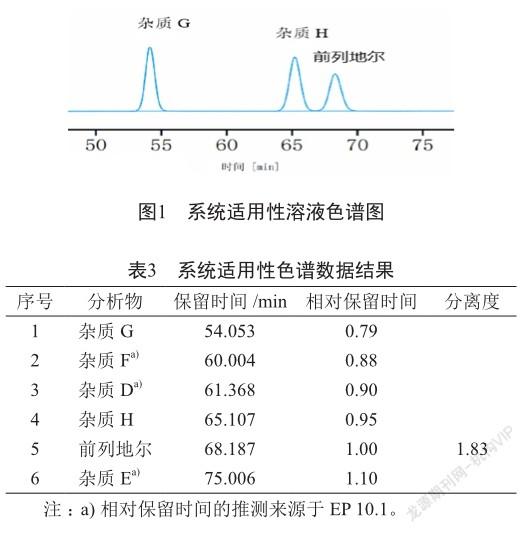
中国药典、美国药典、欧洲药典、日本药典和国家标准(国家食品药品监督管理局国家药品标准WS1 -(X-041)-2002Z-2008)均未关注前列地尔注射液中可能由合成过程引入及贮存过程降解产生的各种杂质[4-8]。因此,有必要建立一套专属性强,重复性好的有关物质检查法,有效控制前列地尔注射液的质量。本研究参考《欧洲药典》(EP10.1)中的前列地尔原料标准[6],建立前列地尔注射液有关物质的检查方法,并采用强制破坏试验,验证主成分与已知杂质及相邻的未知杂质之间达到基线分离,同时对已知杂质进行定量分析(校正因子杂质D、E、F、G、H和单个杂质的校正因子分别为1.0、0.7、0.8、0.7、0.7和1.0,来源于EP10.1),最终,采用加校正因子的主成分自身对照法,对前列地尔注射液进行有关物质检查。
1 材料和方法
1.1 试药和试剂
前列地尔对照品(LGC GmbH公司,批号77025,含量100.2%)、杂质G对照品(EP,批号3,含量99.6%)、杂质H对照品(EP,批号3,含量按100%计)、前列地尔注射液(批号20190703,规格1 mL∶5 mg)和空白辅料溶液(批号19060601)均来自辅必成(上海)医药科技公司。
