饲粮中添加复合益生菌对猪生长、粪便菌群及代谢产物的影响
2021-11-04赵彦光相德才刘韶娜
赵彦光 张 斌 相德才 刘韶娜
(云南省畜牧兽医科学院,昆明 650224)
国家农业农村部已发布194号公告,自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。至此,来源广泛、效果安全和价格低廉的益生菌逐渐成为研究热点,也成为无抗饲料中的抗生素替代物之一。益生菌具有促进生长和抗病等作用。目前,虽然益生菌的研究较多[1-3],但针对复合益生菌对育肥猪肠道菌群和代谢产物影响的研究较少。Lee等[4]研究发现由来自于新生儿粪便、乳制品的乳杆菌和来源于志愿者粪便中的片球菌复合而成的复合益生菌协同作用具有增强细胞活素的作用,而其单菌则不具备此作用。钟晓霞等[5]则发现由枯草芽孢杆菌、解淀粉芽孢杆菌、酿酒酵母和丁酸梭菌等4种菌组成的复合益生菌具有提高断奶仔猪平均日采食量的作用,王磊等[6]则发现由分离自山羊肠道的枯草芽孢杆菌、地衣芽孢杆菌和酿酒酵母等复合而成的复合益生菌具有降低西门塔尔牛血清胆固醇合成和有害菌含量的作用。以上研究多为一种或少数几种复合菌[7-9],且跨种源应用。
虽然复合益生菌对猪的生长和抗病的良好作用报道,但研究还存在以下问题:益生菌分离来源不清晰;试验动物多为外来猪种;地方猪的消化道菌群结构具有特异性,品种间差异较大;部分品种,如藏猪,其对青绿饲料具有耐受性,适用于集约化养殖的外来猪种的复合益生菌无法满足地方猪的需求。且有关于地方猪适用的复合益生菌及其如何通过肠道细菌及代谢产物发挥益生菌的作用机理研究,目前鲜见报道。因此,本研究采用高通量测序技术和代谢组学技术,研究添加6种分离自云南地方猪的复合益生菌,对云南地方育肥猪生长性能、肠道菌群结构和代谢产物的影响,以期为益生菌开发及作用机理的研究提供数据支撑。
1.1 试验材料
试验用复合益生菌制剂为:贝莱斯芽孢杆菌B13(Bacillusvelezensis)、类肠膜魏斯氏菌353(Weissellaparamesenteroides)、赖氨酸芽孢杆菌381(Lysinibacillus)、戊糖片球菌368(Pediococcuspentosaceus)、植物乳杆菌325(Lactobacillusplantarum)和枯草芽孢杆菌386(Bacillussubtilis),均由本实验室从迪庆藏猪消化道中分离并保存,将菌培养至对数期后,按照等比例混合制成复合益生菌制剂,每种菌添加量为106CFU/g。
1.2 试验动物
本试验在云南省畜牧兽医科学院种猪性能测试中心完成,选择无病史、体重(33.75±0.25) kg的“云上飘香猪®”(杜洛克25%×太湖猪25%×迪庆藏猪50%)20头,按照完全随机区组设计,综合猪的日龄和体重情况,随机分为两组,每组2个重复,每个重复5头,对照组饲喂基础日粮,试验组饲喂基础日粮+复合益生菌(饲粮中每种菌添加量为106CFU/g,合计6×106CFU/g,益生菌的用量参考前期试验结果[3,10])。
1.3 试验日粮与管理
基础日粮根据肉脂型猪饲养标准(NY/T 65-2004)进行配方设计,由昆明市东道饲料有限公司根据试验要求加工,试验猪只自由采食和自由饮水,按照管理规程免疫,驱虫、消毒,试验为21 d,日粮组成及营养成分见表1。
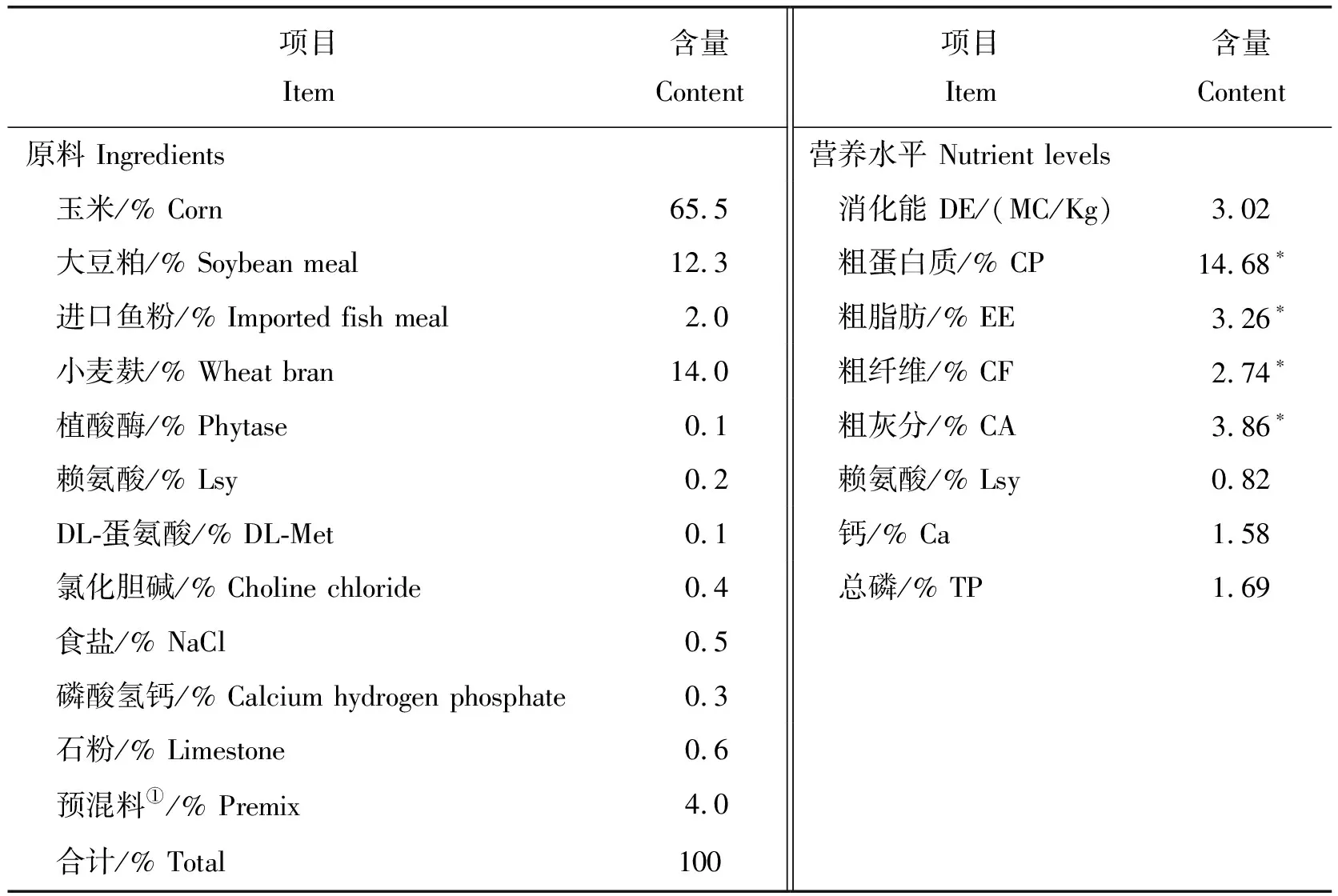
表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of feed (air-dry basis)
1.4 样品采集
试验期间按照要求对试验猪只称重并记录采食,试验结束后计算平均日增重,平均日采食量和料重比。试验结束当天,在称重之前,每个重复随机选择3头猪,收集其粪便样品,样品需选择刚排泄的粪便,用无菌取样器取中间部分,液氮速冻后,-80 ℃保存,用于后续分析。
1.5 16S rRNA PCR扩增
用总DNA抽提使用试剂盒提取DNA(Omega Bio-tek),用超微量分光光度计(NanoDrop2000)检测DNA浓度和纯度;对V3~V4区采用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增,扩增片段大小为468 bp。然后回收、纯化、洗脱和检测(QuantiFluorTM-ST (Promega, USA))。
1.6 高通量测序及数据分析
使用Trimmomatic软件进行序列质控。根据Illumina MiSeq平台,构建文库(PE300)。根据97%的相似度进行OTU聚类,去除单序列和嵌合体,同时在I-Sanger云平台(https:∥cloud.majorbio.com/)对每条序列进行物种分类注释。
1.7 代谢组学分析
通过液质联用技术(LC-MS, UPLC-TripleTOF)在正、负离子模式下检测代谢物,采用Progenesis QI (Waters Corporation, Milford, USA)软件对代谢物注释、数据预处理等,结合t检验和VIP (OPLS-DA)筛选出差异代谢物,并进一步对差异代谢的生物学信息进行挖掘。
1.8 数据分析
数据采用EXCEL 2007整理,通过SPSS 17.0统计软件进行单因素方差分析(One-way ANOVA),用Duncan法进行多重比较,P<0.05表示差异显著,P<0.01和P<0.001均表示差异极显著。数据以平均值±标准差表示。
2 结果与分析
2.1 复合益生菌对猪生长性能的影响
由表2所示,添加复合益生菌后,试验组猪的终末体重、平均日增重和平均日采食量均高于对照组,料重比低于对照组,但差异均不显著(P>0.05)。
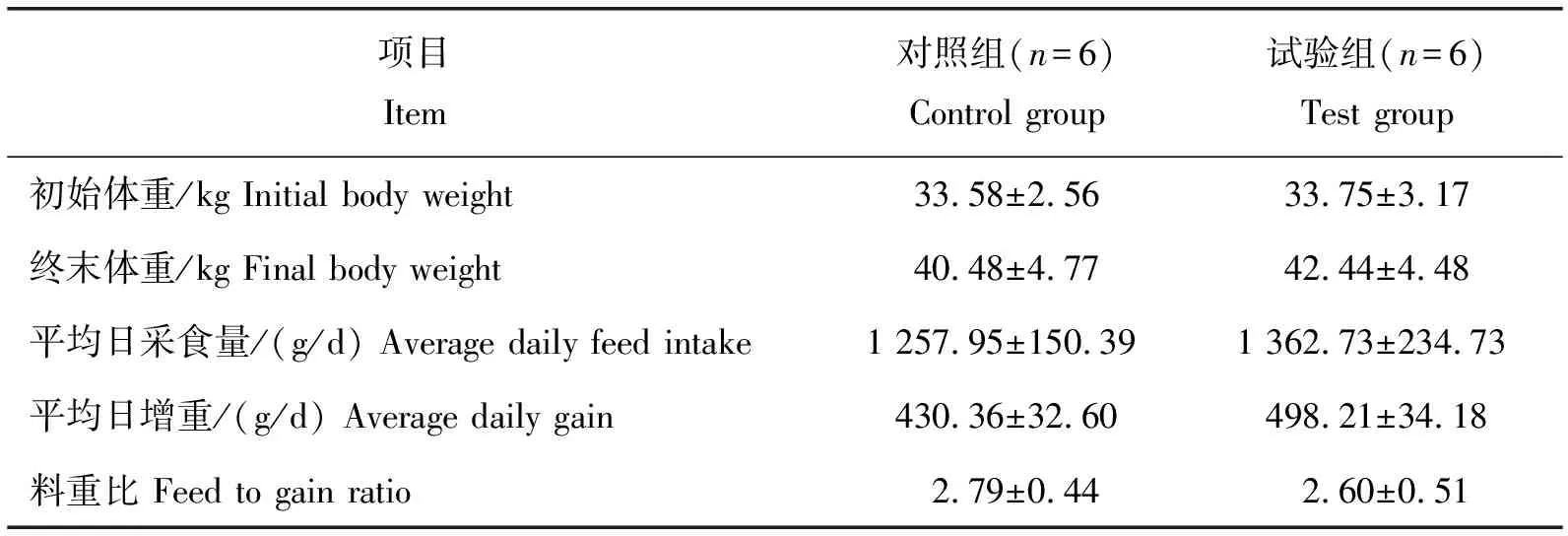
表2 复合益生菌对猪的生长性能影响Table 2 Effects of complex probiotics on growth performance of pigs
2.2 复合益生菌对猪肠道菌群多样性的影响
2.2.1α多样性分析
本研究共获得597 584条高质量序列,平均长度为418.78 nt。按照97 %的相似度聚类,共聚类为1 124个OTU,归属为19个门,26个纲,39个目,71个科,209个属,377个种。
α多样性指数分析见表3,本试验中Coverage指数都在0.999以上,说明测序的深度和广度符合要求。添加复合益生菌后,试验组的Chao1指数和Ace指数显著升高(P<0.05),Shannon指数和Simpson指数均无显著差异(P>0.05)。
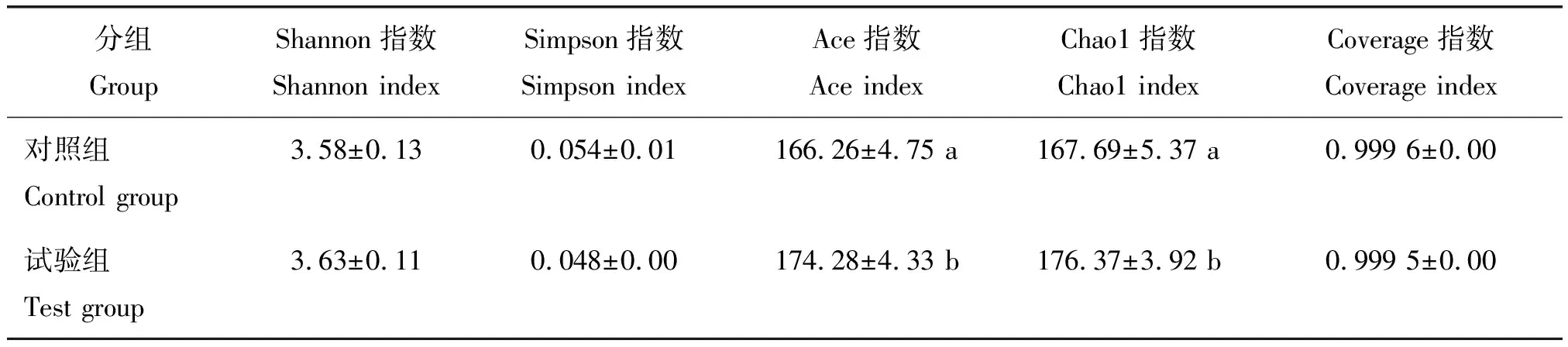
表3 复合益生菌对猪肠道菌群的α多样性指数的影响Table 3 Effects of complex probiotics on alpha diversity index of fecal microbiota of pigs
2.2.3β多样性分析
β多样性分析通过对组间不同样品的微生物多样性进行分析,从而探索试验组和对照组微生物群落组成的相似性或差异性。基于Unweighted unifrac加权距离PCoA分析如图1所示,2个组的12个样品部分重叠未明显分开,说明饲粮中添加复合益生菌具有促进肠道菌群改变和增加肠道物种丰度的作用。
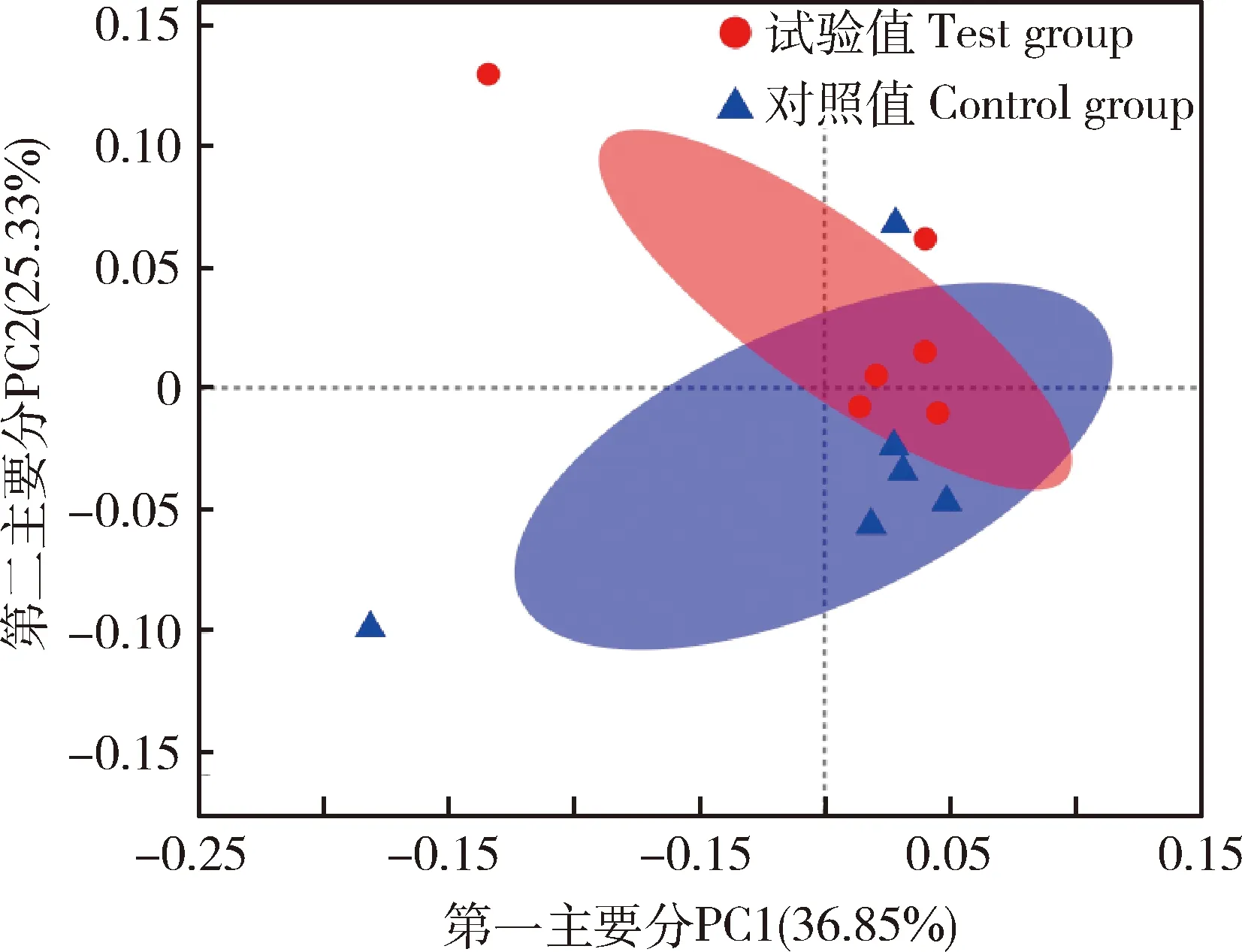
图1 基于Unweighted unifrac距离PCoA分析Fig.1 Analysis of PCoA based on Unweighted unifrac distance
2.3 复合益生菌对猪肠道菌群结构的影响
2.3.1门水平下的优势菌群分布
门水平下的优势菌群分析见表4,相对丰度大于1%的分别为厚壁菌门、拟杆菌门和螺旋体门。90%以上的菌群分布于厚壁菌门和拟杆菌门,添加复合益生菌后,拟杆菌门相对丰度极显著升高(P<0.01),厚壁菌门/拟杆菌门的比值下降,但差异不显著(P>0.05)。
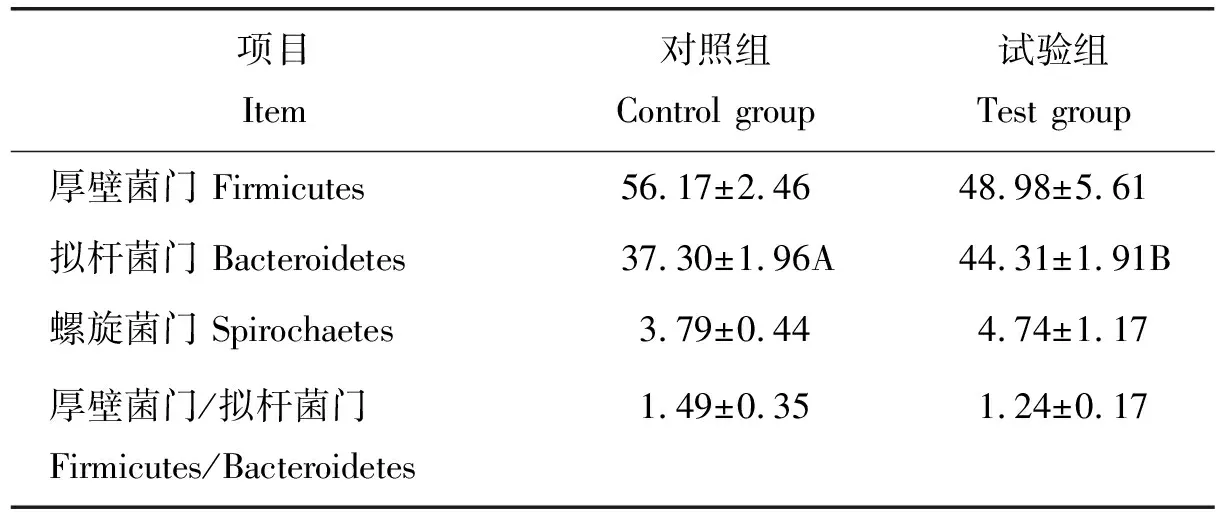
表4 门水平下的优势菌群丰度分布Table 4 Distribution of dominant microflorain the level of phylum %
2.3.1属水平下的菌群分布
属水平下的优势菌群分析结果见表5。试验组和对照组中共计18种菌的相对丰度大于1%。添加复合益生菌后,试验组中理研菌科_RC9肠群的相对丰度极显著性提高(P<0.01),其中理研菌科_RC9肠群属于拟杆菌门。

表5 属水平下的优势菌群分布Table 5 Distribution of dominant microflora in the level of genus %
2.3.5复合益生菌对猪肠道菌群群落组成差异分析
本研究采用了LEfSe方法对试验组和对照组进行了差异分析,结果显示:两组细菌的相对丰度差异显著,LDA值大于2.0时(图2),获得16个生物标记物,其中试验组获得6个生物标记物,对照组获得10个。对照组内LDA值最大的是毛螺菌科AC2044群,试验组LDA值最大的是瘤胃球菌科_UCG_014,这两类是相对丰度差异最大的细菌。门水平上,试验组中柔膜菌门的相对丰度显著高于对照组,纲水平上,试验组的丹毒丝纲的相对丰度则显著低于对照组,而柔膜菌纲则显著高于对照组。目水平上,试验组的柔膜菌目_RF39相对丰度显著提高,肠杆菌目和丹毒丝目相对丰度则显著降低。科水平上,试验组的未命名的丹毒丝菌科_RF39相对丰度显著提高,肠杆菌科和丹毒丝菌科则显著下降。属水平上,试验组中瘤胃球菌科_UCG_014和未命名的柔膜菌目_RF39相对丰度显著上升,毛螺菌科AC2044_群、未命名的丹毒丝菌科、短真杆菌属群、无甾醇原体属和大肠埃希菌-志贺菌属相对丰度则显著下降。大肠埃希菌-志贺菌属为肠道内致病菌,添加复合益生菌后能显著降低其相对丰度。
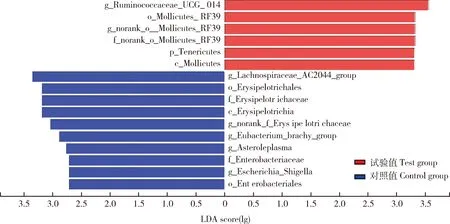
g_Lachnospiraceae_AC2044_group:毛螺菌科_AC2044群;f_Erysipelotrichaceae:丹毒丝菌科;o_Erysipelotrichale:丹毒丝菌目;c_Erysipelotrichia:丹毒丝菌纲;g_norank_f_Erysipelotrichaceae:未命名的丹毒丝菌科;g_Eubacterium_brachy_group:短真杆菌属群;g_Asteroleplasma:无甾醇原体属;o_Enterobacteriales:肠杆菌目;f_Enterobacteriaceae:肠杆菌科;g_Escherichia_Shigella:大肠埃希菌-志贺菌属;g_norank_o_Mollicutes_RF39:未命名的柔膜菌目_RF39属;f_norank_o_Mollicutes_RF39:未命名的柔膜菌目_RF39科;o_Mollicutes_RF39:柔膜菌目_RF39;c_Mollicutes:柔膜菌纲;g_Ruminococcaceae_UCG_014:瘤胃球菌科_UCG_014;p_Tenericutes:柔膜菌门图2 复合益生菌对猪肠道菌群群落组成差异分析Fig.2 Differences of pig intestinal microbiota composition by adding the complex probiotics
2.4 复合益生菌对猪肠道菌群差异代谢产物分析
2.4.1PLS-DA分析
偏最小二乘判别分析(PLS-DA)被用于监督和判别分析样品。正负离子模式下,R2Y分别为0.839 和0.899,模型可靠。图3中两组样品完全分开且分离度较大,显示样品分类效果显著,给猪饲喂复合益生菌后,显著改变了代谢物的组成,阳离子条件下更为明显。
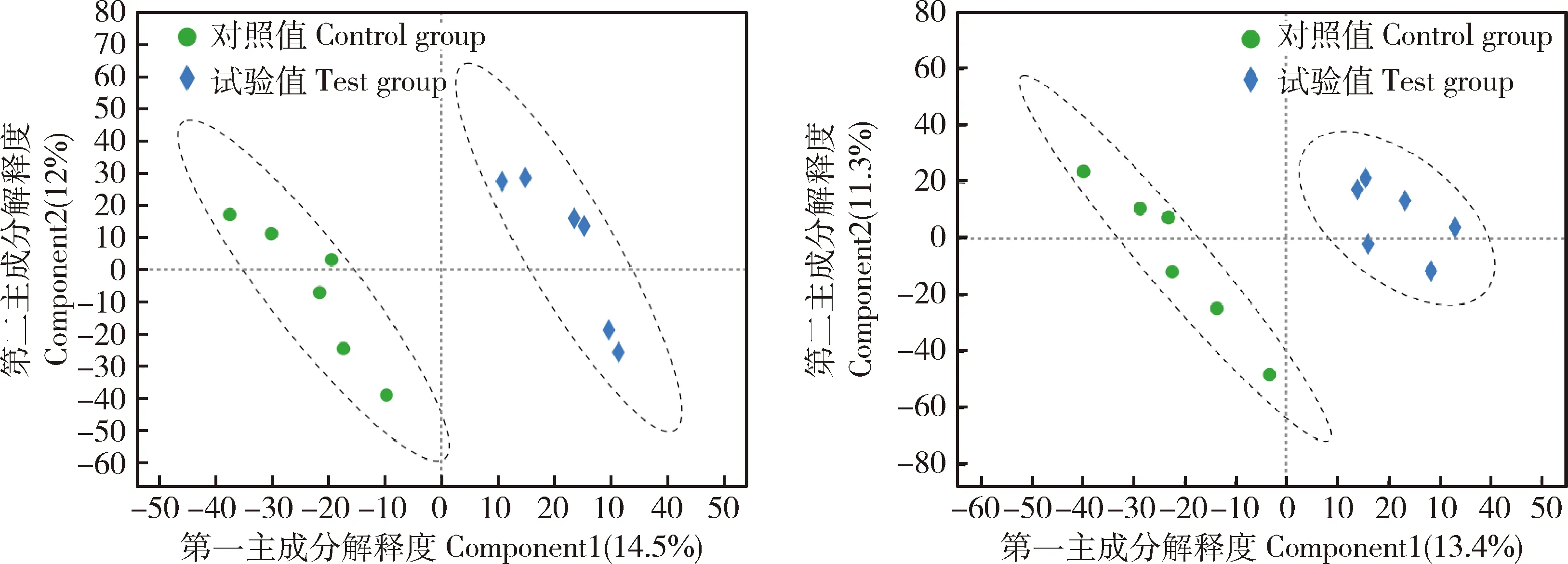
图3 正负离子模式下的PLS-DAFig.3 The PLS-DA chart of positive (a) and negative (b) ion mode
2.4.2代谢物注释
差异显著的代谢产物如表6所示,在正负离子模式下,两组共检出804种差异代谢产物,其中正离子条件下的差异代谢产物为434种,与对照组相比较,304种产物相对表达量上升,130种产物的相对表达量下降;负离子条件下的差异代谢产物为370种,其中260个产物相对表达量上种,110种产物的相对表达量下降,其中前十种显著性差异的代谢物见表6。
由表6可知,雌马酚和磷脂酸是正负离子模式下相对表达量最大的两个差异代谢产物,雌马酚属于显著上调物质(P<0.05),磷脂酸属于极显著下调物质(P<0.01)。添加复合益生菌后,上调的物质有雌马酚、香豆素K、磷酸甘油-N-棕榈酰胆胺、磷脂类化合物、5,6-环氧基-8,11,14-二十碳三烯酸、糖基类化合物和N6-半乳糖基-L-赖氨酸,下调的物质有磷脂酸、肉豆蔻醇和3α-羟基-5β-胆甾-7,9(11)-二亚乙基三胺-24-油酸。
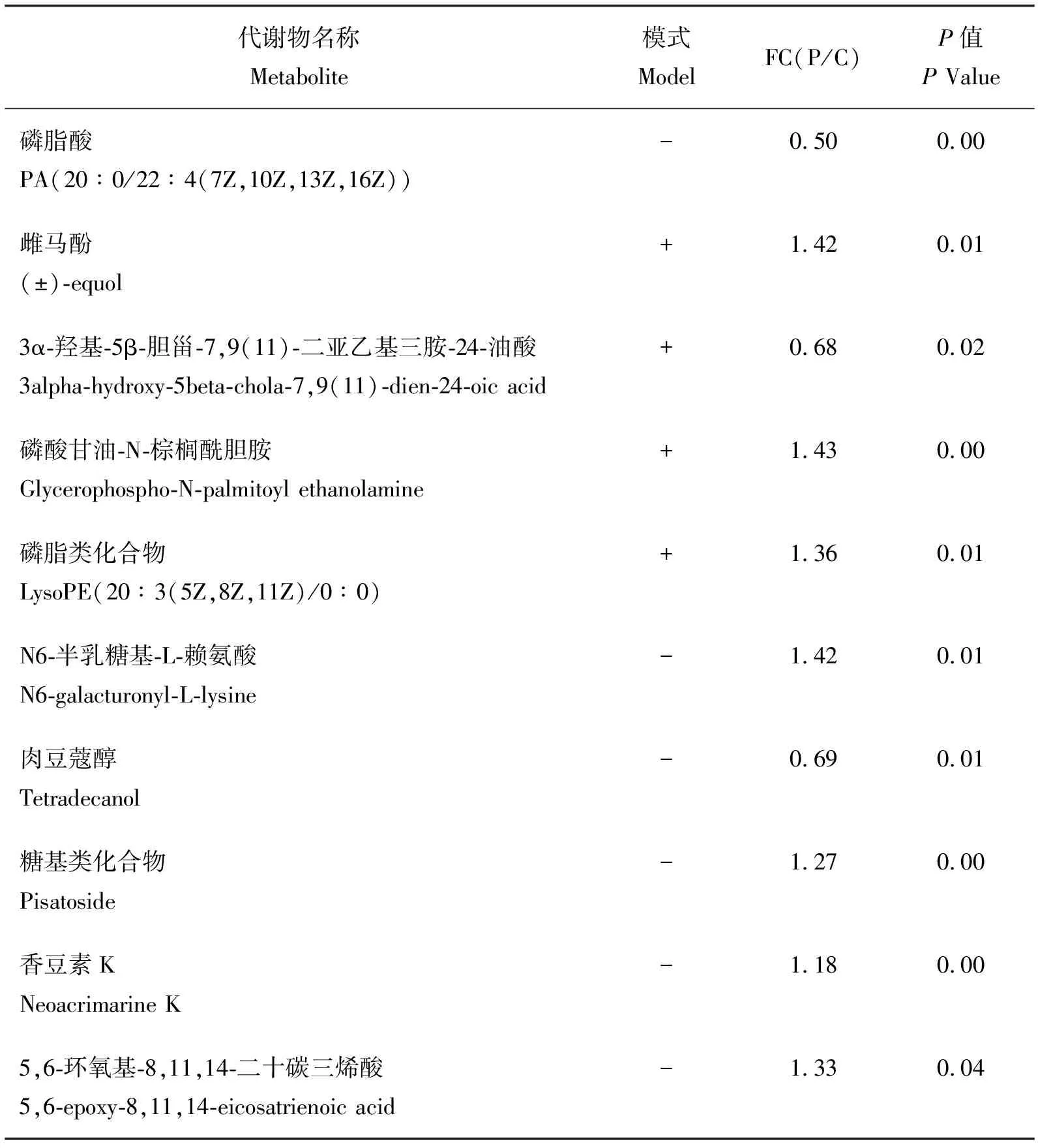
表6 正负离子模式下猪粪中的差异代谢产物Table 6 The significant different metabolites of positive and negative ion mode
2.4.3差异代谢产物和差异菌群的相关性分析
采用Pearson分析方法将差异代谢产物和差异菌群进行相关性分析,如图4所示,大肠埃希菌-志贺菌属、丹毒丝菌科和短真杆菌属群与5,6-环氧基-8,11,14-二十碳三烯酸(P<0.01)和磷脂类化合物(P<0.05)负相关,理研菌科_RC9肠群(P<0.05)、瘤胃球菌科_UCG_014(P<0.01)和柔膜菌目_RF39属(P<0.01)与磷脂类化合物正相关,同时,这三个菌属也与5,6-环氧基-8,11,14-廿碳三烯酸(P<0.05)正相关;无甾醇原体属(P<0.05)、大肠埃希菌-志贺菌属(P<0.01)、丹毒丝菌科(P<0.05)和毛螺菌科_AC2044群(P<0.01)与磷酸甘油-N-棕榈酰胆胺负相关,而瘤胃球菌科_UCG_014和柔膜菌目_RF39属与其正相关(P<0.05);无甾醇原体属和丹毒丝菌科与雌马酚负相关(P<0.05),而瘤胃球菌科_UCG_014和柔膜菌目_RF39属与其正相关(P<0.05);无甾醇原体属(P<0.01)和毛螺菌科_AC2044群(P<0.05)与香豆素K呈负相关,而瘤胃球菌科_UCG_014和柔膜菌目_RF39属与其正相关(P<0.05);无甾醇原体属(P<0.01)、大肠埃希菌-志贺菌属(P<0.05)和毛螺菌科_AC2044群(P<0.05)与N6-半乳糖基-L-赖氨酸呈负相关,而柔膜菌目_RF39属则与其正相关(P<0.05);无甾醇原体属(P<0.01)与肉豆蔻醇正相关,而柔膜菌目_RF39属则与其负相关(P<0.05);无甾醇原体属和丹毒丝菌科与磷脂酸正相关(P<0.05),理研菌科_RC9肠群(P<0.05)、瘤胃球菌科_UCG_014(P<0.01)和柔膜菌目_RF39属(P<0.01)与磷脂酸负相关;柔膜菌目_RF39属与3α-羟基-5β-胆甾-7,9(11)-二亚乙基三胺-24-油酸呈显著负相关(P<0.05)。
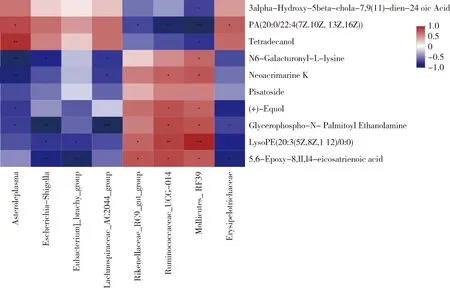
Erysipelotrichaceae:丹毒丝菌科;Eubacterium_brachy_group:短真杆菌属群;Asteroleplasma:无甾醇原体属;Escherichia_Shigella:大肠埃希菌-志贺菌属;Mollicutes_RF39:柔膜菌目_RF39属;Ruminococcaceae_UCG_014:瘤胃球菌科_UCG_014;Rikenellaceae_RC9_gut-group:理研菌科_RC9肠群;Lachnospiraceae_AC2044_group:毛螺菌科_AC2044群PA(20:0/22:4(7Z,10Z,13Z,16Z)):磷脂酸;(±)-Equol:雌马酚;3alpha-Hydroxy-5beta-chola-7,9(11)-dien-24-oic Acid:3α-羟基-5β-胆甾-7,9(11)-二亚乙基三胺-24-油酸;Glycerophospho-N-Palmitoyl Ethanolamine:磷酸甘油-N-棕榈酰胆胺;LysoPE(20∶3(5Z,8Z,11Z)/0∶0):磷脂类化合物;N6-Galacturonyl-L-lysine:N6-半乳糖基-L-赖氨酸;Tetradecanol:肉豆蔻醇;Pisatoside:糖基类化合物;Neoacrimarine K:香豆素K;5,6-Epoxy-8,11,14-eicosatrienoic acid:5,6-环氧基-8,11,14-二十碳三烯酸;*:差异显著(P<0.05);**:差异极显著(P<0.01);***:差异极显著(P<0.001)*: Significantly different (P<0.05); **: Extremly different (P<0.01); ***: Extremly different (P<0.001)图4 差异菌群与差异代谢产物的关联分析Fig.4 Correlation analysis between microbiota and metabolites
理研菌科_RC9肠群、瘤胃球菌科_UCG_014和柔膜菌目_RF39属与3α-羟基-5β-胆甾-7,9(11)-二亚乙基三胺-24-油酸、磷脂酸和肉豆蔻醇呈负相关趋势,与香豆素K、N6-半乳糖基-L-赖氨酸、糖基类化合物、雌马酚、磷酸甘油-N-棕榈酰胆胺、磷脂类化合物和5,6-环氧基-8,11,14-二十碳三烯酸呈正相关趋势;而无甾醇原体属、短真杆菌属群、大肠埃希菌-志贺菌属(P<0.05)、丹毒丝菌科和毛螺菌科_AC2044群与这十种代谢物的相关趋势则相反。
3 讨 论
3.1 复合益生菌对猪生长性能的影响
益生菌具有抗病促生长的作用。目前已报道的益生菌有芽孢杆菌、双歧杆菌、乳酸菌和酵母菌等。但由于菌的品种、添加剂量、试验动物和试验环境等的差异性,试验结果也不完全相同。解淀粉芽孢杆菌能提高患高白斑病毒感染小龙虾的成活率[11],提高鸡的精子质量和卵子的孵化率[12],并能抑制奇异变形杆菌的生长[13];枯草芽孢杆菌具有提高育肥猪的日增重和降低料重比的作用[14]。乳酸菌是青贮中常用菌[15],具有隔离病菌的生物膜作用[16],酵母菌能提高其生物活性[17],能促进生长,促进免疫应答和抗病[18]。李宗凯等[19]发现复合乳酸菌和枯草芽孢杆菌能显著提高结肠中瘤胃球菌属的相对丰度,显著提高生长期猪的日增重、日采食量和终末体重的作用,对育肥期猪的生长性能具有提高趋势,但差异不显著。李浩等[20]研究发现由枯草芽孢杆菌、粪肠球菌和丁酸梭菌组成的复合益生菌能提高营养物质消化率,对猪生长性能的促进作用需要随时间的推移逐渐显现。芽孢杆菌和乳酸菌类是复合益生菌中常用的菌种,本研究中复合益生菌的种类也主要集中在这两类,研究用菌均来源于半放牧模式的云南地方猪(迪庆藏猪等)消化道,复合后又应用于云南地方猪,理论上具有更好的适应性。种类上选择具有协同性的菌,主要由贝莱斯芽孢杆菌、类肠膜魏斯氏菌、赖氨酸芽孢杆菌、戊糖片球菌、植物乳杆菌和枯草芽孢杆菌组成,其种类较以往研究更为丰富,其中贝莱斯芽孢杆菌和类肠膜魏斯氏菌在猪上的应用较为罕见,但在高海拔地区猪消化道较为常见。本研究选择6种地方猪消化道中优势菌,旨在更好地应用于云南地方猪,促进其健康养殖,提高试验猪只的生长和生产性能,这其中贝莱斯芽孢杆菌具有显著提高短链脂肪酸产生菌和促进乳杆菌生长,抑制条件致病菌链球菌的功能[3],戊糖片球菌则具有提高抗病菌并降低链球菌属等条件致病菌的相对丰度的作用[10],此6种菌相互协同,共同发挥益生作用,且在超早期断奶仔猪中应用,发现复合益生菌具有提高断奶仔猪肠道微生物结构向成年猪转化速率的趋势,对于断奶应激造成的肠道菌群失衡,能够更快速地建立新的平衡。本研究表明,添加复合益生菌后,可提高生长性能,但差异不显著,可显著改变菌群结构和代谢物质,说明添加益生菌具有提高生长性能和抗病的趋势,后期应该就时间、添加剂量及微生物之间的配比继续研究,使这种趋势呈现显著性变化,以期为复合益生菌更好地应用提供依据。
3.2 复合益生菌对猪粪便菌群的影响
肠道微生物与宿主的营养代谢和免疫功能[21]及疾病显著相关[22-24]。肠道菌群的结构和丰度与营养和代谢疾病等显著相关,越来越多的学者也关注菌群的比例与机体营养代谢和疾病等相关性,其中厚壁菌门/拟杆菌门的丰度比值是近年来关注的热点。厚壁菌门/拟杆菌门的比值与病理性肥胖[25]和脂肪的贮存[26-27]呈正相关,高脂食物能可提高其比值[28],菌群代谢产物丁酸钠[29]、菊粉等益生元[30]和植物乳杆菌等特定益生菌[31]可降低其比值。Lee等[7]发现复合益生菌可以缓解小鼠脂肪肝,显著降低肝脏/体重比值和厚壁菌门/拟杆菌门的比值。本研究在育肥猪饲粮中添加6种益生菌组合的复合益生菌后,厚壁菌门与拟杆菌门的比值下降,但差异不显著,说明添加复合益生菌或具有促进厚壁菌门/拟杆菌门的比值下降的趋势,但是否能达到显著性差异,后期应该关注并探讨试验动物、试验时间及复合菌的浓度等试验因素对结果的影响程度。
理研菌科是肠道内的优势菌,与黏蛋白降解相关[32],与机体肥胖显著呈负相关[33-34],对肠道黏膜健康具有重要作用。瘤胃球菌属是猪肠道内常见的肠道共生菌,菌体表面可表达2种“超级抗原”蛋白,分别为IbpA(热激蛋白A)和IbpB(热激蛋白B),在体外可以激活表达B细胞,体内可以激活免疫球蛋白IgA[35],同时理研菌科相对丰度与宿主的饲料利用率、挥发性脂肪酸和短链脂肪酸的代谢呈正相关[36-37],与胰岛素水平[38]和干扰素IFNγ[39]等炎症相关免疫基因的表达显著负相关。瘤胃球菌属是肠道内优势菌,能够利用糖结合蛋白(RgCBM40)与杯状细胞分泌的黏液及纯化的黏液蛋白结合,并以唾液酸为媒介,降解黏液蛋白[40]。还能产生瘤胃球菌素C1(RumC1),通过抑制核酸合成而抗致病性梭菌和多重耐药菌[41]。本研究发现添加复合益生菌后,极显著提高了理研菌科_RC9肠群的相对丰度,显著提高了瘤胃球菌科_UCG_014的相对丰度。此二种菌均与黏蛋白的降解正相关,与肠道粘膜健康具有重要作用,对维护肠道健康具有促进作用,试验结果提示,添加复合益生菌对调节肠道菌群发挥维护粘膜健康,抵抗有害菌具有促进作用。理研氏菌科的相对丰度上升和厚壁菌门/拟杆菌门比值的下降趋势提示添加复合益生菌或对猪的脂肪含量具有一定的控制作用,但还需后续屠宰试验验证。
3.3 复合益生菌对猪肠道代谢物质的影响
肠道是营养物质消化吸收的重要器官。在试验动物和饲料基本相同的前提条件下,由于肠道内微生物的结构和丰度等差异而导致代谢产物的差异,目前还是研究的热点问题。本研究发现添加复合益生菌后,粪便中雌马酚和香豆素K等物质的相对含量显著或极显著上调。雌马酚对血清和尿液代谢物具有显著影响,与心脑血管和代谢疾病负相关[42]。香豆素具有拮抗细菌和真菌的作用[43],能促进黄曲霉毒素降解菌的生长[44],对全齿复活线虫具有致死性[45]。相关性分析数据显示此二者代谢产物均与瘤胃球菌科_UCG_014和不同分类水平的柔膜菌显著正相关。从而可知,添加复合益生菌或通过促进瘤胃球菌科_UCG_014等菌相对丰度从而促进粪便中雌马酚和香豆素含量的提高。
4 结 论
猪饲粮中添加来源于迪庆藏猪消化道的6种益生菌组合的复合益生菌可提高育肥猪粪菌的α多样性,丰富菌群的结构,并在属水平上可极显著提高理研菌科_RC9肠群的相对丰度,提高与心脑血管和代谢疾病负相关物质(雌马酚)和抗菌物质(香豆素K)的含量,具有潜在抗病和抗菌的趋势。
