猪圆环病毒3型PCR检测方法的建立及应用
2021-11-04赵兴华赵志强段保宁郑丽丽李杰峰
杨 威,田 青,,赵兴华,何 欣,赵志强,刘 月,段保宁,程 龙,郑丽丽,李杰峰
(1.河北省畜牧兽医研究所,保定 071000;2.河北农业大学动物医学院,保定 071000;3.邯郸市饲料工业办公室,邯郸 056002;4.邯郸市动物疫病预防控制中心,邯郸 056002)
猪圆环病毒(Porcine circovirus,PCV)是到目前已知最小的动物病毒[1],PCV属于圆环病毒科圆环病毒属,为单股环状DNA病毒。现已知3个血清型,即PCV1、PCV2和PCV3。猪圆环病毒3型(Porcine circovirus type 3,PCV3)是一种新型的猪圆环病毒,于2015年在美国被发现,该病毒基因组长2.0 kb[2],同PCV1、PCV2相似,也包含两个开放阅读框(Rep和Cap)。已有研究表明,PCV3可能垂直传播或导致母猪繁殖障碍[2-3],美国学者Phan等[4]发现猪圆环病毒3型Rep蛋白编码296aa,但其却并非以ATG起始编码,另外位于互补链上的Cap蛋白编码231aa。
2016年,致病性的PCV3首次在我国被发现。目前,该病原在我国的8个省及1个直辖市均可以检测到。猪圆环病毒3型感染以后会导致机体免疫系统障碍,引起免疫疾病、继发感染等。PCV3在国内外已逐渐呈现流行的趋势,给生猪养殖产业造成相当大的经济损失。目前国内尚缺乏猪圆环病毒3型的快速检测方法,因此,建立一种针对猪圆环病毒3型快速的检测方法具有重要意义。本研究针对PCV3建立快速检测方法,为PCV3检测、流行病学监测以及发病机理的研究提供技术支持。
1 材料和方法
1.1 病料及阳性模板 本实验采用的猪圆环病毒3型阳性病料为来自本实验室保存的样本。猪圆环病毒2型(Porcine circovirus type 2,PCV2)、伪狂犬病病毒(Pseudorabies virus,PRV)阳性核酸均来自于本实验室。特异性实验所用猪细小病毒(Porcine parvovirus,PPV)、猪瘟病毒(Classical swine fever virus,CSFV)、高致病性猪繁殖与呼吸障碍综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、口蹄疫病毒(Foot and mouth disease virus,FMDV)阳性模板均为实验室保存的阳性核酸。临床样品共157份,来自2018年河北地区6个猪场送检的待检淋巴结组织。
1.2 仪器 LifeECO基因扩增仪购自杭州博日科技有限公司;JY300型电泳仪购自北京君意东方电泳设备有限公司;凝胶成像系统购自西盟国际集团;K5500超微量分光光度计购自北京凯奥科技发展有限公司;荧光定量PCR仪购自卡尤迪生物科技(北京)有限公司。
1.3 试剂 TIANamp Genomic DNA Kit血液/细胞/组织基因组DNA提取试剂盒、D2000购自天根生化科技有限公司;Gold view核酸染色剂购 自酷来搏科技有限公司;2×TaqMaster Mix购自近岸蛋白质科技有限公司;TaqMan荧光定量试剂盒购自北京TIANGEN生化科技有限公司。
1.4 引物的设计与合成 通过检索GenBank上发表的猪圆环病毒3型序列,用DNAStar软件比对,选取基因保守区域,用NCBI在线引物设计程序进行引物设计。参考猪圆环病毒3型毒株为PCV3 strain 29160(GenBank登录号:KT869077.1),引物委托生工生物工程(上海)股份有限公司合成,序列为F:5'-TTGTGGTGCTACGAGTGTCC-3';R:5'-CGTCTCCGTCAGAATCCGAG-3'。
1.5 PCV3目的基因扩增与鉴定 依照组织DNA提取试剂盒操作说明对样品进行DNA提取。PCR反应体系为:PCR mix 10 μL,正、反向引物各0.5 μL,模板DNA 1 μL,补充ddH2O至20 μL。反应程序为:95℃预变性5 min;95℃变性20 s,57℃退火20 s,72℃延伸1 min,30个循环;72℃再延伸10 min。
1.6 PCV3测序验证 收集扩增出的PCR阳性产物进行测序,将测序结果输入GenBank数据库进行序列比对,用DNAStar软件比对所得核酸序列与GenBank中收录的PCV3序列的同源性。
1.7 PCR特异性试验 分别取本实验室保存的7种猪常见病原核酸的阳性模板与提取的猪圆环病毒3型DNA阳性模板用以上引物同时做PCR扩增,电泳检测。
1.8 PCR敏感性试验 对提取的猪圆环病毒3型DNA检测核酸浓度进行10-1~10-8稀释,取1 μL作为模板,用本研究建立的PCR方法进行扩增,电泳检测。
1.9 重复性试验 取3份阳性病料分别提取DNA,采用本研究建立的PCR检测方法分别对这3份阳性模板进行扩增,各重复扩增3次,重复多孔同步验证重复性。
1.10 临床样品检测 对2018年来自河北地区6个猪场送检的157份待检淋巴结组织样品,采用本研究建立的PCR方法对PCV3进行检测,同时利用荧光定量PCR技术对该样品进行PCV2、PRV、CSFV、HP-PRRSV、FMDV快速检测。验证两种检测PCV3与其他猪常见病原是否存在混合感染现象,并对检测结果进行分析讨论。
2 结果
2.1 PCV3测序验证结果 对PCR产物测序的结果如下:5'-TTGTGGTGCTACGAGTGTCCTGAAGATA AGGACTTTTATTGTCATCCTATTCTAGGTCCGG AGGGAAAGCCCGAAACACAGGTGGTGTTTTAC GATAAACAACTGGACCCCGACCGAGTGGGAAT CTATTGTGGAGTGTGGAGGCAGTATAGCGAGA TACCTTATTATCGGCAAAGAGGTTGGAAAAAG CGGTACCCCACACTTGCAAGGGTACGTGAATT TCAAGAACAAAAGGCGACTCAGCTCGGTGAAG CGCTTACCCGGATTTGGTCGGGCCCATCTGGAG CCGGCGAGGGGGAGCCACAAAGAGGCCAGCG AGTATTGCAAGAAAGAGGGGGATTACCTCGAG ATTGGCGAAGATTCCTCTTCGGGTACCAGATCG GATCTTCAAGCAGCAGCTCGGATTCTGACGGA GACG-3'。将测得的序列输入GenBank数据库进行序列比对,确定所得序列为猪圆环病毒3型序列,用DNAStar软件比对所得核酸序列与GenBank中收录的6条PCV3序列同源性,同源性达到99.8%~100%。
2.2 特异性检测结果 按照建立的PCR方法分别对7种常见病原核酸(PPV、PRV、PCV2、CSFV、HPPRRSV、PEDV、FMDV阳性核酸)进行检测。结果显示,只有PCV3阳性样品扩增出1条约418 bp的条带,而另7种猪常见病原核酸的阳性模板均无任何条带扩增(图1)。

图1 PCR特异性检测Fig.1 Specificity test of PCR products
2.3 敏感性检测 将提取的PCV3模板DNA进行10-1~10-8倍稀释后进行敏感性试验。结果显示,该方法能够扩增出PCV3模板DNA的最大稀释度为10-5(图2),即能够扩增的最低模板量为1.13×10-3ng/μL,表明该方法具有较好的敏感性。

图2 PCR敏感性检测Fig.2 Sensitiveness test of PCR products
2.4 重复性检测结果 用本研究建立的PCR检测方法对3份阳性样品分别进行PCR扩增,3份样品均扩增出了418 bp的目的条带,结果均为阳性,该方法重复性较好。
2.5 流行病学调查中PCV3检测方法的应用 用本研究建立的PCR检测方法对2018年来自河北地区的6个猪场送检的157份待检样品进行PCV3检测,结果显示25份样品为阳性,总阳性率为15.92%(表1)。
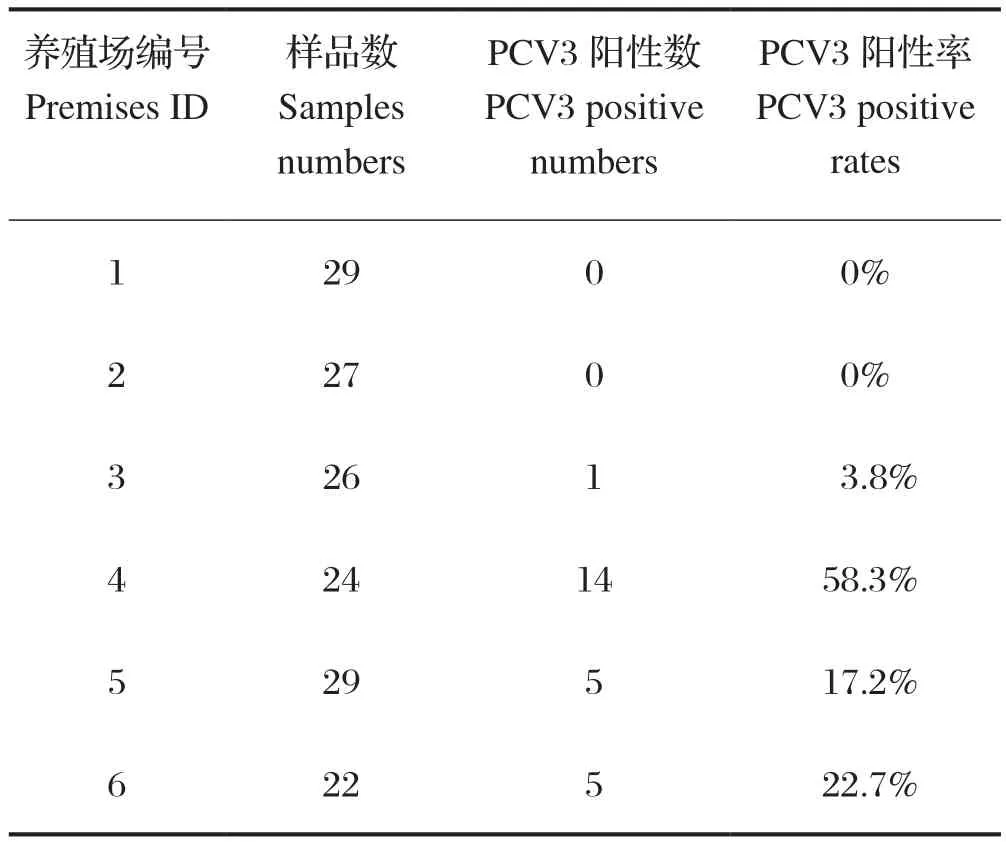
表1 样品PCV3检测结果统计表Table 1 PCV3 test statistics of pig samples
采用荧光定量PCR方法对该样品进行PCV2与PRV的快速检测,结果显示6个猪场中4个为PCV2阳性猪场,总样本阳性率为8.28%(表2);PRV检测阳性猪场为5个,总样本阳性率为15.29%(表3)。同样采用荧光定量PCR方法对CSFV、HP-PRRSV、FMDV进行检测,均未检出阳性样本。

表2 样品PCV2检测结果统计表Table 2 PCV2 test statistics of pig samples

表3 样品PRV检测结果统计表Table 3 PRV test statistics of pig samples
混合感染情况来看,多数PCV3和PRV感染都与PCV2混合感染,其中PCV2与PRV混合感染样品共6份,占所有样品的3.82%;PCV2与PCV3混合感染样品共9份,占所有样品的5.73%;未发现PRV与PCV3的混合感染;未发现PCV2、PCV3、PRV三重感染。
3 讨论
2016年以来,Palinski等[2,4]相继在美国不同地区的猪场检出了PCV3,2017年Ku等[3-5]在福建、辽宁、广东等11个省市发现猪群中存在PCV3感染,由此推测PCV3在国内外已呈现逐渐流行的趋势,但是目前国内尚缺乏PCV3的快速检测方法。传统诊断病毒的方法有很多,例如间接ELISA、免疫组织化学,病毒分离技术等[4,6-9],但间接ELISA技术需要制备特异性抗体,后两个方法则需要苛刻的条件,PCR技术凭借其快速、特异、敏感和易于操作的优点,已广泛应用于畜禽传染病的检测、鉴别诊断[5,10]。本研究为克服现有PCV3快速检测手段的不足,提供了一种PCV3核酸的PCR检测方法。该方法能够扩增的最低模板量为1.13×10-3ng/μL,与猪的7种常见病原核酸无交叉反应情况,具有良好的敏感性、特异性和重复性,可以对PCV3进行定性鉴别,从而为新型病毒猪圆环病毒3型的检测和监控提供有效方法。本研究建立的PCR检测方法为猪圆环病毒3型的检测及流行病学监测、致病机理的研究提供技术支持。
利用本研究建立的PCR检测方法,对来自河北地区的6个猪场送检的157份待检样品进行PCV3检测,其中检出阳性样本25份,阳性率为15.92%,其中4个猪场中检测到PCV3阳性,两地猪场的PCV3检出率约为0%~60%,表明河北省部分地区猪圆环病毒3型已经流行,部分猪场感染严重,应该提高警惕。
本次调查中所检测的PCV3阳性率为15.92%,高于2017年河北地区所报道的阳性率[11],但低于同时期报道的华南地区的PCV3检测结果[12]。由此初步推测,PCV3流行情况随时间推移呈现逐步加剧的情况。这与对于华东地区PCV3流行情况的调查结果相似[13-14],华东地区PCV3的阳性率从2011年到2017年间,阳性率由4.1%升至35.0%,呈现上升趋势。
本实验所采用的检测方法与已报道的其他方法相比[15-16],特异性试验中共检测了7种猪病原核酸的阳性模板,几乎包括了所有常见的猪病病原。另外,应用范围扩大至157份,对本方法进行了充分的检测应用。本实验所用引物扩增片段大小为418 bp,与已报道的其他检测方法中的扩增片段大小有所差异[11,13,17],方便研究者根据不同的扩增片段大小设计多重PCR检测方法。
采用荧光定量PCR检测方法对157份样品进行PCV2与PRV快速检测,结果显示PCV2的阳性率为8.28%,PRV的阳性率为15.29%,其中PCV2与PCV3的混合感染率为5.73%,而PRV与PCV3不存在交叉感染。Ku等[3]采用普通PCR技术对来自辽宁、重庆的3个猪场中222份样品进行PCV2与PCV3的检测结果显示,PCV2阳性率为62.2%,PCV3阳性率为34.7%,两者混合感染率为15.8%,这个结果与本研究中的结果相差较大,可能与地域、气候等外界因素有关,也可能与养殖场PCV2免疫情况的差异有关。综合本次检测情况来看,PCV2与PCV3存在交叉感染,且多数PCV2感染伴随PCV3感染,且两者所引起的疾病症状极为相似,在针对PCV2的防治与研究工作中,应特别注意是否存在PCV3的混合感染情况,防止由于PCV3的存在而影响对PCV2致病性的判断。国内对PCV2的致病机制与流行病学分析做了大量研究,但对PCV3的研究却非常少,所以PCV3的致病机制及与其他病原体的混合感染情况是目前亟需研究清楚的问题,对PCV3流行病学的深入研究将有助于了解其致病特性和制定有效的防控手段,同时也可为解决PCV2与PCV3混合感染问题提供理论基础。
综上所述,本研究建立了一种PCV3的PCR方法,该方法具有良好的特异性和敏感性。应用该方法进行流行病学调查,发现部分猪场具有较普遍的PCV3感染情况。就本次检测的样本分析,PCV2与PCV3存在较普遍的交叉感染情况,应引起重视。
