NDV感染促进hnRNPA1进入细胞质帮助病毒增殖
2021-11-04姜维雨
姜维雨,丁 铲,廖 瑛
(中国农业科学院上海兽医研究所,上海 200241)
新城疫是危害养禽业的一类动物疫病,由感染新城疫病毒(Newcastle disease virus,NDV)引起,以高热、呼吸困难、下痢、神经紊乱、黏膜和浆膜出血为症状,具有很高的发病率和死亡率。NDV基因组RNA长度为15 186 bp,依次编码6个结构蛋白:核衣壳蛋白(nucleocapsid protein,NP)、磷蛋白(phosphate protein,P)、基质蛋白(matrix protein,M)、融合蛋白(fusion protein,F)、血凝素神经氨酸酶蛋白(hemagglutinin-neuraminidase protein,HN)和大分子蛋白(large protein,L)。P基因还通过RNA编码两个非结构蛋白:V和W。NP的氨基端包裹病毒基因组RNA,以避免其被降解[1];其羧基端则发挥RNA聚合酶的作用[2]。M蛋白为疏水蛋白,没有跨膜区,位于囊膜与核衣壳之间。在病毒复制早期,M蛋白定位于细胞核内;在病毒复制晚期,M蛋白出核到达细胞膜,与F蛋白和HN蛋白相互作用,并与核衣壳结合,最终完成病毒粒子组装和出芽。另有研究表明,M蛋白负责维持病毒核衣壳的球形形状[3]。
核不均一核糖体蛋白(heterogeneous nuclear ribonucleoprotein,hnRNP)有A和B两个亚家族,主要分布在细胞核内,与细胞核中的前体mRNA相互作用,影响前体mRNA的加工以及mRNA的代谢和转运[4]。该家族的典型成员hnRNPA1广泛参与转录调控和mRNA的加工[5],并跟神经退行性疾病相关[6]。hnRNPA1通过以下方式发挥功能:(1)转录调节:在转录过程中,hnRNPA1结合到双链DNA上的特定靶序列,形成蛋白-蛋白复合物,抑制转录[7];(2)mRNA拼接控制:真核生物的蛋白质组多样性在很大程度上取决于前体mRNA选择性拼接的程度,而hnRNPA1能影响剪接体对前体mRNA选择性剪接位点的选择;(3)应激颗粒的组装:应激颗粒是细胞压力应激时在细胞质中形成的蛋白和RNA聚集颗粒[8]。hnRNPA1因其RNA结合特性以及与蛋白质相互作用而参与应激颗粒的组装[9];(4)MicroRNA的加工;(5)端粒延长。
已有研究结果表明,hnRNPA1促进非典型肺炎冠状病毒[10]、鼠肝炎病毒[11]、猪流行性腹泻病毒[12]、肠道病毒[13],以及辛德毕斯病毒[14]的复制。然而,hnRNPA1对副粘病毒复制的影响尚未有报道。本研究发现,NDV感染可促进hnRNPA1从细胞核进入细胞质,并与NDV核衣壳蛋白NP发生共定位和相互作用。考虑到hnRNPA1和NP均有RNA结合能力,我们推测hnRNP A1通过NP蛋白结合到病毒RNA基因组,参与了病毒基因组的复制和转录过程。
1 材料与方法
1.1 主要试剂 Flag-HRP抗体及HA-HRP抗体购自MBL公司;anti-hnRNPA1抗体购自CST公司;RIPA购自碧云天生物技术有限公司;TRIzol裂解液购自Thermo Fisher公司;反转录酶MLV购自Promega公司;Anti-Flag抗体亲和凝胶购自Bimake公司。
1.2 细胞与病毒 HeLa细胞及293T细胞购自ATCC,并由本实验室保存。培养于含10% FBS(Gibco)、双抗(细胞培养用青霉素-链霉素)的DMEM,37℃、5%CO2细胞培养箱中培养。NDV标准强毒株Herts/33由中国兽药监察所提供,本实验室保存。
1.3 NDV感染 以5×105个HeLa细胞铺6孔板,待细胞长至70%~80%时用PBS洗细胞3次,无血清DMEM稀释NDV,以1 MOI(multiplicity of infection)感染细胞,置于37℃、5%CO2培养箱吸附1 h。PBS清洗细胞3次,去除未吸附的病毒后,更换为2% FBS DMEM培养基继续培养。
1.4 间接免疫荧光(indirect immunofluorescence assay,IFA) 以4%多聚甲醛室温固定细胞15 min;0.5% TritonX-100室温透化细胞15 min;以3% BSA 37℃条件下封闭1 h;37℃孵育anti-NDV NP鼠源单克隆抗体2 h,37℃孵育Alexa Fluor 488 nm goat anti-Mouse IgG荧光二抗1 h;37℃孵育anti-hnRNPA1兔源抗体2 h;37℃孵育Alexa Fluor 594 nm goat anti-Rabbit IgG荧光二抗1 h;室温孵育DAPI染色液10 min。在载玻片中央滴一滴抗荧光猝灭封片剂,取出细胞爬片倒扣于封片剂上,室温避光风干,使用蔡司激光共聚焦显微镜观察。
1.5 质粒转染 以每孔5×105个HeLa细胞铺板。待细胞长至60%~80%时,使用Fugene HD转染试剂进行质粒转染。
1.6 免疫共沉淀 以8×107个293T细胞铺100 mm培养皿。12 h后,分别转染质粒Flag-M和HA-hnRNPA1、Flag-NP和HA-hnRNPA1、Flag-P和HA-hnRNPA1、pCMV-Flag载体和HA-hnRNPA1各3 μg。转染24 h后以RIPA裂解液裂解细胞,离心取上清液,加入Anti-Flag亲和凝胶中,4℃旋转孵育4 h。以2400 ×g离心10 s,弃上清液。利用RIPA裂解液洗3~5次,彻底弃去上清液,加入50 μL 2×SDS上样缓冲液,100℃金属浴10 min。样品用于后续SDS-PAGE和Western blot分析。
1.7 siRNA设计及siRNA干扰 根据hnRNPA1(GenBank登录号:XM_005268826)基因序列,设计siRNA(序列为5'-AGCAAGAGATG GCTAGTGC-3'),由上海吉玛制药技术有限公司合成,同时合成一段无义对照siNC(序列为5'-UUCUCCGAACGUGUCACGUTT-3')。
待细胞长至40%时,用Lipofectamine 2000进行siRNA转染。36 h后,以1 MOI的NDV感染。感染后12 h收取细胞样品,Western blot检测干扰效果和病毒蛋白的表达,或荧光定量RT-PCR检测病毒的RNA水平。
1.8 SDS-PAGE及Western blot鉴定 将蛋白样品室温离心10 min后取10 μL上样,进行SDS-PAGE电泳,并转印至NC膜上。5%脱脂乳室温封闭NC膜1 h后,4℃孵育一抗过夜,PBST洗3次,再室温孵育NC膜和HRP标记的二抗1 h,PBST洗3次。然后将NC膜置于发光液中孵育2 min,在化学图像分析仪中显影并保存图像。
1.9 细胞RNA抽提、反转录及荧光定量PCR 6孔板每孔加1 mL TRIzol细胞裂解液抽提RNA,将细胞裂解液移入无RNA酶离心管中,加入200 mL氯仿,剧烈震荡15 s。静置5 min后,13 700 ×g、4℃离心15 min,小心吸取上清液至新的无RNA酶离心管。加入200 mL异丙醇,-20℃沉淀2 h。13 700 ×g、4℃离心15 min,弃上清液,加入75%乙醇,13 700 ×g、4℃离心10 min。彻底弃去上清液,室温风干至乙醇完全挥发。加入30 μL DEPC水,65℃孵育15 min溶解RNA,使用分光光度计测量RNA浓度。
取3 μg RNA进行反转录,获得cDNA。以cDNA为模板,采用SYBR Green染料法进行荧光定量RT-PCR,引物如表1所示。PCR反应程序为:94℃预变性5 min;94℃变性15 s,60℃退火15 s,72℃延伸20 s,共35个循环。采用2-ΔΔCT法计算目的基因mRNA相对含量,以β-actin做为内参基因。

表1 荧光定量PCR引物Table 1 Primers of RT-qPCR
2 结果
2.1 NDV感染导致hnRNPA1出核 以1 MOI NDV标准强毒株Herts/33感染HeLa细胞,Mock感染为对照组。利用NDV NP鼠源抗体及hnRNPA1兔源抗体进行免疫荧光实验,检测病毒蛋白NP和hnRNPA1的亚细胞定位。结果可知,在Mock感染的细胞中,hnRNPA1聚集于细胞核;NDV感染16 h,少量的hnRNPA1蛋白出核进入细胞质,并与病毒核衣壳蛋白NP共定位(图1)。以上结果表明,NDV感染促进hnRNPA1出核,迁移至病毒核衣壳蛋白NP所在位置。

图1 NDV病毒感染诱导hnRNPA1蛋白出核,与病毒蛋白NP共定位Fig.1 NDV infection induced hnRNPA1 nuclear export and co-localized with viral protein NP
2.2 NDV NP和M蛋白与hnRNPA1存在相互作用 在非典型冠状病毒、鼠肝炎病毒及猪流行性腹泻病毒感染过程中,感染引起hnRNPA1出核,并与病毒核衣壳蛋白NP相互作用,影响病毒基因组RNA的复制。通过免疫荧光实验发现,hnRNPA1出核后,与NDV核衣壳蛋白NP共定位。NP结合病毒负链基因组RNA,并与P蛋白、L蛋白一起,形成病毒复制小体[15]。因此,我们推测hnRNPA1出核后,迁移至病毒复制小体,参与病毒的复制。为了证实以上推测,我们在293T细胞中共表达Flag-NP和HA-hnRNPA1、Flag-P和HA-hnRNPA1、Flag-M蛋白和HA-hnRNPA1,或者pCMV-Flag载体和HA-hnRNPA1。24 h后裂解细胞,以Anti-Flag亲和凝胶进行免疫共沉淀,再利用HA抗体进行Western blot,检测HA-hnRNPA1是否跟Flag标签的病毒蛋白共沉淀。结果可知,在全细胞裂解液中,各个带Flag标签的病毒蛋白和带HA标签的hnRNPA1均成功表达;在免疫共沉淀的样品中,HA-hnRNPA1被Flag-NP和Flag-M共沉淀,但不能被Flag-P或者pCMV-Flag载体共沉淀,揭示hnRNPA1跟NP和M蛋白相互作用,跟P蛋白不存在相互作用(图2)。

图2 NDV NP和M蛋白与hnRNPA1相互作用Fig.2 NDV NP and M interact with hnRNPA1
2.3 干扰hnRNPA1的表达不利于NDV的复制 以上实验结果说明:NDV感染导致hnRNPA1出核,且hnRNPA1迁移至病毒复制小体,与病毒的NP、M蛋白相互作用。但hnRNPA1在病毒的感染过程中,发挥了促进病毒增殖的作用还是抗病毒作用呢?我们在HeLa细胞中,转染sihnRNPA1干扰hnRNPA1的表达,以转染non-target control siRNA(NC)作为阴性对照。转染siRNA 36 h之后,以1 MOI剂量的NDV感染细胞,12 h后收取细胞样品,以Western blot检测hnRNPA1的干扰效果和病毒蛋白的表达。结果可知,与NC对照组相比较,sihnRNPA1成功地干扰了hnRNPA1的表达,并且,病毒蛋白NP的表达略有降低(图3A)。进一步检测NDV NP mRNA发现,相较于NC组,干扰hnRNPA1的实验组NDV的mRNA水平显著降低(图3B)。以上结果揭示hnRNPA1对病毒复制起着促进作用。
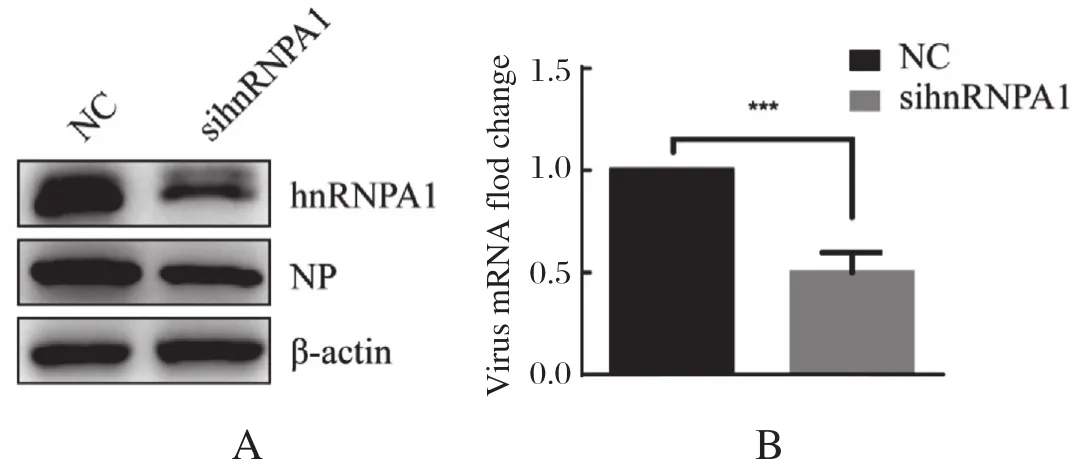
图3 siRNA干扰hnRNPA1的表达不利于NDV的复制Fig.3 siRNA knock down of hnRNPA1 does not support NDV replication
2.4 外源表达hnRNPA1有利于NDV复制 在HeLa细胞转染HA-hnRNPA1质粒时,以另一组细胞转染pCMV-HA载体作为阴性对照。转染24 h后,以1 MOI NDV感染,12 h收取细胞样品,Western blot检测HA-hnRNPA1和病毒蛋白的表达。结果可知,HA-hnRNPA1成功表达;与pCMV-HA转染组相比较,HA-hnRNPA1显著促进了病毒蛋白NP的表达。进一步检测病毒mRNA发现,相较于pCMV-HA对照组,HA-hnRNPA1促进病毒mRNA的复制水平(图4B)。本实验进一步证实了hnRNPA1对NDV复制增殖的促进作用。

图4 外源表达hnRNPA1促进NDV复制Fig.4 Overexpression of hnRNPA1 enhances NDV replication
3 讨论
在本研究中,我们发现NDV感染导致hnRNPA1出核,与病毒核衣壳蛋白NP共定位,并能结合NP,说明hnRNPA1可能迁移到病毒复制小体,参与病毒的复制。出乎意料的是,病毒M蛋白也与hnRNPA1有相互作用。有报道表明,NDV M蛋白在感染早期进入细胞核,抑制宿主细胞RNA转录,有助于病毒RNA的复制和转录[16]。我们推测M蛋白进入细胞核后,促进hnRNPA1出核进入细胞质,迁移至病毒复制小体,促进病毒基因组RNA的合成及mRNA的转录。然而,hnRNPA1的出核机制尚不清楚,还需要进一步研究。
进一步实验证实,siRNA干扰hnRNPA1的表达,病毒RNA复制和蛋白表达有所下降,外源表达hnRNPA1,病毒RNA复制和蛋白表达均有所升高,说明hnRNPA1确实有助于病毒的复制增殖。虽然干扰或过表达hnRNPA1对病毒的复制有影响,但幅度不大。造成这一结果的原因,可能是由于转染效率的缘故:不是所有的细胞都能有效地转染hnRNPA1质粒或者siRNA,这一部分未转染的细胞,干扰了实验结果;另一个可能性是hnRNPA1对病毒复制起到辅助作用,但不是必需的。
以往关于hnRNPA1参与病毒复制的研究,多集中在冠状病毒、禽流感、甲病毒及肠道病毒[13]。在肠道病毒感染过程中,hnRNPA1通过改变病毒IRES(internal ribosome entry sites,IRES)的结构以促进病毒复制;在辛德毕斯病毒感染过程中,hnRNPA1通过促进病毒正链RNA和负链RNA的合成,帮助病毒复制;在冠状病毒科的非典型肺炎冠状病毒、鼠肝炎病毒及猪流行性腹泻病毒感染过程中,hnRNPA1与核衣壳蛋白N相互作用,促进病毒基因组复制。以上研究说明,hnRNPA1对不同病毒复制的影响机制有所区别。在本研究中,我们发现hnRNPA1与NDV核衣壳蛋白NP相互作用,促进病毒复制增殖,其具体机制有待进一步研究。
综上所述,本研究首次证实了hnRNPA1参与副粘病毒的复制。鉴于hnRNPA1结合RNA的特性,推测此蛋白家族可能广泛性地参与RNA病毒的复制。
