运输应激对小鼠免疫器官结构及热休克蛋白表达的影响
2021-11-04胡威郑路程易金鑫郑文亚徐梦婷刘犇
胡威,郑路程,易金鑫,郑文亚,徐梦婷,刘犇,3*
运输应激对小鼠免疫器官结构及热休克蛋白表达的影响
胡威1,郑路程1,易金鑫2,郑文亚1,徐梦婷1,刘犇1,3*
(1.宜春学院生命科学与资源环境学院,江西 宜春 336000;2.江西农业工程职业学院动物科学学院,江西 樟树 331200;3.江西省高等学校硒农业工程技术研究中心,江西 宜春 336000)
采用苏木精–伊红(HE)染色、醋酸铀–枸橼酸铅染色和免疫组织化学染色,对模拟运输应激小鼠免疫器官(胸腺、淋巴结和脾脏)的结构和3种热休克蛋白(HSP27、HSP70和HSP90)的表达情况进行分析。结果表明:试验组小鼠的胸腺、淋巴结和脾脏结构均受到不同程度的损伤,胸腺髓质增大,皮质中血管充血,淋巴小结缩小,脾小结增大,中央动脉被破坏,细胞发生凋亡等;淋巴细胞核核膜呈锯齿状甚至碎裂,嗜酸性粒细胞胞核溶解消失,浆细胞破坏更为严重,线粒体肿胀,嵴断裂或消失等;HSP27在淋巴小结中的表达逐渐降低,在淋巴结髓质和脾脏中的表达有所增加,HSP70在淋巴结髓质中的表达逐渐降低,在淋巴小结和脾脏红髓中的表达升高,HSP90仅在淋巴结中有明显表达。综上可知,运输所引起的应激反应会对小鼠免疫器官的结构造成严重损伤,应激相关热休克蛋白HSP27、HSP70和HSP90的表达情况也会发生一定的变化,提示热休克蛋白与运输应激之间可能存在着某些调控关系。
小鼠;运输应激;胸腺;淋巴结;脾脏;热休克蛋白;病理变化
运输应激不仅会引起畜禽的死亡,而且对于存活下来的大部分动物的机体组织器官都会造成一定程度的损伤,从而对动物的肉质、副产品及繁殖机能造成严重的影响[1]。运输应激发生后,鸡和大鼠的心脏会受到不同程度的损伤[2–3],奶牛的产奶量也会受到一定的影响[4],火鸡和山羊的肝脏也会出现不同程度的损伤[5–6]。大鼠经运输应激刺激后其小肠的形态会受到严重的损伤,相关基因的表达也会发生一定的改变[1]。动物在长时间的应激条件下,其机体的免疫功能会受到严重的损伤[7],免疫器官在运输应激反应中也会遭到一定的破坏[8]。MINKA等[9]研究表明,山羊经长途运输后机体免疫器官会受到严重损伤。
热休克蛋白(HSPs)包括小热休克蛋白、HSP60、HSP70、HSP90和大热休克蛋白家族,在细胞增殖、分化及癌症发生过程中具有重要作用,其功能主要是参与蛋白质的折叠和成熟过程[10]。目前,HSPs已被证明与许多应激反应之间存在着一定的联系,且以HSP27、HSP70和HSP90家族研究较多[8]。当细胞发生应激或处于高温条件下时,HSPs会被诱导表达,以逆转或抑制蛋白质的展开或变性,从而达到保护机体的目的[10–11]。机体在应激条件下,HSP27、HSP70和HSP90的表达会发生明显变化, HSP27、HSP70和HSP90是机体应对应激调控时的主要几种热休克蛋白[12–13]。相对分子质量约为2.5×104的HSP27(Hsp25和Hsp27)能够参与诸如抵御热应激和代谢应激、调节细胞的生长和分化等机体活动,亦可作为分子伴侣参与调控[14–15]。HSP70家族是相对分子质量约7.0×104的一类蛋白,具有分子伴侣及维持细胞稳态的作用,应激条件下HSP70的表达会明显升高,以减少细胞在应激情况下的损伤[16–17]。HSP90家族成员相对分子质量约为9.0×104,其在机体应对应激的适应性反应中具有重要的作用,是维持细胞内稳态的关键调节因子[18]。
免疫系统是动物体内一个极其重要的防御系统,机体免疫反应异常会引起组织器官发生相应的病理变化。本研究中,选取小鼠的胸腺、淋巴结和脾脏作为研究对象,利用苏木精–伊红染色(HE)、醋酸铀–枸橼酸铅染色和免疫组织化学染色的方法,对模拟运输应激小鼠免疫器官的显微和超微结构的损伤及相关热休克蛋白HSP27(Hsp25和Hsp27)、HSP70(Hsp70、Hsc70和p75)和HSP90的表达情况进行研究,以期阐明运输应激对小鼠免疫器官的影响,为后续减轻运输应激对畜禽机体损伤的研究提供依据。
1 材料与方法
1.1 试验材料
苏木精和伊红染液购自北京梦怡美生物有限公司;SP免疫组织化学检测试剂盒(SP–9002)和浓缩型辣根过氧化氢酶二氨基联苯胺(DAB)显色试剂盒均购自北京中杉生物工程公司;一抗HSP27(货号ab79868)、HSP70(货号ab5439)、HSP90(货号ab13492)和二抗Goat Anti–Mouse IgG(货号ab6789)购自艾博抗上海贸易有限公司。
1.2 供试动物及处理
将24只购自湖南斯莱克景达实验动物有限公司的8~9周龄且体质量相近(30±1 g)的ICR雄性小鼠随机分成3组(每组8只),分别均置于鼠笼中进行相应处理。对照组小鼠于室温(24 ℃)条件下饲养,不作任何特殊处理;模拟运输应激试验组1(后简称试验组1)小鼠于每天09:00开始在35 ℃条件下置于水平摇床中以60 r/min的速度处理2 h,连续处理3 d;模拟运输应激试验组2(后简称试验组2)小鼠在水平摇床上以160 r/min的速度处理2 h,处理1 d,其他条件同试验组1。参照文献[1]的方法,两试验组同时模拟畜禽运输途中的噪音、振动和高温等应激因素。各组小鼠经相应处理后采用脊椎脱臼法处死,用无菌器械迅速采集小鼠的胸腺、淋巴结和脾脏,并用无菌0.9%氯化钠溶液冲洗去除污物,再对组织块进行适当的修整。将修整好的组织块分成2份:一份置于4%多聚甲醛中固定,一份置于2.5%戊二醛中固定,以用于后续试验。
1.3 病理学研究
将于4%多聚甲醛中固定48 h或以上的组织块进行脱水、透明和石蜡包埋,制备厚度为5 μm的石蜡切片,再进行常规HE染色,切片经中性树脂胶封片干燥后,于光学显微镜下观察组织的病理变化情况,并进行拍照记录;将4 ℃条件下于2.5%戊二醛中固定72 h或以上的组织块取出,放入4 ℃条件下1%锇酸中继续固定一段时间,再经常规脱水、包埋和超薄切片机切片后进行醋酸铀–枸橼酸铅染色,最后于透射电镜下观察并拍照记录。
1.4 免疫组织化学染色
将制备好的厚度为5 μm的石蜡切片置于55 ℃展片台上烘片1 h,再经二甲苯脱蜡和梯度乙醇、蒸馏水进行复水,于修复液中微波修复后,根据SP免疫组织化学检测试剂盒操作说明书进行相应操作。按照相应的稀释比例对一抗HSP27(1∶400)、HSP70(1∶800)和HSP90(1∶400)进行稀释,阴性对照组一抗用PBS代替,再按照DAB显色试剂盒操作说明书进行显色,切片经中性树脂胶封片干燥后于光学显微镜下观察并拍照,以用于后续结果分析。根据酶催化色原在抗原位置处的沉积情况不同,染色结果所呈现出的反应色(棕色)深浅不一,颜色越深,说明酶催化色原在抗原位置处的沉积越多,即靶标蛋白的表达量越高。根据棕色反应的位置和颜色深浅程度可对靶蛋白在组织中的表达位置及相对表达量进行相应的判断。
2 结果与分析
2.1 运输应激小鼠免疫器官的显微病理学观察结果
所有免疫器官的对照组组织结构正常,均未见明显的病理变化(图1)。从图1–a可知,与对照组相比,试验组1胸腺的髓质区域有显著增大,但与皮质界限保持明显,皮质毛细血管略有充血;试验组2胸腺的被膜严重脱落,髓质与皮质之间界限模糊,髓质区域有明显的坏死灶出现,胸腺小体显著增大,皮质受到严重破坏,毛细血管充血情况更加严重。从图1–b可知,与对照组相比,试验组1淋巴小结体积减小,生发中心缩小,髓质区域细胞略显稀疏,髓索减少,髓窦中有少量红细胞浸润;试验组2被膜受损,部分淋巴小结相互融合,生发中心进一步缩小,甚至消失,副皮质区细胞大量坏死,有较多的淋巴小结呈“孤岛”样存在,髓质区域的细胞稀疏程度更加严重,髓索进一步减少,髓窦明显增大,并有大量的红细胞浸润。从图1–c可知,与对照组相比,试验组1脾小结相互融合,白髓区域显著增大且有少量的红细胞浸润,红髓区域相对缩小且红细胞密度降低,出现较多的坏死灶;试验组2被膜下细胞发生坏死,组织结构变得松散,白髓及边缘区也有大量的细胞发生坏死,且有大量的红细胞浸润,中央动脉闭锁消失,小梁周围可见有大量的炎性细胞和红细胞聚集,红髓区域同样有大量细胞发生坏死,整个脾脏组织染色较淡。
2.2运输应激小鼠免疫器官的超微病理学观察结果
从图2–a可知,运输应激对胸腺内各种细胞造成严重损伤,部分浆细胞胞核核膜破裂,染色质聚集于细胞核边缘,核中央出现空洞,胞质中出现空泡,空泡内含有多种细胞碎片,粗面内质网排列散乱,线粒体肿胀,嵴断裂或消失;部分淋巴细胞胞核呈锯齿状,一些胞核中染色质聚集于核边缘,中间出现空洞;嗜酸性粒细胞的胞核浓缩,单核细胞线粒体肿胀。从图2–b可知,单核细胞中出现较多的嗜天青颗粒,淋巴细胞核碎裂,部分胞核中核质溶解殆尽,残留物呈絮状残存于残留的空泡中,同时有较多的包涵体也存在于空泡中,线粒体肿胀,嵴断裂或消失,部分细胞中出现较多高电子密度的不明颗粒物。从图2–c可知,部分淋巴细胞核周间隙变宽,有的细胞核呈长条状,有的核染色质严重固缩;有大量的嗜酸性粒细胞出现,部分嗜酸性粒细胞的胞核溶解或消失;淋巴细胞间可见凋亡细胞的残体,细胞固缩,电子密度升高,部分细胞的核膜完全消失,核染色质呈碎片状分布在整个细胞中。
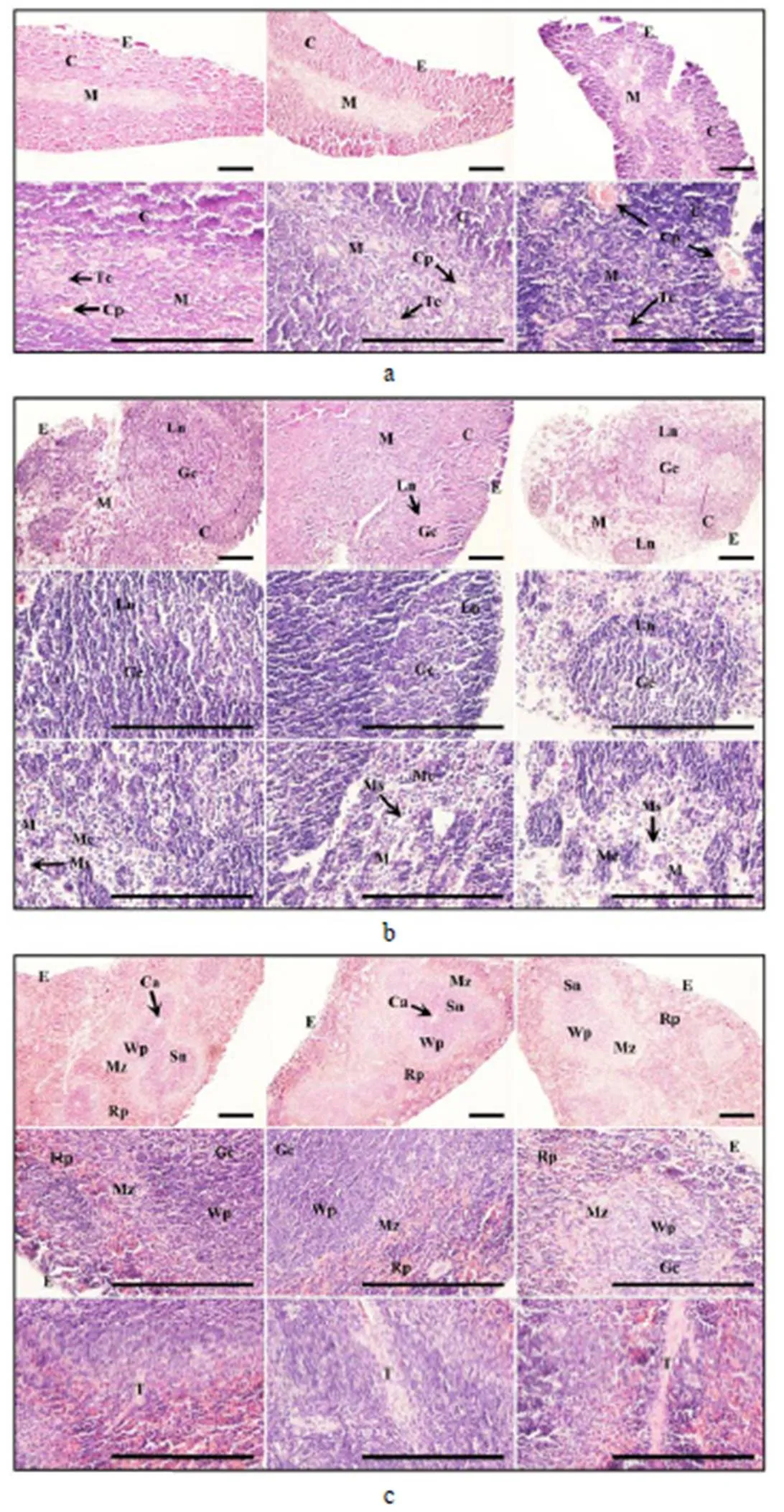
a、b、c分别示小鼠胸腺、淋巴结、脾脏的显微病理变化,其中左、中、右图依次示对照组、试验组1、试验组2的病理变化。E 被膜;C 皮质;M 髓质;Cp 毛细血管;Tc 胸腺小体;Ln 淋巴小结;Gc 生发中心;Mc 髓索;Ms 髓窦;Sn 脾小结;Ca 中央动脉;Wp 白髓;Mz 边缘区;Rp 红髓;T 小梁。比例尺为100 μm。

a、b、c分别示小鼠胸腺、淋巴结、脾脏的超微病理变化。P 浆细胞;L 淋巴细胞;EG 嗜酸性粒细胞;Mo 单核细胞;RBC 红细胞;N 细胞核;M 线粒体;RER 粗面内质网;Ly 溶酶体;V 空泡;Eg 嗜酸性颗粒;Ag 嗜天青颗粒。红色箭头示核膜凹陷呈锯齿状;蓝色箭头示核周间隙增宽;绿色箭头示核膜完全破裂,染色质呈碎片状分布。比例尺为5 μm。
2.3 运输应激对热休克蛋白在小鼠免疫器官中表达的影响
从图3–a可知,HSP27在皮质和髓质中均有表达,其主要定位于细胞质中,在胸腺小体上皮细胞中的表达较为显著,运输应激后,在皮质中的表达量略有下调,但不显著,其总体表达量在运输应激前后无显著变化;HSP70在皮质和髓质中均有表达,在细胞核和细胞质中均有定位,皮质中的表达量略高于髓质,运输应激后,其总体表达量略有下调;HSP90的表达不明显或没有表达,运输应激后,在皮质中的细胞胞质中略有表达,但表达量较低。

a、b、c分别示热休克蛋白在运输应激前后小鼠胸腺、淋巴结、脾脏中的表达情况,其中左、中、右图依次为对照组、试验组1、试验组2的图。NC为阴性对照;C 皮质;M 髓质;Ln 淋巴小结;Gc 生发中心;Sn 脾小结;Ca 中央动脉;Mz 边缘区;Rp 红髓。比例尺为50 μm。
从图3–b可知,HSP27在对照组皮质和髓质中均有表达,主要定位于胞质中,与对照组相比,HSP27在试验组1淋巴小结中的表达明显升高,在髓质中的表达无显著变化,在试验组2淋巴小结中的表达较对照组和试验组1均显著降低,并且在髓质中的表达均显著升高,除了在细胞质中有定位外,在细胞核中也有定位;在对照组中,HSP70在髓质中有强烈表达,主要定位于细胞质中,在淋巴小结中无表达,运输应激后,HSP70在试验组1髓质中的表达显著降低,此外在皮质中也有表达,信号在细胞核和细胞质中均有定位,在试验组2的髓质中也有表达,在淋巴小结中的表达较试验组1略有下调,信号主要在细胞质中定位;HSP90在对照组中的表达情况同HSP70,运输应激后,HSP90在试验组1中的表达主要集中于生发中心,在髓质中的表达明显下调,在试验组2中,HSP90在髓质中的表达继续下调。
从图3–c可知,HSP27在对照组中无表达,在两试验组中的总体表达量均显著上调,主要定位于细胞质中,有部分细胞在胞核中也有表达;对照组中HSP70主要表达于边缘区和红髓中,信号主要定位于细胞质中,在白髓中几乎无表达;运输应激后,HSP70在试验组1红髓中的表达显著高于对照组,在白髓中也有明显的表达,信号主要定位于细胞核中,细胞质中也有少许信号存在,但在边缘区的表达较对照组显著降低;随着应激强度的增加,HSP70在试验组2红髓中的表达明显减弱,信号主要定位于细胞质中,在白髓和边缘区几乎无表达;HSP90在对照组的红髓中有较微弱的表达,其他区域均无信号出现,运输应激后,其在试验组1红髓中的表达明显上调,但在其他区域同样无信号出现,随着应激强度的增加,其在试验组2红髓中的表达明显低于对照组和试验组1,此外,HSP90在以上各组中均定位于细胞质中表达。
3 结论与讨论
大鼠在经历过剧烈的偏心运动后,其某些免疫应答反应会受到一定的影响[19]。拥挤也能够引起动物的免疫应答反应减弱[20]。应激不仅会对动物机体的免疫应答反应造成一定的影响,同时也会对动物的免疫器官造成一定的影响,蛋鸡经运输应激刺激后,其脾脏和法氏囊的质量会明显增加[21];应激会对大鼠脾脏的免疫耐受能力产生一定的影响[22]。本研究中,小鼠经模拟运输应激处理后,其胸腺、淋巴结和脾脏的组织结构均受到不同程度的破坏,免疫细胞的形态结构发生了破坏性的改变。由此可见,运输应激不但会对动物免疫器官的组织结构造成破坏,同时还能够对各种免疫细胞的结构功能产生损伤。
热休克蛋白是参与应激反应的主要蛋白家族,在应激条件下,大部分热休克蛋白在动物机体不同组织器官的定位和表达情况均会发生明显的变化,以此提高机体应对应激损伤的能力[23–24]。本研究中,小鼠经模拟运输应激作用后,HSP27在淋巴结和脾脏中的定位和表达情况均发生了变化,尤其在脾脏中的变化更为明显;运输应激前后,其在胸腺中均有较高的表达量,但表达情况基本维持不变。ZHENG等[25]研究表明,当机体或细胞受到外界的损伤性刺激时,HSP27表达升高,通过激活细胞外核因子κB(NF–κB)信号通路维持细胞的生存;此外,细胞内HSP27能够与凋亡因子BAX和BIM结合,从而有效阻断线粒体的凋亡通路,以抑制细胞的凋亡。由此可见,HSP27在小鼠淋巴结和脾脏应对运输应激损伤的过程中发挥着重要的保护作用,对胸腺具有持续性的保护作用。
本研究中,HSP70在脾脏红髓中的表达量显著上调主要发生在运输应激早期,且大部分HSP70的定位由细胞质转移到了细胞核中,但随着应激时间的延长,其表达量逐渐减弱,细胞核中的表达量也显著降低。这可能是由于应激强度超出了脾脏的调控能力所引起的。由此可见,当运输应激强度超出一定范围时,可能会对机体的组织器官造成无可挽救的损伤;运输应激后,HSP70在淋巴结细胞中的定位也明显的由细胞质转移到了细胞核中。当机体受到应激刺激时,HSP70会由细胞质转移到细胞核中。GAO等[26]研究发现,在凋亡细胞中FAS和FAS相关因子1(FAF1)的下游分子Caspase–8具有很高的活性,而当细胞内过表达HSP70时能够有效抑制FAF1与FAS的结合,从而抑制Caspase–8的活性,进而抑制细胞凋亡的发生。由此可见,HSP70在运输应激早期可能通过抑制细胞凋亡的途径来保护小鼠的脾脏免受损伤,在淋巴结中也可能存在HSP70调控的抗细胞凋亡的发生。HSP70在胸腺中的表达情况在运输应激前后也没有明显的变化,说明其对胸腺的保护作用也可能是持续性的。
本研究中,HSP90在胸腺和脾脏中的表达较弱或无表达,仅在淋巴结中有显著的表达,但运输应激引起其表达量逐渐下调,HSP70的表达量也同时下调。XU等[27]研究表明,在肝癌细胞中,高表达的HSP90通过与丙酮酸激酶M2(PKM2)结合,可增强细胞的糖酵解和增殖能力,同时减少细胞凋亡的发生,进而提高细胞的存活能力,当HSP90的表达量被敲低时,细胞的凋亡率会显著升高。由此说明淋巴结应对运输应激损伤的能力较弱,提示在运输应激过程中淋巴结可能是最易被攻击的免疫器官。
综上可知,小鼠在模拟运输应激过程中其主要的免疫器官均会受到较大的损伤,淋巴结可能是最易被攻击的免疫器官,但还有待于进一步的研究证明。运输应激前后,HSP27(Hsp25和Hsp27)、HSP70 (Hsp70、Hsc70和p75)和HSP90在小鼠免疫器官中的表达变化趋势表明,它们可能是通过抑制细胞凋亡来保护组织器官免受损伤的,但仍需要进一步的证实,同时3种热休克蛋白在该过程中的具体分子调控机制还有待于进一步的研究。
[1] WAN C R,YIN P,XU X L,et al.Effect of simulated transport stress on the rat small intestine:a morphological and gene expression study[J].Research in Veterinary Science,2014,96(2):355–364.
[2] SUN F,ZUO Y Z,GE J,et al.Transport stress induces heart damage in newly hatched chicks via blocking the cytoprotective heat shock response and augmenting nitric oxide production[J].Poultry Science,2018,97(8):2638–2646.
[3] WAN C R,CHEN Y P,YIN P,et al.Transport stress induces apoptosis in rat myocardial tissue via activation of the mitogen-activated protein kinase signaling pathways[J]. Heart and Vessels,2016,31(2):212–221.
[4] HONG H,LEE E,LEE I H,et al.Effects of transport stress on physiological responses and milk production in lactating dairy cows[J].Asian-Australasian Journal of Animal Sciences,2019,32(3):442–451.
[5] MARQUES A T,LECCHI C,GRILLI G,et al.The effect of transport stress on turkey() liver acute phase proteins gene expression[J].Research in Veterinary Science,2016,104:92–95.
[6] 郑文亚,章志涛,梅婷,等.运输应激对山羊肝脏和肾脏病理损伤及热休克蛋白表达的影响[J].农业生物技术学报,2019,27(10):1769–1781.
ZHENG W Y,ZHANG Z T,MEI T,et al.Effect of transport stress on pathological injury and heat shock protein expression of liver and kidney in goats()[J].Journal of Agricultural Biotechnology,2019,27(10):1769–1781.
[7] DHABHAR F S.Effects of stress on immune function:the good,the bad,and the beautiful[J].Immunologic Research,2014,58(2/3):193–210.
[8] 郑文亚.运输应激对山羊主要器官的应激损伤及热休克蛋白表达的影响[D].兰州:甘肃农业大学,2019.
ZHENG W Y.Effects of transport stress on stress injury and expression of heat shock protein in main organs of goats[D].Lanzhou:Gansu Agricultural University,2019.
[9] MINKA N S,AYO J O.Modulating effect of ascorbic acid on transport-induced immunosuppression in goats[J]. ISRN Veterinary Science,2011,2011:749753.
[10] WU J M,LIU T E,RIOS Z,et al.Heat shock proteins and cancer[J].Trends in Pharmacological Science,2017,38(3):226–256.
[11] ARRIGO A P,SUHAN J P,WELCH W J.Dynamic changes in the structure and intracellular locale of the mammalian low-molecular-weight heat shock protein[J]. Molecular and Cellular Biology,1988,8(12):5059– 5071.
[12] BAO E D,SULTAN K R,BERNHARD N,et al. Expression of heat shock proteins in tissues from young pigs exposed to transport stress[J].DTW. Deutsche Tierarztliche Wochenschrift,2009,116(9):321–325.
[13] ZHANG M,LV Y,YUE Z,et al.Effects of transportation on expression of Hsp90,Hsp70,Hsp27 and αB-crystallin in the pig stomach[J].The Veterinary Record,2011,169(12):312.
[14] YANG X,CUI Y,YUE J,et al.The histological characteristics,age-related thickness change of skin,and expression of the HSPs in the skin during hair cycle in yak ()[J].PLoS One,2017,12(5):e0176451.
[15] JIA Y,RANSOM R F,SHIBANUMA M,et al. Identification and characterization of hic-5/ARA55 as an hsp27 binding protein[J].The Journal of Biological Chemistry,2001,276(43):39911–39918.
[16] POWERS E T,BALCH W E.Diversity in the origins of proteostasis networks:a driver for protein function in evolution[J].Nature Reviews Molecular Cell Biology,2013,14(4):237–248.
[17] YENARI M A,LIU J L,ZHENG Z,et al.Antiapoptotic and anti-inflammatory mechanisms of heat-shock protein protection[J].Annals of New York Academy of Sciences,2005,1053:74–83.
[18] TREPEL J,MOLLAPOUR M,GIACCONE G,et al. Targeting the dynamic HSP90 complex in cancer[J]. Nature Reviews Cancer,2010,10(8):537–549.
[19] SUN Y I,PENCE B D,WANG S S,et al.Effects of exercise on stress-induced attenuation of vaccination responses in mice[J].Medicine & Science in Sports & Exercise,2019,51(8):1635–1641.
[20] HUO H,YIN S,JIA R,et al.Effect of crowding stress on the immune response in turbot() vaccinated with attenuated[J].Fish & Shellfish Immunology,2017,67:353–358.
[21] MATUR E,AKYAZI İ,ERASLAN E,et al.The effects of environmental enrichment and transport stress on the weights of lymphoid organs,cell-mediated immune response,heterophil functions and antibody production in laying hens[J].Animal Science Journal,2016,87(2):284–292.
[22] SASAGURI K,YAMADA K,NARIMATSU Y,et al. Stress-induced galectin-1 influences immune tolerance in the spleen and thymus by modulating CD45 immunoreactive lymphocytes[J].The Journal of Physiological Sciences,2017,67(4):489–496.
[23] BAO E D,SULTAN K R,NOWAK B,et al.Expression and distribution of heat shock proteins in the heart of transported pigs[J].Cell Stress and Chaperones,2008,13(4):459–466.
[24] ZHU L,BAO E D,ZHAO R Q,et al.Expression of heat shock protein 60 in the tissues of transported piglets[J]. Cell Stress and Chaperones,2009,14(1):61–69.
[25] ZHENG G P,ZHANG Z J,LIU H,et al. HSP27- mediated extracellular and intracellular signaling pathways synergistically confer chemoresistance in squamous cell carcinoma of tongue[J].Clinical Cancer Research,2018,24(5):1163–1175.
[26] GAO X J,LIU W L,HUANG L S,et al.HSP70 inhibits stress-induced cardiomyocyte apoptosis by competitively binding to FAF1[J].Cell Stress and Chaperones,2015,20(4):653–661.
[27] XU Q R,TU J F,DOU C W,et al.HSP90 promotes cell glycolysis,proliferation and inhibits apoptosis by regulating PKM2 abundance via Thr-328 phosphorylation in hepatocellular carcinoma[J].Molecular Cancer,2017,16(1):178.
Effects of transport stress on morphology and heat shock protein expression in the immune organs of mice
HU Wei1,ZHENG Lucheng1,YI Jinxin2,ZHENG Wenya1,XU Mengting1,LIU Ben1,3*
(1.College of Life Science and Resources and Environment, Yichun University, Yichun, Jiangxi 336000, China; 2.Faculty of Animal Science, Jiangxi Agricultural Engineering College, Zhangshu, Jiangxi 331200, China; 3.Engineering Technology Research Center of Jiangxi Universities and Colleges for Selenium Agriculture, Yichun, Jiangxi 336000, China)
In this study, hematoxylin-eosin(HE) staining, uranium acetate-lead citrate staining and immunohistochemical staining were used to analyses the effects of transport stress on morphology and three heat shock proteins expression(HSP27, HSP70 and HSP90) in mice immune organs(thymus, lymph nodes and spleen). The results showed that the thymus, lymph nodes and spleen of mice were all damaged by transport stress. The thymus medulla was enlarged and the blood vessels in the cortex were congested. The lymphatic nodules were shrinked and the splenic nodules were enlarged. The central artery was destroyed and cell apoptosis was showed up. The shape of lymphocyte nuclear membranes were performed as serration or even destroyed. A part of the nucleus of the eosinophilic granulocyte was disappeared. The destructive condition of the plasmocyte was even worse. The mitochondrial was swelled and cristae was damaged or disappeared. The expression of HSP27 in lymphoid nodule was gradually reduced, but that in medulla of lymph nodes and spleen were increased. In the medulla of lymph nodes, the expression of HSP70 was gradually reduced, but in lymphoid nodule and spleen red pulp were both increased. HSP90 was only obviously expressed in the lymph nodes. In summary, the transport induced stress would cause serious damages to the morphology of immune organs in mice, and the expression patterns of three stress related HSPs(HSP27, HSP70 and HSP90) were also changed. These results indicated that several certain regulatory relationships ware might exist between the HSPs and transport stress.
mice; transport stress; thymus; lymph node; spleen; heat shock protein; pathological change
S852.3
A
1007–1032(2021)05–0571–09
胡威,郑路程,易金鑫,郑文亚,徐梦婷,刘犇.运输应激对小鼠免疫器官结构及热休克蛋白表达的影响[J].湖南农业大学学报(自然科学版),2021,47(5):571–579.
HU W,ZHENG L C,YI J X,ZHENG W Y,XU M T,LIU B.Effects of transport stress on morphology and heat shock protein expression in the immune organs of mice[J].Journal of Hunan Agricultural University(Natural Sciences),2021,47(5):571–579.
http://xb.hunau.edu.cn

2020–04–13
2020–05–25
江西省现代农业科研协同创新项目(JXXTCX201702)
胡威(1988—),男,安徽阜阳人,博士研究生,讲师,主要从事临床兽医学研究,huweigsau@126.com;*通信作者,刘犇,博士,副教授,主要从事临床兽医学研究,liubenres@163.com
责任编辑:邹慧玲
英文编辑:柳正
