IBDU诊治1例并文献回顾*
2021-11-04何泽慧温红珠
何泽慧,温红珠,林 江
(上海中医药大学附属龙华医院脾胃病科,上海 200032)
炎症性肠病(IBD)是一种特发性肠道炎症性疾病,根据患者症状、结肠镜病变特征及病理表现不同主要分溃疡性结肠炎(UC)和克罗恩病(CD)2型,对结肠IBD一时难以区分UC和CD的患者,即仅有结肠病变,但内镜及活检缺乏UC或CD的特征者临床可诊断为结肠 IBD 类型待定(IBDU)[1]。现将本院收治的1例IBDU的诊治经过报道如下。
1 临床资料
患者,女,27岁。因反复腹泻1年余,加重1个月于2019年11月6日收入本院脾胃病科。患者于2018年8月开始出现稀便,每天1~2次,便中夹有少量鲜血,无黏液脓便,无肛旁结块、流脓,以及腹痛、发热等,至外院就诊,诊断为肛周脓肿,予痔疮栓治疗后症状未见好转。患者于2018年10月至本院肛肠科就诊,诊断为肛裂,予消痔膏、清肠栓治疗后便血消失,每天1~2次稀便。2019年10月患者因排便次数增至每天5~6次,稀便,便前脐周刺痛,便后痛减,排便急迫感,于2019年10月31日至本院脾胃病科门诊查肠镜显示结肠炎伴溃疡形成,IBD及其他感染性肠炎待排。见图1。病理检查:多部位结肠黏膜活动性慢性炎症,见多个肉芽肿,无坏死,IBD不能除外,CD或结核可能性较大。入院时查体:神清,精神可,未触及浅表肿大淋巴结,眼睑结膜无苍白,心率88次/分,律齐,各瓣膜区未闻及病理性杂音,两肺呼吸音清,未闻及干湿啰音,腹软平坦,无压痛、反跳痛,无肌卫,肝脾肋下未及,墨菲氏(-),麦氏征(-),肠鸣音7次/分,双下肢压迹(-)。入院后查血常规、甲状腺功能、风湿免疫指标、肿瘤指标均未见异常,粪培养、EB病毒、巨细胞病毒、胸部CT、T-spot检查均阴性,肛周磁共振成像增强检查见肛周欠规整,未见瘘道。于2019年11月13日完善胶囊内镜检查显示回盲部溃疡、糜烂。根据我国IBD共识意见的CD与UC的鉴别诊断要点[1],本例患者症状、结肠镜表现及活检结果既有UC的表现(病变连续,直肠受累,无肠腔狭窄,溃疡浅,见黏膜弥漫性充血、水肿),也有CD的表现(有腹泻但无脓血,见纵行溃疡,病理检查见非干酪样肉芽肿);且根据WHO推荐的CD诊断标准,无法确诊CD,故诊断为IBDU。给予口服美沙拉嗪每天4 g,联合清肠栓每天1粒纳肛治疗。服药期间患者稀便每天1次,无黏液脓血,时有左下腹隐痛。2020年4月30日复查肠镜:回肠末端糜烂灶,降结肠黏膜水肿和白色瘢痕,乙状结肠散在斑点状浅溃疡和白色瘢痕。见图2。确诊为UC。
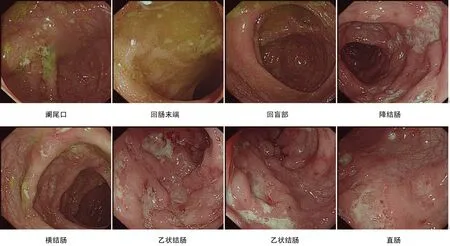
回盲部、升结肠、横结肠、直肠黏膜均充血、水肿,伴散在片状浅表溃疡及充血糜烂灶;降结肠黏膜充血、水肿明显,散在片状溃疡,局部似纵行排列,表面黏液覆着;乙状结肠黏膜充血、水肿,伴散在溃疡及充血糜烂灶,相互之间有融合,表面粘液覆着。
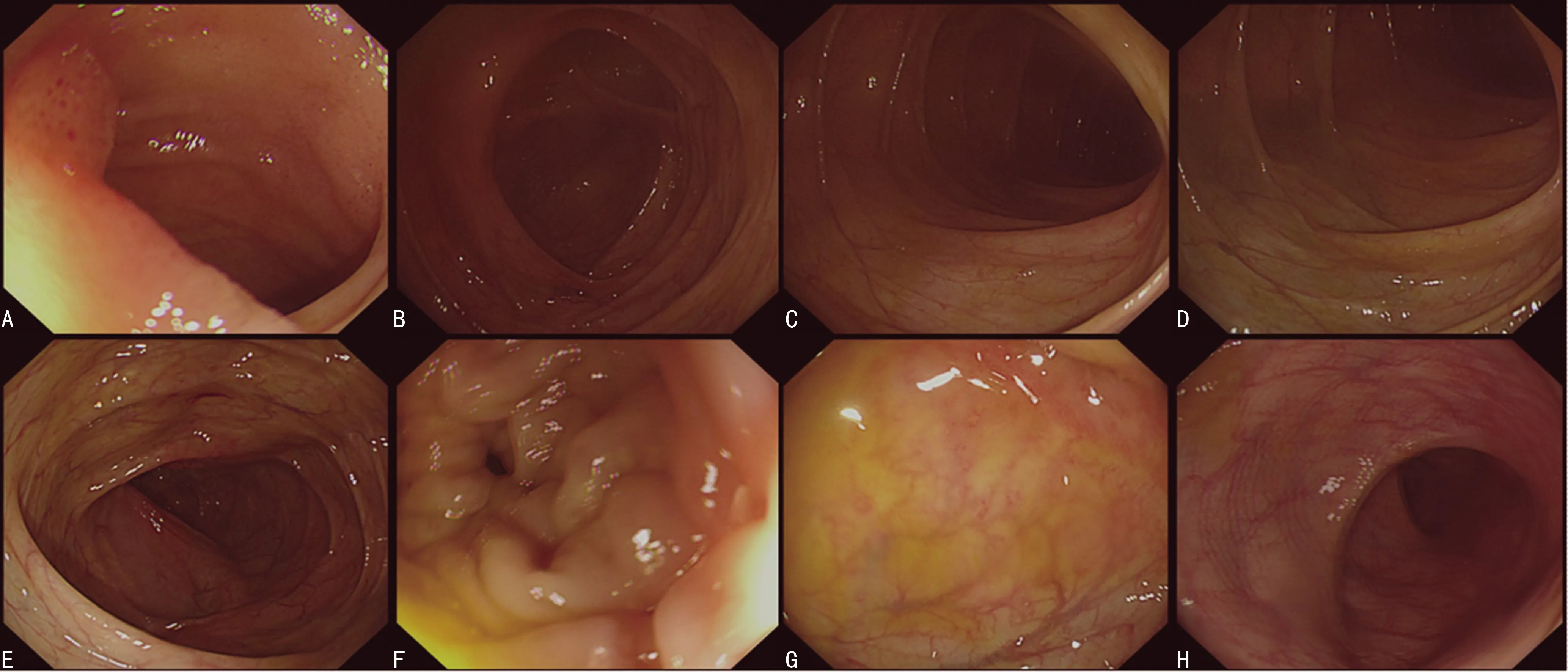
A:回肠末端糜烂灶,回盲瓣形态基本正常;B:阑尾开口存在;C~E:升结肠、横结肠未见异常改变;F:降结肠黏膜水肿和白色瘢痕;G:乙状结肠散在斑点状浅溃疡和白色瘢痕;H:直肠未见异常改变。
2 讨 论
本例患者初起症状为便中带血,先后诊断为肛周脓肿和肛裂,给予外用药物治疗后便血症情改善,后未复发,且入本院后肛周磁共振成像检查未见CD典型的肛周表现,故考虑血便为肛裂所致,而非IBD引起。患者入院时主要症状为大便频次增加、便不成形,伴便前脐周刺痛,排便急迫感,结肠镜检查提示结肠炎伴溃疡形成,病理检查见黏膜活动性慢性炎症,见多个肉芽肿,应考虑可能为IBD、肠结核、感染性腹泻等。入院后完善相关检查,排除甲状腺功能亢进症、消化道肿瘤、阑尾炎、胰腺炎等炎症引起的腹痛、腹泻,除外风湿免疫疾病引起的溃疡,排除细菌(艰难梭菌、结核分枝杆菌、沙门氏菌、大肠杆菌等)、病毒(巨细胞病毒、EB病毒)等引起的感染性腹泻。因此,考虑本例患者为IBD,此时应在UC和CD中谨慎鉴别。
UC和CD的临床表现、内镜和组织学特征各有特征。在临床表现上,UC患者以黏液血便、腹泻、里急后重、排便紧迫感、腹痛等为主症;CD患者主要症状为腹泻、腹痛,部分患者可见肠梗阻、肠穿孔等,累及肛周者可伴肛周脓肿、肛瘘等。在内镜表现上,UC患者通常自直肠起病,见弥漫性黏膜充血、水肿,质脆、自发或接触出血和脓性分泌物附着,黏膜血管纹理模糊、紊乱,多发性糜烂或浅溃疡;CD患者分布特点则为节段性,早期表现为阿弗他溃疡,随疾病进展为纵行和匍匐形溃疡,周围铺路石样增生,肠腔狭窄,可累及至上消化道。在病理学特点上,UC患者主要表现为固有层炎症细胞浸润,隐窝炎、隐窝脓肿等;CD患者主要病理改变为裂隙状溃疡、固有膜炎性细胞浸润、淋巴细胞聚集、非干酪性肉芽肿形成等。在影像学方面,肠道影像学检查——CT小肠造影(CTE)可观察到UC病变累及的范围、肠壁增厚程度、淋巴结增大等征象[2];CD急性期CTE以肠管水肿为主要表现,慢性期则表现为纤维增生,增强后肠周可见“梳状征”[3]。因此,CTE可作为评估UC病情严重程度的工具,而对CD则具有定性作用[4]。
本例患者肠镜检查提示病变范围为回盲部之全结肠的连续性、弥漫性病变,可见片状糜烂、溃疡,符合UC连续性病变的特点;然而,患者降结肠部位溃疡局部似纵行分布,病理提示多个肉芽肿,不能排除CD的可能;小肠胶囊内镜检查仅见回盲部病变,无法明确是否为UC累及或结肠型CD。因此,根据相关检查的结果仍无法明确UC或CD,故暂诊断为IBDU。给予美沙拉嗪每天4 g治疗,同时密切随访。治疗6个月后复查结肠镜见散在浅溃疡及白色瘢痕,故确诊为UC。
2005年加拿大蒙特利尔召开的世界胃肠病学大会首次提出IBDU的诊断标准[5],指的是根据临床表现、内镜表现、内镜活检及影像学检查不能区别UC和CD的情况;而未定型结肠炎(IC)指结肠切除术后病理检查仍无法区分UC和CD者。根据现有资料,儿童IBDU发病率约为13%,几乎是成人IBDU发病率(6%)的2倍[6-8]。一项纳入1 370例儿童IBD(PIBD)的大型研究结果显示,<2岁患儿占33%,而13岁以上患儿仅占9%,提示发病率随儿童年龄增长而下降[9]。诊断延迟可能是因21%的PIBD患者出现的非经典表现所致[10],如约5%的患儿仅出现生长障碍,而6%~35%的患儿仅有结节性红斑、关节炎等肠外表现,仅4%的患儿出现肛周疾病[11]。ZHOU等[12]对2002—2009年477例成人IBD患者的临床资料进行了回顾性分析,结果显示,27例(5.7%)患者初步诊断为IBDU/IC,与文献报道的发生率较为接近。统计显示,未治疗的早期UC和儿童UC或合并暴发性结肠炎、中毒性巨结肠、左半结肠炎合并阑尾炎,以及使用促进组织愈合作用的药物等情况时IBD易被诊断为IBDU/IC[13]。
目前,对IBDU/IC的诊断尚无“金标准”,应建立在排除诊断的基础上,如本例患者,在排除了其他原因所致结肠炎后,结合病理、影像和血清学检查等无法区别UC和CD才诊断为IBDU。胡惠静等[14]研究了IBD相关抗体的临床价值,结果显示,免疫球蛋白A(IgA)型抗小肠杯状细胞抗体、IgA/IgG型抗中性粒细胞胞浆抗体(pANCA)诊断UC的特异性较高;抗胰腺腺泡抗体、抗酿酒酵母抗体(ASCA)诊断CD的特异性较高,提示了较高特异性的血清学标志物在IBD鉴别诊断中的潜在价值。OKUNO等[15]发现,肠道黏膜表达的白细胞介素-3、白细胞介素-2、T盒子转录因子具有一定特异性,可作为鉴别IBDU的辅助工具。
IBDU在治疗上与IBD无明显差异,以非特异性抗炎、止痛止泻等对症治疗和手术治疗为主[16]。在药物治疗方面,刘明军等[17]使用5-氨基水杨酸前体药物——巴柳氮治疗IBDU/IC患者有效率可达88.1%。PRENZEL等[18]建议5-氨基水杨酸盐可作为活动性IBDU的一线治疗药物。关于生物制剂的疗效,目前尚缺乏大样本随机对照临床试验予以证明。在中医治疗方面,杜锐等[19]将100例IBDU患者随机分为治疗组和对照组,每组50例,治疗组给予白头翁汤药液保留灌肠,对照组则用柳氮磺吡啶栓纳肛,2周后观察疗效,结果提示,白头翁汤灌肠在缓解临床症状、提高患者生活质量方面效果均明显优于柳氮磺吡啶,但肠镜下表现无明显差别。在手术治疗方面,目前多推荐回肠贮袋肛管吻合术。一项对28例IC/IBDU患者采用回肠贮袋肛管吻合术后的回顾性研究发现,术后回肠贮袋炎发生率与血清学指标阳性率有一定相关性,如ASCA、pANCA阳性率可达63%,阴性率则为17%,提示血清学可作为手术的参考标准之一[20]。
IBDU究竟是作为UC或CD的临时性诊断,还是IBD亚型尚有待于更多的研究进一步明确[21]。一项基于欧洲人口的队列研究发现,初诊为CD者476例(37%),UC者701例(54%),IBDU者112例(9%),随访5年后28例(25%)IBDU患者被再诊断为UC 10例(71%)或CD 8例(29%)[22]。美国一项纳入2002—2014年44 302例IBD患者的统计结果显示,长期随访后18%的患者改变了诊断,包括UC、CD、IBDU的互相转换,甚至存在改变2次者[23]。HERMAND等[24]回顾性分析了110例行结肠次全切除术后IBD患者的临床资料,结果显示,6例原诊为UC或IBDU患者最终诊断为CD。可能表示IBD并不是一个独立病变,而是一个连续的疾病谱,目前已有明确定义和特性UC和CD代表的只是该疾病谱中最典型的2种形式,那么IBDU也许也是其中一种。因此,不少学者认为,IBDU为IBD的其中一种临床亚型并具有特定的临床表现、内镜和病理检查特点,尤其是在PIBD中[25]。CARVALHO等[26]研究表明,诊断为IBDU的儿童患者具有独特、持久的亚群表现,即发病年龄较早和进展迅速。一项纳入406例PIBD患儿的研究表明,IBDU最普遍的血清学特征是pANCA阴性/ASCA阴性,而CD患儿多为pANCA阴性/ASCA阳性(特异性为83%),UC患儿则多呈pANCA阳性/ASCA阴性(特异性为66%),提示IBDU是介于UC和CD之间的中间表型[27]。CHANDRADEVAN等[28]研究表明,在遗传图谱方面,IBDU也有区别于CD和UC。而对成人IBD,王钢等[29]对258例IBD患者进行了回顾性分析,对比总结出IBDU/IC具有一定的特性,推断其可作为一个独立的病变。在首发症状方面,IC与UC比较,发热、腹痛发生率较低,而腹泻、黏液血便发生率较高;在内镜表现和治疗方面,IC与CD比较,病变累及范围较广,而节段型病变、累及直肠较少;而与UC比较,IC的节段型病变、回肠、直肠受累及手术次数较多。在转归方面,杨善兵等[30]对118例发生消化道狭窄的IBD患者的临床资料进行了回顾性分析,结果显示,CD、UC、IBDU患者消化道狭窄发生率分别为59.02%、6.67%、34.25%,差异有统计学意义(P<0.05),提示消化道狭窄发生率有高至低依次为CD、IBDU、UC。
本例患者初诊时以腹痛、腹泻为主,内镜检查的溃疡表现与UC相似,但在结肠病理检查中见到了非干酪样性肉芽肿;因无法明确UC或CD,暂时诊断为IBDU;后密切随访患者并定期复查,根据复查结果及美沙拉嗪治疗的效果,确诊为UC。因此,作者认为,IBD是一个动态变化的疾病过程,IBDU这一诊断是暂时性的诊断,随着疾病的发展,最终将明确为UC或CD。因此,长期随访为疾病诊治的关键,而不能仅根据某一时刻的组织学表现武断地进行诊断。对IBDU患者的临床表现、内镜表现和病理变化尚有待于更多的研究和临床观察。
