微小RNA-381在卵巢癌细胞中的表达及对卵巢癌细胞增殖、迁移和侵袭的影响*
2021-11-04徐洁欢邓玉屏李耀军
徐洁欢,邓玉屏,李耀军
(1.长沙卫生职业学院护理学院,湖南 长沙 410600;2.中南大学湘雅医学院附属肿瘤医院,湖南 长沙 410013)
卵巢恶性肿瘤致死性很高[1]。卵巢癌患者发病隐匿,早期临床症状不明显,并且尚无可靠的早期检测方法,多数卵巢癌患者初诊时已经为肿瘤晚期。据统计其5年生存率仅为30%~45%[2]。微小RNA(miRNA)作为癌基因或抑癌基因调控着肿瘤的发生和发展[3],其属于内源性非编码小分子RNA。其中微小RNA-381(miR-381)属于肿瘤抑制miRNA[4-5]。目前,关于miR-381在卵巢癌中表达的研究很少见[6]。本研究探讨了miR-381在卵巢癌细胞中的表达,以及对卵巢癌细胞增殖、迁移和侵袭的影响,对找寻新的卵巢癌肿瘤特异性诊断标记物和基因治疗新靶点具有一定指导意义。
1 材料与方法
1.1材料 卵巢癌细胞A2780、SKOV3购自普拉特泽生物科技有限公司细胞库。miR-381 mimics NC、miR-381 mimics、miR-381 inhibitor NC、miR-381 inhibitor均购自吉玛公司;Lipofectamine 2000转染试剂购自上海恪敏生物科技有限公司;QIAzol裂解试剂、cDNA逆转录试剂盒均购自百赛生物,其他化学试剂均为国产分析纯,CCK-8购自MCE,二甲基亚砜购自北京鼎国昌盛生物技术有限责任公司。
1.2方法
1.2.1细胞培养及转染分组 将卵巢癌细胞A2780、SKOV3分别置于10%胎牛血清、无血清杜氏改良Eagle培养基(DMEM)培养基和1%双抗的RPMI 1640 高糖完全培养液(美国Gibco公司)中培养。取对数期细胞,接种于6孔板每孔(3.0×105个/孔)。当达到80%融合,根据Lipofectamine 2000说明书对细胞进行转染,分为miR-381control组(不转染miR-381控制)、miR-381 mimics NC组(miR-381模拟阴性对照)、miR-381 mimics组(转染miR-381模拟)、miR-381 inhibitor NC组(miR-381抑制阴性对照)和miR-381 inhibitor组(miR-381抑制)。
1.2.2实时定量聚合酶链反应(qRT-PCR)检测miR-381的表达 收集细胞,采用TrizoL法进行qRT-PCR。U6作为内参,使用 方法计算。miR-381-3p上游引物序列为5′-CCAGUGCA CCGACCCUUGAG ACUGC-3′,miR-381-3p下游引物序列为5′-AGCCUAAACUCGGUCCAA GCAUC-3′;U6的上游引物序列为5′-CTCGCTTCG GCAGCACA-3′,U6的下游引物序列为5′-AACGC TTCACGAATTT GCGT-3′。
1.2.3CCK-8实验 转染24 h后将重悬后的细胞于96 孔板接种,等待贴壁后再分别于0、12、24、48、72 h每孔加10 μL CCK-8溶液,于37 ℃培养箱下孵育3 h。采用酶联免疫监测仪测定各孔光密度(OD)值。
1.2.4划痕愈合实验 采用划痕检测卵巢癌细胞A2780、SKOV3转染miR-381后的迁移情况。将A2780、SKOV3细胞接种于6孔板中,并将细胞置于无血清DMEM培养基饥饿12 h。每孔中线处以100 μL的移液器枪头划过,再每孔加入2 mL无血清DMEM培养基,经过48 h培养后在显微镜下观察细胞迁移情况并拍照。
1.2.5Transwell侵袭小室 在Transwell小室上层接种1×105个细胞,并在Transwell小室下层加入含20%胎牛血清的培养基,再置于37 ℃、5%二氧化碳培养箱中孵育24 h后拭去Transwell小室多余基质胶并去除上室细胞,再以生理盐水洗2次。然后采用结晶紫染色液进行染色,用生理盐水洗2次,在显微镜下拍照并计算结果。
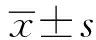
2 结 果
2.1miR-381在卵巢癌细胞中的表达 经慢病毒感染miR-381过表达的卵巢癌A2780、SKOV3 细胞能使细胞内miR-381表达明显上调。见图1。
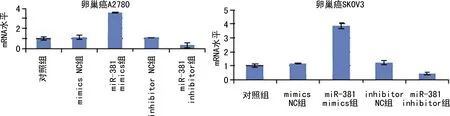
图1 卵巢癌细胞miR-381表达
2.2miR-381对卵巢癌细胞增殖能力的影响 转染了miR-381 mimics的A2780、SKOV3卵巢癌细胞与转染了mimics NC的A2780、SKOV3卵巢癌细胞比较,48、72 h细胞活性均较低,转染了miR-381 inhibitor的A2780、SKOV3卵巢癌细胞与转染了inhibitor NC的A2780、SKOV3卵巢癌细胞比较,48、72 h细胞活性均较高,差异均有统计学意义(P<0.05)。表明miR-381的过表达使A2780、SKOV3卵巢癌细胞活性降低,miR-381抑制卵巢癌细胞的增殖能力。见表1、图2。
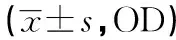
表1 miR-381对A2780、SKOV3卵巢癌细胞增殖能力的影响
2.3miR-381对细胞卵巢癌迁移和侵袭能力的影响 转染了miR-381 mimic的A2780、SKOV3卵巢癌细胞与转染了miR-381 mimic NC的A2780、SKOV3卵巢癌细胞比较,48 h后划痕距离较大,愈合率小[分别为(35.0±2.1)%、(63±5.0)%],差异有统计学意义(P<0.05);转染了miR-381 inhibitor的A2780、SKOV3卵巢癌细胞与转染了inhibitor NC的A2780、SKOV3卵巢癌细胞比较,48 h后的划痕距离较小,愈合率大[分别为(55.0±1.0)%、(49.0±1.0)%],差异有统计学意义(P<0.05)。表明miR-381使卵巢癌细胞A2780、SKOV3迁移速度减慢,抑制卵巢癌细胞的迀移能力。miR-381 mimics组穿入Matrugel基质胶的卵巢癌细胞A2780、SKOV3的灰度值均明显低于miR-381control组及miR-381 inhibitor组,差异均有统计学意义(P<0.05);miR-381control组与miR-381 inhibitor组比较,差异无统计学意义(P>0.05)。表明卵巢癌细胞miR-381的表达水平可影响细胞侵袭能力。见图3、4。
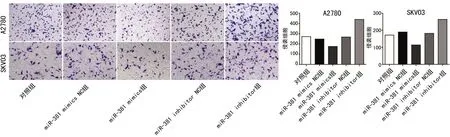
图4 侵袭检测结果
3 讨 论
相关研究表明,miRNA在肿瘤细胞中表达的特异性在肿瘤的发生、发展、浸润、转移及患者预后等过程中均起着重要作用。卵巢癌相关miRNA作为疾病进展的生物标志物或肿瘤抑制剂的创新用途对卵巢癌患者而言可能是有前途的诊治工具,使得miRNA在卵巢癌中生物学功能的研究和阐述显得尤其重要。
miR-381为miRNA中的一种,其编码序列位于14号染色体上,已证实与细胞增殖、分化有关。陈兵海[7]分析验证了miR-381、miR-424与丝氨酸/苏氨酸蛋白激酶家族1的直接靶向关系。林成辉等[8]探讨了血清miR-381在乳腺癌骨转移患者中的表达,结果显示,血清miR-381在乳腺癌骨转移患者中的相对表达水平明显降低。卞干霞[9]研究表明,卵巢癌组织miR-381-3p表达水平降低可促进卵巢癌细胞增殖。杨泽波等[10]研究表明,食管癌组织miR-381呈低表达。有学者发现,miR-381-3p在乳头状甲状腺癌中的表达异常下调,可能与乳头状甲状腺癌的发生、侵袭和转移相关[11-13]。
本研究结果显示,miR-381在卵巢癌细胞A2780、SKOV3低表达,表明miR-381可能在卵巢癌的发生、发展中具有一定作用。将miR-381转染卵巢癌细胞A2780、SKOV3发现,miR-381过表达后卵巢癌A2780、SKOV3细胞的增殖、侵袭和迁移能力受到了抑制。进一步证实了miR-381在卵巢癌中可能担当着重要的抑癌基因角色。miR-381可能成为卵巢癌生物治疗的重要靶点之一,为今后卵巢癌的生物治疗提供了实验依据。李丹[14]研究表明,miR-381在卵巢癌中低表达,上调miR-381可能通过抑制肝脏受体同源物-1、基质金属蛋白酶2表达而抑制卵巢癌细胞转移。但是否存在其他使miR-381发挥抑癌因子作用的通路及具体机制仍需进行全面深入的研究[15-19]。
卵巢癌化疗耐药是治疗卵巢癌效果不佳的原因之一。已有学者对miRNA在耐药形成机制中的作用进行了深入探索,指出在对化疗敏感和耐药细胞系及组织之间存在明显不同的miRNAs表达谱[20]。有研究表明,miRNA与多种肿瘤的多药耐药相关,但miR-381与卵巢癌耐药相关研究尚不多见,需进一步进行miR-381与卵巢癌耐药相关研究,为寻找卵巢癌新的治疗靶点提供理论基础。
