腹腔感染耐碳青霉烯类肺炎克雷伯菌的毒力特征
2021-11-04马立艳苏建荣
马立艳 孙 伟 夏 帅 苏建荣*
(1.首都医科大学附属北京友谊医院检验科,北京 100050;2.首都医科大学研究生院,北京 100069)
既往研究[7]显示,与肺炎克雷伯菌致病相关的毒力因子包括荚膜多糖、菌毛和铁载体等。参与调控荚膜多糖合成的毒力基因黏液表型调节基因A(regulator of mucoid phenotype A,rmpA)位于肺炎克雷伯菌的毒力质粒(large virulence plasmid ofKlebsiellapneumoniae,pLVPK)上,与肺炎克雷伯菌黏附宿主细胞和生长增殖相关。铁载体是一种低相对分子质量的铁螯合剂,由细菌在乏铁条件下分泌,促进细菌的生长繁殖、加重感染,是肺炎克雷伯菌毒力增强的重要原因之一。其中,气杆菌素和受体由iucABCD-iucA基因簇编码,也位于pLVPK毒力质粒上,是HvKP产生的最重要的铁载体[8]。
因此,本研究选取侵袭性腹腔感染部位分离的CRKP菌株为研究对象,通过基因分型、筛查耐药基因和致病基因的携带情况、检测生物膜形成能力和铁载体生成能力,阐述CRKP的毒力特征。
1 材料与方法
1.1 菌株来源
收集2016至2019年首都医科大学附属北京友谊医院侵袭性腹腔感染部位分离的CRKP菌株38株,剔除同一患者相同部位重复分离的菌株。CRKP定义为肺炎克雷伯菌对美罗培南、亚胺培南或厄他培南中介或耐药,或产生碳青霉烯酶[9]。所有菌株保存于-80 ℃无菌脱脂牛奶中。
1.2 试剂与仪器
菌株鉴定使用法国生物梅里埃公司的VITEK MS飞行时间质谱仪及其配套试剂;药敏试验使用法国生物梅里埃公司的VITEK 2 Compact及其配套药敏卡片AST334,郑州安图生物工程股份有限公司的E-test条,以及英国OXIOD公司的药敏纸片;脑心浸液、LB等培养基购自英国OXIOD公司;结晶紫、铬天青S(chrome azurol sulfonate,CAS)、无水哌嗪、三氯化铁、三甲基十六烷基溴化胺(hexadecyl trimethyl ammonium, HDTMA)等试剂购自美国Sigma公司;细菌基因组提取试剂盒和PCR试剂为生工生物工程(上海)股份有限公司产品;脉冲场凝胶电泳仪和分光光度计为美国Bio-Rad公司的产品;PCR仪器为美国应用生物系统公司的ABI 7500;测序仪为美国应用生物系统公司的3730XL。药敏质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853,按照临床和实验室标准化委员会(Clinical and Laboratory Standards Institute, CLSI)制定的抗微生物药物敏感试验执行标准M100-S30文件中的折点进行判读。
1.3 生物膜形成实验
参照文献[10],挑取分纯培养的CRKP菌落1~2个,制备2.0~3.0×108CFU/mL的菌悬液,用脑心浸液稀释100倍,取200 μL加入96孔板,每孔CRKP的终浓度为5×105CFU/mL,脑心浸液作为阴性对照,肺炎克雷伯菌ATCC700603作为阳性对照,37 ℃培养18~20 h。200 μL PBS洗板3次,加入甲醇200 μL固定生物膜15 min,室温干燥10 min。0.5%(质量分数)的结晶紫100 μL染色5 min,300 μL无菌水洗板。待室温干燥后,加入33%(体积分数)的乙酸,摇床震荡10 min充分溶解生物膜。每株菌重复3次试验,取均值计算595 nm处的吸光度A595。
1.4 铁载体生成实验
参照文献[11],将1.5 mL 1 mol/L FeCl3溶液加入到7.5 mL 2 mol/L CAS溶液中,混匀后加入到6 mL 10mol/L HDTMA溶液中,然后将30 mL水溶无水哌嗪(pH值5.6)加入到上述溶液中,定容至100 mL,制成CAS定量检测液。将待测菌株在含有4 mol/L去铁胺的LB培养基中孵育48 h,离心收集上清,用0.22 μm 滤膜过滤,滤后上清与CAS定量检测液等体积混合。LB培养液作为参照同步操作,含4 mol/L去铁胺的LB培养液作为铁离子螯合的质控。每株菌重复3次试验,取均值计算待测菌株在630 nm处的吸光度A630。
1.5 拉丝试验
用无菌环挑取过夜孵育的CRKP菌落,拉丝长度>5 mm即为拉丝试验阳性。
1.6 致病基因和耐药基因检测
参照文献[5,12],聚合酶链式反应(polymerase chain reaction,PCR)方法检测致病基因rmpA2和iucA,碳青霉烯酶基因blaKPC-2、blaNDM-1、blaIMP-4、blaVIM-1和blaOXA-48。所有PCR产物经1.0%(质量分数)琼脂糖凝胶电泳,阳性产物测序并与美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库进行比对分析。
将仅检出碳青霉烯酶基因blaKPC-2的菌株作为KPC组,同时检出blaKPC-2和致病基因rmpA2和iucA的菌株作为KPC+rmpA2+iucA组,两组之间进行生物膜形成能力和铁载体生成能力的比较。
通过调查研究发现男性大学生的自我效能感显著高于女性,因为无论在高校还是社会中,男性在体力、智力、耐力、心理素质等方面明显优于女性,在社会各行业中对男大学生的需求日益增多,间接提升了高校男性大学生的自信能力,进而影响自我效能感。参与过志愿和基层服务的高校大学生与未参与过志愿和基层服务的高校大学生在自我效能感方面具有显著差异,说明在从事志愿和基层服务时,高校大学生所学的理论知识和技能得到实践,在语言沟通、人际交往、统筹协调能力等方面得到了提升,使得这些从事过志愿和基层服务者的高校大学生通过服务他人的过程中自我满足感和幸福感得到升华,进而影响其自我效能感。
1.7 多位点序列分型
根据肺炎克雷伯菌多位点序列分型(multilocus sequence typing, MLST)数据库(http://bigsdb. web.pasteur.fr/klebsiella/primers_used.html)提供的引物序列和反应条件扩增7对管家基因(gapA、mdh、phoE、tonB、infB、pgi、rpoB),将扩增产物测序结果与MLST数据库比对,确定ST型别。根据是否为ST11型分为ST11组与非ST11组。
1.8 统计学方法
2 结果
2.1 实验菌株及其耐药特征
共收集38株CRKP,对至少一种碳青霉烯类抗菌药物耐药,包括亚胺培南、厄他培南或美罗培南,MIC范围为4~128 μg/mL。对替加环素和黏菌素的MIC50分别为1.0 μg/mL和0.25 μg/mL。在38株CRKP菌株中,碳青霉烯酶的检出率为84.2%(32/38)。仅携带blaKPC-2的菌株检出率最高,为76.3%(29/38),其中ST11组的检出率高于非ST11组,两组之间差异有统计学意义(P<0.05)。只携带blaNDM-1的菌株次之,为5.3%(2/38),1株CRKP同时携带blaKPC-2和blaNDM-1,未检测到blaOXA-48、blaVIM-1和blaIMP-4型碳青霉烯酶。ST11为主要克隆株,占比78.1%(25/38),其次为ST37型,占比10.5%(4/38),此外还检出2株ST258和1株ST147,另有6株未知型别,详见表1。
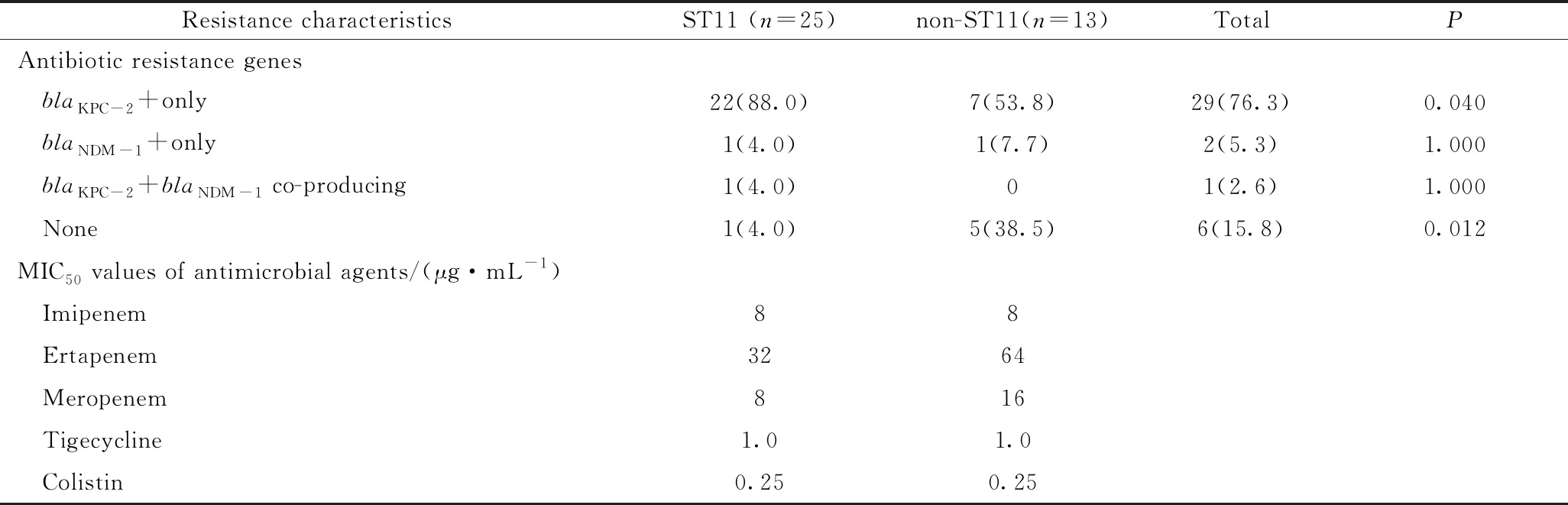
表1 CRKP菌株的耐药特征Tab.1 Resistance characteristics of CRKP strains n(%)
2.2 致病基因的检测情况
38株CRKP中,共23株检测到rmpA2或iucA,其中21株同时携带rmpA2和iucA。ST11组同时携带rmpA2和iucA菌株的检出率为60.0%,非ST11组同时携带rmpA2和iucA菌株的检出率为46.2%,两组之间差异无统计学意义(P>0.05)。在ST37型和ST258型的菌株中未检测到rmpA2或iucA。在21株同时携带rmpA2和iucA的菌株中,14.3%(3/21)的菌株拉丝试验阳性,详见表2。

表2 CRKP菌株的致病基因检测结果Tab.2 Distribution of virulence genes harbored by CRKP strains n(%)
2.3 不同组别生物膜形成能力比较
38株CRKP均可形成生物膜,A595位于0.1~0.8之间,形成生物膜的能力均较弱。与非ST11组相比,ST11型CRKP组形成生物膜的能力略高,两组之间差异无统计学意义(P>0.05)。KPC组与KPC+rmpA2+iucA组生物膜形成能力差异无统计学意义(P>0.05)(图1)。
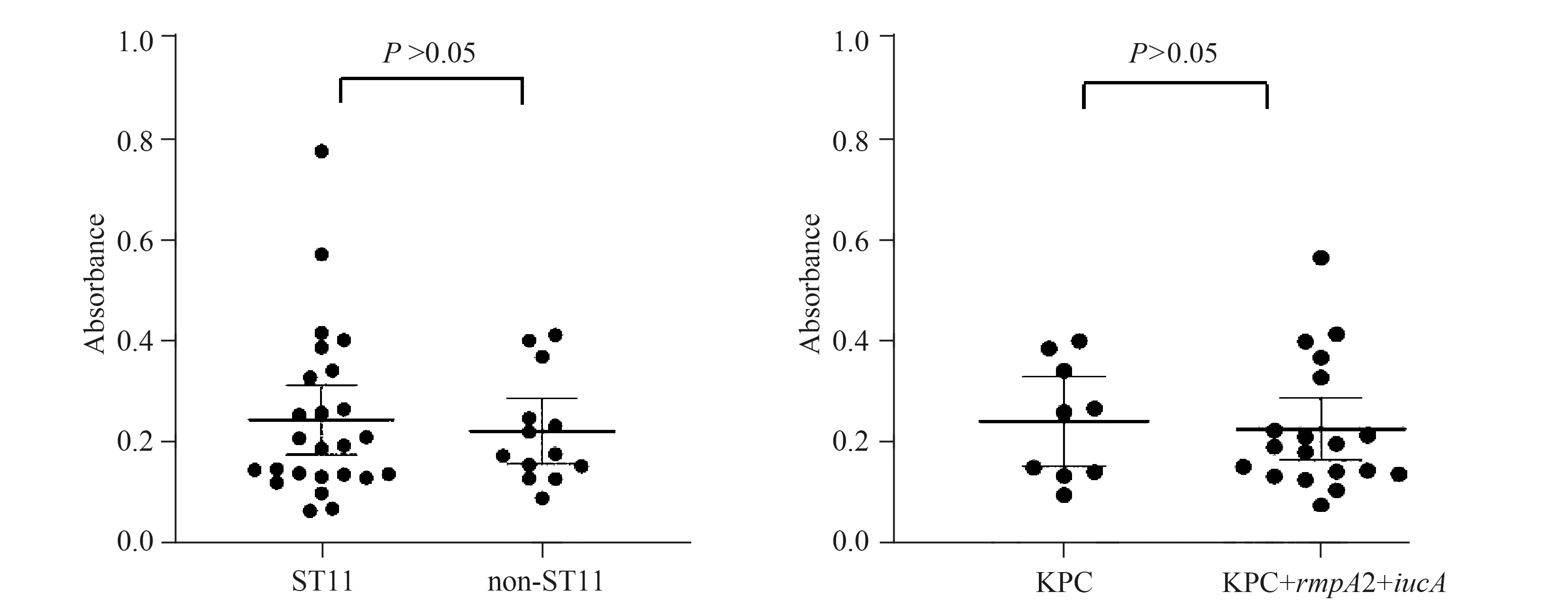
图1 不同组别间生物膜形成能力的比较Fig.1 Comparison of biofilm formation in different CRKP groupsCRKP: carbapenem-resistant klebsiella pneumoniae.
2.4 不同组别铁载体生成能力比较
38株CRKP均可生成铁载体,铁载体生成能力ST11组高于非ST11组,KPC+rmpA2+iucA组高于KPC组,两组间差异均有统计学意义(P<0.05)(图2)。

图2 不同组别间铁载体生成能力的比较Fig.2 Comparison of siderophore production in different CRKP groupsCRKP: carbapenem-resistant klebsiella pneumoniae.
3 讨论
在我国,CRKP最常见的基因型别为ST11型,该克隆株传播性强,是临床重症感染的主要病原菌,部分菌株仅保留了对黏菌素、替加环素的敏感性[13-14]。而携带rmpA、rmpA2和铁载体基因的pLVPK质粒,是一种可移动的、大约170 000 bp的毒力元件,可与碳青霉烯酶耐药基因整合。2017年,Gu等[5]对呼吸机相关肺炎中分离的CR-HvKP菌株进行了分子流行病学研究,证实ST11型CRKP获得了pLVPK质粒后具有高毒力、高耐药、高传播的特点,成为临床抗感染治疗的重大威胁。此后,中国不同地区也相继报告,河南省和山东省较高,CR-HvKP检出率分别为25.4%和25.8%,提示CR-HvKP可能已经在国内引起了播散[15]。
既往研究[2,16]显示,与经典型肺炎克雷伯菌相比,HvKP往往表现高黏性表型,因此通常将拉丝试验阳性作为HvKP的诊断标准。但是,Lin等[17]研究发现,高黏性与毒力并无直接相关性,拉丝试验阴性的菌株也可能引起严重的感染,引起糖尿病小鼠更高的病死率。近期两项中国学者的研究[17-18]显示,HvKP中仅28.9%或30.9%的菌株拉丝试验阳性,与Zhang等[19]研究中10.9%CR-HvKP菌株拉丝试验阳性相似,本研究中的阳性率为14.3%,因此,拉丝试验作为鉴定HvKP的方法并不可靠。大蜡螟LD50和动物实验对鉴定HvKP更为确切,但因其操作复杂,并不适合在临床实验室常规开展。本研究中,88.0%的ST11型菌株中仅检测到blaKPC-2,60.0%的ST11型菌株同时携带rmpA2和iucA,rmpA2和iucA在携带blaKPC-2的ST11型菌株中检出率明显增高。Gu等[5]也证实,毒力基因iucABCD、rmpA2和iut是ST11型CR-HvKP特有,而经典型ST11型CRKP则不具有。因此,目前将菌株的表型、基因型和毒力实验相结合鉴定CR-HvKP是相对可靠的方法,但需要进一步研究筛选出高毒力菌株的特征性生物标志物。
生物膜的形成不仅造成抗菌药物治疗效果不佳,还容易引起感染复发,进一步加重CRKP菌株感染的治疗难度。而一旦生物膜形成,可能会造成CRKP在医院环境中定植、播散。本研究中,不同ST型别间、携带耐药基因和致病基因的不同组别间生物膜形成能力差异无统计学意义。实验所用CRKP菌株形成生物膜的能力均较弱,可能与获得性耐药导致毒力受损有关,如生物膜形成相关蛋白的低水平表达,具体的机制尚需进一步研究。与HvKP常常引起健康人社区获得性感染不同,CRKP通常与侵入性操作、免疫功能受损等有关,造成毒力相对较低的耐药株也可引起严重的侵袭性感染。此外,在体内抗菌药物选择压力下,细菌往往比体外试验更易形成生物膜。
铁载体,尤其是气杆菌素,帮助细菌从宿主体内环境获得铁离子,明显提高肺炎克雷伯菌在腹水和血清中的生存率,是HvKP重要的致病机制,往往引起严重的临床感染。既往对肝脓肿分离HvKP菌株的研究[8,19]证实,铁载体是高毒力的特征性标志物,但是这些研究所用的菌株对临床常用抗菌药物均表现良好的敏感性。本研究选取侵袭性腹腔感染部位分离的CRKP菌株,结果显示,同时携带blaKPC-2、rmpA2和iucA的菌株,铁载体产生的能力明显升高,提示rmpA2和iucA是CR-HvKP重要的毒力因子。仅携带blaKPC-2的菌株虽然产生铁载体的能力较低,但是在乏铁环境中仍然可以分泌铁载体维持自身生长繁殖。
综上所述,同时携带KPC-2型耐药基因、rmpA2和iucA毒力基因的ST11型CRKP,使抗感染治疗形势更为严峻,需要采取严格的医院感染防控措施和/或进行主动筛查,以防止其在医疗机构内播散流行。
