光遗传学技术
——2021年拉斯克奖基础医学研究奖
2021-11-09徐志卿
宫 平 徐志卿,2*
(1. 首都医科大学基础医学院病理学系,北京 100069; 2. 首都医科大学基础医学院神经生物学系,北京 100069)
北京时间2021年9月25日,拉斯克奖(the Lasker Awards)公布了2021年度获奖者名单。
1 基础医学研究奖
2021年基础医学研究奖颁发给了3位在光遗传学(optogenetics)领域贡献突出的科学家,他们是德国马克斯普朗克生物化学研究所(Max Planck Institute of Biochemistry, Martinsried)的Dieter Oesterhelt(图1)、柏林洪堡大学(Humboldt University of Berlin)的Peter Hegemann(图2)和斯坦福大学(Stanford University)的Karl Deisseroth(图3)。拉斯克基础医学研究奖素有“美国的诺贝尔奖”和“诺贝尔奖风向标”之美誉。光遗传学技术作为一项神经科学领域的革命性新技术,目前已被全世界数千个实验室应用于解析神经系统中的复杂神经网络结构。与此同时,它也为神经系统疾病的治疗提供了新的思路。

图1 Dieter Oesterhelt[1]

图2 Peter Hegemann[1]

图3 Karl Deisseroth[1]
2 光遗传学的发展历程
哺乳动物的大脑是一种复杂又精密的系统,大脑中约有数百亿的神经元相互连接,这些神经元分别具有不同的特性和“布线”模式,相互缠绕的神经元能够精确地交换毫秒级别的电信号,从而产生记忆、思考、感觉和情绪等多种生理活动[2]。我们熟知的神经系统疾病都与脑内神经元的功能密切相关。
多年以来,神经生物学家专注于解析神经元的具体功能。但研究手段存在局限性,无法特异性地操控某类神经元的活动。诺贝尔奖获得者Francis Crick在1979年曾提出“神经科学面临的挑战是如何去操控大脑中某一类神经元,同时不改变其他神经元的生理功能”。科学家对此目标也尝试了许多种解决方法:如试图使用药物操控,这种方法虽然可以特异性地操控某类神经元,但由于很难做到毫秒级别,缺乏时间精度;也曾试图用电刺激某一类神经元,但因为电极的控制精度有限,往往对电极插入部位的所有神经元同时产生刺激作用,缺乏对目标神经元的选择性,且电刺激只能促进神经元放电,却不能抑制其放电。因此这些方法都具有一定的缺陷性,并不能做到精细化操控神经元。虽然Crick也推测“也许光线可以作为控制工具操控神经元”,但当时的科学家不知道如何让神经元对光线做出反应。
2.1 光敏蛋白的发现
1969年,年轻的生物化学家Dieter Oesterhelt从德国慕尼黑大学博士毕业之后,来到了美国加州大学旧金山分校,从那里开启了对细菌视紫红质的研究。1971年,他和生理学家Walther Stoeckenius在细菌的细胞膜中,发现了一种紫红色物质含有视黄醛,因此将其命名为细菌视紫红质(bacteriorhodopsin,BR)[3]。细菌视紫红质能够起到光传感器或光感受器的作用,当光照时能够吸取光子的能量,将质子泵出细胞。随着研究的深入,研究人员证明了细菌视紫红质为一种光控的氢离子通道。这种微生物蛋白质与脊椎动物的蛋白质不同,它不与细胞内的第二信使发生级联反应,间接影响离子通道,而是直接将光子转成电流。科学家随后对这种蛋白质家族的其他成员展开研究。在1977年科学家发现了主要介导氯离子细胞内流的卤视紫红质(halorhodopsin,HR)[4](图4)。而2002年发现了这个蛋白质家族的另外一个成员视紫红质通道蛋白(channelrhodopsin,ChR),开启了光遗传学时代。

图4 微生物中发现的3种光敏蛋白[6]
视紫红质通道蛋白的发现,其灵感最早来源于另一种光敏感微生物——绿藻(Chlamydomonas)。从1986年开始,Dieter Oesterhelt的博士学生——生物物理学家Peter Hegemann就开始以莱茵衣藻(Chlamydomonas reinhardtii)为材料,对其趋光性进行研究。科学研究的过程并不顺利,直至2001年,Peter Hegemann才通过比对绿藻基因组数据库,找出了两个与细菌视紫红质高度同源的候选基因。2003年,通过将候选基因分别转入动物细胞(非洲爪蟾蜍的卵母细胞)[5]和人的细胞(人胚胎肾脏细胞HEK293)[6]中,均准确表达了衣藻视紫红质蛋白。研究发现,这种蛋白的活性受光的调控,并且介导了阳离子如钠离子、钙离子等流入细胞中,这也是第一次发现光能够直接控制离子通道。这种蛋白的发现,也给了神经生物学家带来了新的思路:ChR可以在神经元中表达并影响其生理功能,它也许可以成为光控制神经元的理想介质。这些发现奠定了光遗传学发展的基础。
2.2 光遗传学的诞生
ChR的发现吸引了众多神经生物学家的目光,越来越多的研究者加入到光控细胞的探索中。起初,研究者[7-8]认为这种异物膜蛋白可能会对哺乳动物的神经元有毒不良反应,其光电流(photocurrent)可能会过慢或过弱,无法发挥预想的作用。且微生物的视蛋白吸收光子时需要辅助因子全反式视黄醛的配合,因此有些研究者认为其可能难以独立发挥作用。此时,斯坦福大学的Edward. S. Boyden和Karl Deisseroth也在探索控制神经元的新技术,尤其是当过精神科医生的Karl Deisseroth迫切地想要找到一种对精神病患者不良反应小的新的治疗方法。直到2005年8月,拥有工程背景的Edward. S. Boyden和医学背景的Karl Deisseroth使用慢病毒载体将单个ChR2基因转入哺乳动物的神经元后,ChR2能够准确地表达在海马神经元的细胞膜上,且在不添加全反式视黄醛的条件下,蓝光照射表达外源性ChR2的神经元可以在50 ms内引起阳离子的流入,神经元发生去极化效应,即神经元能够准确地对光做出反应[9]。这一新颖的发现虽然当时被Science杂志拒稿,只刊登在NatureNeuroscience上,但它却正式拉开了光遗传学的序幕。后来,人们证实BR和HR也能够快速又准确地开启或终止神经元的活动[10]。除了上述提到的科学家,华人视觉科学家潘卓华(美国韦恩州立大学),也提出了光敏蛋白ChR2在视网膜细胞上的表达,这一发现对治疗失明有很大的临床应用价值[11]。同期,Lynn T. Landmesser、Stefan Herlitze(美国凯斯西储大学)和Hiromu Yawo(东京大学生命科学研究院)也分别发表了ChR2在哺乳动物细胞和神经细胞中的应用研究[12-13]。
3 光遗传学的基本原理
神经元在静息状态下,细胞膜两侧存在电位差,这是由于细胞膜内外各种离子浓度分布不均匀和细胞膜对各种离子的通透性不同所造成的。而细胞膜对各种离子的通透性的改变会导致膜电位的改变进而导致神经元的兴奋性发生改变。光遗传学的原理是选用病毒载体,将光敏蛋白的基因转入到特定的神经细胞中,目的是为了表达光敏的离子通道[14]。当这些能被不同波长的光激活的光敏蛋白受到相应波长的光照刺激时,这些离子通道会对细胞膜内外的阳离子或阴离子产生选择性开放,引起细胞膜内外的膜电位发生改变,从而选择性地兴奋或抑制神经细胞(图5)。
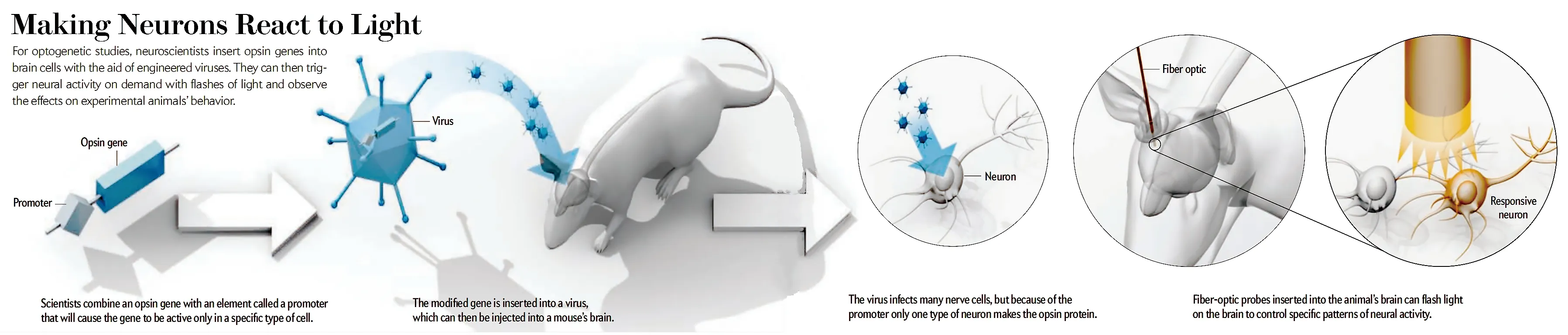
图5 光遗传学的工作原理[13]
光遗传学是将遗传学和光学结合在一起的新兴技术[15]。它通过将具有光反应性的基因插入特定的神经细胞中,用光来控制经过基因改造的目标细胞,以此来精准操控目标细胞来确定如其在活体神经回路中的作用等。由于哺乳动物的组织中天生就含有足量的全反式视黄醛,除了转入ChR基因,无需再向目标神经元中转入其他基因。因此,光遗传学具有高度可行性和应用性[16-17]。
在应用过程中,首先要选择适合的光敏蛋白。光敏蛋白按功能分类,可分为两类,即激活神经元型,如:ChR2(H134R)、ChR2(C128S/D156A)、ChETA、oChIEF、C1V1、Chronos、ChrimsonR、ST-ChroME和ChRger等;和抑制神经元型,如eNpHR3.0、Arch、Mac、Jaws和ST-eGtACR1等。第二,将光敏蛋白导入靶细胞中,常用方法包括转染、病毒注射或构建转基因动物等。第三,将光导入研究的区域,如采用导入光纤或者控制激光来实现,通过选择不同参数(波长、光强度、频率)光照进行刺激,对神经元进行精准的时间和/或空间调控。第四,配合电生理记录或行为学手段等实验方法,观察和记录光刺激后的神经元变化、神经环路或动物的行为学变化。
4 光遗传学的未来
随着光遗传学技术的不断发展,光遗传学作为一项新的技术已被广泛用于各领域科学研究中。在光遗传学技术的帮助下,在阿尔茨海默病[18]、帕金森病[19]、抑郁症[20]、慢性疼痛和焦虑[21]等神经系统疾病研究中可以对神经细胞进行精准解析,从而对相关机制有更深层次的认识。光遗传学技术的应用也为神经系统的药物研发带来了新的契机[22],且人们也在不断地探讨光遗传学技术的临床应用,希望能为神经系统疾病的治疗开辟新的途径。此外,光遗传学技术不但已经被应用于心血管[23]等其他系统的生理和病理机制研究,还被用于植物细胞功能的研究[24]。同时,人们也发现光遗传学技术存在一些需要关注和改善的问题:如神经元中的光敏蛋白的表达也许并不均匀,过表达的光敏蛋白本身对细胞功能的影响,等等。每项新的科学技术的发现和发展的背后,都隐藏着许多勇于探索和创新的科学家,他们都值得我们敬佩。但我们相信,随着科学技术的发展,会有更多的交叉学科技术应用于光遗传学中,虽然也许还需要经历艰难和漫长的探索过程,但光遗传学技术会逐步得到完善并被更广泛地应用。
