早期三阴性乳腺癌新辅助免疫治疗联合化疗的研究进展
2021-11-03韩敬茹综述邓红彬审校
韩敬茹 综述 邓红彬 审校
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌中预后较差的亚型,行新辅助化疗(neoadjuvant chemotherapy,NACT)能缩小肿瘤,提高手术率并预测预后。研究表明,仅接受NACT 的TNBC 患者中有60%~70%未能达到病理完全缓解(pathological complete response,pCR)[1-2]。在乳腺癌中,TNBC 患者能否达到pCR 与可否获得良好的长期预后关系最为密切。研究表明,免疫治疗联合化疗可延长晚期TNBC 患者的中位生存期(overall survival,OS)[3-4]。而早期TNBC 在新辅助治疗中应用免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)联合化疗的研究正在开展中。本文将就早期TNBC 新辅助免疫治疗联合化疗的疗效与安全性的研究进展进行综述。
1 早期TNBC 患者的新辅助治疗现状
早期TNBC 行新辅助治疗可缩小肿瘤,提高保乳手术的成功率及肿瘤切除率,并通过术后病理结果评估肿瘤对治疗的反应,以预测患者的预后,从而更好地制定辅助治疗策略[5-6]。中国临床肿瘤学会(CSCO)乳腺癌指南推荐,TNBC 患者新辅助治疗的指征为原发肿瘤大小>2 cm、腋窝淋巴结转移、有保乳意愿,ⅠA 级推荐方案为紫杉烷类(taxanes,T)、蒽环类(anthracyclines,A)及环磷酰胺(cyclophosphamide,C)。研究表明在以TAC 为基础的方案中加入卡铂,pCR 率提高至约50%,但其对无疾病生存期(disease-free survival,DFS)和OS 影响尚不确定,且会增加治疗不良反应,目前未被广泛推荐应用于临床[7-9]。
2 早期TNBC 患者应用新辅助免疫治疗联合化疗
美国食品药品监督管理局(FDA)批准阿特珠单抗联合紫杉醇用于一线治疗PD-L1 阳性的不可手术切除的局晚部期或转移性TNBC,是基于IMpassion130 临床试验的结果[3]。TNBC 是乳腺癌的亚型,研究表明其具有高度异质性,不同类型的TNBC 细胞差异较大[10]。目前TNBC 分为4 种mRNA 亚型:1)腔面雄激素受体(luminal androgen receptor,LAR)型;2)免疫调节(immunomodulatory,IM)型;3)基底样免疫抑制(basal-like immune-suppressed,BLIS)型;4)间质(mesenchymal-like,MES)型。而IM 型TNBC细胞的周围有大量淋巴细胞,意味着该亚型可能对免疫治疗较敏感。研究表明,在意向治疗人群(intentionto-treat,ITT)中,IM 型TNBC 使用ICIs 联合紫杉醇的客观缓解率(objective response rate,ORR)为52.6%(95%CI:28.9%~75.6%)[4]。以上研究显示,晚期TNBC的免疫治疗获得一定疗效,促使将免疫治疗用于早期TNBC,以改善患者长期生存获益。早期TNBC 患者的新辅助免疫治疗联合化疗的临床试验见表1。
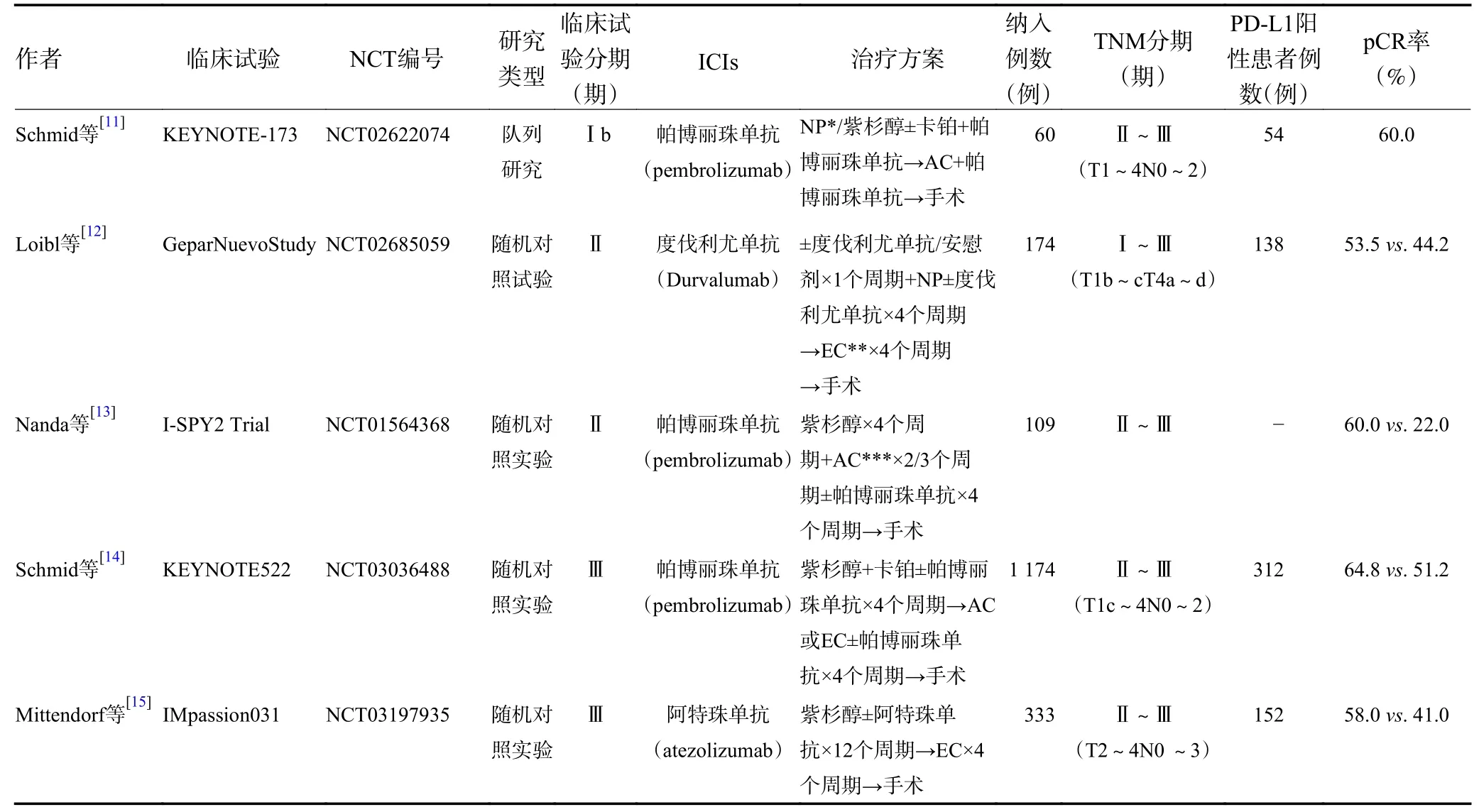
表1 新辅助免疫治疗联合化疗临床试验
2.1 疗效
多项研究表明,新辅助免疫治疗联合化疗提高了早期TNBC 的pCR 率及无事件生存率(event-free survival,EFS)[11-16]。KEYNOTE-173 研究结果显示患者获得了良好的抗肿瘤效应,患者达到pCR 比例为60%[11]。该研究结果为免疫疗法用于早期TNBC 的新辅助治疗奠定了基础。GeparNuevo 试验结果显示,TNBC 患者行NACT 联合度伐利尤单抗方案的pCR率增加9%,但差异无统计学意义(P=0.287)[12]。I-SPY2 研究显示,试验组的pCR 率约为对照组的3倍[13]。KEYNOTE522 研究显示,试验组与对照组的pCR 率差为13.6%(95%CI:5.4~21.8,P<0.001),随访15.5 个月两组的EFS 分别为91.3%和85.3%(HR=0.63, 95%CI:0.43~0.93)[14]。IMpassion031 研究显示,试验组与对照组的pCR 率差为17%(95%CI:6~27,P=0.004 4),随访2年后两组的EFS 差异无统计学意义[15]。NeoTRIPaPDL1 研究显示,280 例患者行卡铂+紫杉醇化疗方案联合阿特珠单抗组或不联合阿特珠单抗组的pCR 率无显著性差异(OR=1.11, 95%CI:0.69~1.79,P=0.066)[16]。相关Meta 分析结果亦表明,新辅助免疫治疗联合化疗能提高pCR 率与EFS[17-18]。
2.2 安全性
KEYNOTE-173 试验表明,新辅助免疫治疗联合化疗发生治疗相关不良事件(treatment-related adverse events,TRAEs)与单用帕博丽珠单抗或化疗基本相同[11]。该研究中54 例患者发生3 级及以上TRAEs,最常见为血液性毒性,24 例患者发生严重TRAEs。GeparNuevo 研究结果显示,试验组并未出现更频繁的化疗药物减量与化疗终止,试验组TRAEs 发生率与化疗组相近,但甲状腺功能障碍发生率较高[12]。该研究的两组患者中分别有30 例与29 例患者至少发生一次严重不良反应(severe adverse events,SAEs)。KEYNOTE522 研究表明,试验组与对照组分别有76.8%和72.2%的患者发生3 级及以上TRAEs,发生SAEs 的患者分别占32.5% 与19.5%,试验组23.3%患者和对照组12.3%患者因TRAEs 终止药物治疗[14]。该研究中,新辅助帕博丽珠单抗联合化疗与帕博丽珠单抗单药新辅助免疫治疗或仅行NACT 发生TRAEs 及SAEs 的频率相近,新辅助帕博丽珠单抗联合化疗并未导致新辅助阶段化疗药物的减量或化疗终止。
IMpassion031 研究显示,试验组与对照组分别有103 例与101 例患者发生3 级及以上TRAEs,37 例和26 例患者发生SAEs[15]。该研究两组中分别有21例和19 例患者因TRAEs 停用阿特珠单抗或安慰剂。Tarantino 等[18]Meta 分析表明,试验组患者发生3 级及以上TRAEs、SAEs 与对照组患者相比无显著性差异(P>0.05)。总之,新辅助免疫治疗联合化疗不良反应比NACT 发生率高,但3 级及以上TRAEs 发生率无明显的升高。
2.3 影响疗效的可能因素
TNBC 较其他类型的乳腺癌有更多的肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs),因此TNBC 患者适合使用ICIs 治疗。研究表明,TILs 水平与TNBC 患者预后密切相关,TILs 每增加10%,TNBC 患者复发、转移或死亡的风险分别降低14%、18%、19%[19]。研究显示,TNBC 中的肿瘤细胞与免疫细胞均有PD-L1 高表达,可为ICIs 提供更多靶点,从而增强免疫治疗疗效,TNBC 因有较多的非同义突变,可产生肿瘤特异性的新抗原并激活新抗原特异性T细胞,进而产生抗肿瘤免疫应答,联合使用ICIs 可增强其效应[20-22]。另有TONIC 试验表明,蒽环类药物可诱导肿瘤微环境变化,从而促进对ICIs 的反应[23]。且转移性TNBC 中高肿瘤突变负荷能提高行ICIs 治疗患者的无进展生存期(progression-free survival,PFS)[24]。
2.4 影响新辅助免疫治疗联合化疗疗效的可能因素
2.4.1 TILs 水平与疗效 GeparNuevo 试验将TNBC患者的间质肿瘤浸润淋巴细胞(stromal tumor-infiltrating lymphocytes,sTILs)水平分为低(0~10%)、中(11%~59%)、高水平(60%及以上),多变量Logistic 回归分析发现sTILs 为能否达到pCR 的独立预测因子[12]。在该研究整个队列中,中水平sTILs 与低水平sTILs 的优势比(odds ratio,OR)为1.79(95%CI:0.93~3.47);高水平sTILs 与中水平sTILs 的OR 为3.09(95%CI:1.12~8.52),表明TNBC 患者的pCR 率与sTILs 水平呈正相关(P<0.01),并与KEYNOTE-173 试验[11]结果相同。
2.4.2 PD-L1 表达与疗效 GeparNuevo 试验显示,与PD-L1 表达阴性患者相比,肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥1%患者(PD-L1 表达阳性)的pCR 率有所增加[12]。NeoTRIPaPDL1 研究中的pCR 多因素分析显示,整体反应(overall response,OR)为2.08(95%CI:1.64~2.65,P<0.000 1),PD-L1 表达是否阳性(TPS≥1%)为能否达到pCR 的最重要影响因素[16]。KEYNOTE-173 试验亦表明,pCR 率与PD-L1 表达呈正相关[11]。KEYNOTE522 研究显示,试验组及对照组的联合阳性分数(combined positive score,CPS)≥1 患者(PD-L1 表达阳性)的pCR 率分别为68.9% 及54.9%;PD-L1 表达阴性患者pCR 率分别为45.3% 及30.3%[13]。该研究试验组中的PD-L1阳性和PD-L1 阴性患者的pCR 率均有提高。IMpassion031 研究表明,试验组中PD-L1 表达阳性(TPS≥1%)与PD-L1 表达阴性患者分别有69% 与49%达到pCR[15]。研究表明,新辅助免疫治疗联合化疗组较单纯化疗组有更佳的疗效获益,PD-L1 表达阳性组患者具有较高的pCR 率,但对试验组中PD-L1 表达阳性与PD-L1 表达阴性组因未行统计学分析,需要进一步探索PD-L1 表达水平的疗效预测价值[13,15]。PDL1 表达阳性可能为良好的预后生物学标志[12,16],另有多项研究表明,无论PD-L1 表达状态如何,患者均可从新辅助免疫治疗联合化疗中获益,其中PD-L1 表达阳性患者可获益更多[13,15,17-18]。
2.4.3 其他影响疗效的因素 Tarantino 等[18]Meta 分析表明,淋巴结阳性、TNM(≥Ⅱ期)的早期TNBC 患者行新辅助免疫治疗联合化疗会获益更多。Sternschuss 等[17]分析患者中位年龄、肿瘤大小≤5 cm 占比、淋巴结阳性占比与PD-L1 阳性占比对pCR 率影响并进行Meta 分析表明,这些因素与能否达到pCR无显著性相关。
基于TNBC 患者行NACT 后pCR 率提高与生存呈正相关,有研究对影响新辅助免疫治疗联合化疗的因素进行分析,并推测在新辅助免疫治疗联合化疗中pCR 率亦是预后重要的预测因素[19]。该研究表明,TILs 水平较高和PD-L1 表达阳性的TNBC 患者可从新辅助免疫治疗联合化疗中获益更多,但其他因素对疗效影响仍有待进一步的研究。
3 结语
早期TNBC 患者行新辅助免疫治疗联合化疗有pCR 率及EFS 获益,2021年CSCO 乳腺癌诊疗指南已将含白蛋白紫杉醇化疗方案联合ICIs 作为TNBC患者新辅助治疗的Ⅱ级推荐。但免疫治疗的最佳时机和使用时间、应联合何种化疗方案、受益人群、有效的生物学预测标志物、pCR 率的改善是否与患者的长期生存获益相关尚不明确。新辅助免疫治疗联合化疗为TNBC 的治疗提供了全新思路,或可成为未来TNBC 患者新辅助治疗的方向。
