海洋无脊椎动物多不饱和脂肪酸合成代谢机理研究进展
2021-11-03王姮丁君
王姮,丁君
(大连海洋大学,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
近年来,人们对水产品质量安全、优质动物蛋白以及脂肪来源的关注度越来越高。水产品中富含人体所必需的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),PUFA不仅是维持正常生命活动的必需物质,而且对很多疾病具有明显的预防和治疗作用。然而,由于过度捕捞和环境破坏等因素,天然渔业资源呈现下降的趋势。近年来,人类不断增加的水产品需求主要依赖于水产养殖业的发展。因此,需要开发新的PUFA来源以满足人类需求。几乎所有的PUFA都来自于水生生态系统中的初级生产者,微藻作为海洋中PUFA的主要初级生产者,其生产出的PUFA进入食物链后,由较高营养级生物通过转化或修饰产生新的PUFA[1]。
人们希望通过研究鱼类PUFA生物合成途径来寻找传统鱼粉和鱼油等的替代品,如植物粕和植物油,从而提高水产养殖的可持续性。因此对鱼类内源二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的合成途径进行了大量研究[2-3],而藻类作为长链多不饱和脂肪酸的主要初级生产者一直备受关注[4]。相比之下,无脊椎动物PUFA合成的研究却相对较少。无脊椎动物位于初级生产者(植物)与脊椎动物(鱼类)之间,约占动物总种类数的95%[5]。曾经认为“动物”没有合成PUFA的能力,只能通过营养升级(trophic upgrading)来获得PUFA。但近几年发现,低等动物具有合成PUFA的能力[2]。由于PUFA在动物个体发育、生长、存活率、色素沉积、应激和疾病抵抗力以及大脑、视力和神经系统中起着重要作用[6],因此,为了获取富含更多PUFA的食物来源,海洋无脊椎动物受到越来越多的关注。同时,随着分子生物学及相关技术的发展,对海洋无脊椎动物PUFA生物合成和代谢分子机制的研究逐渐成为热点。如何提高无脊椎动物自身PUFA的合成能力是解决饲料中植物油替代鱼油问题的关键,因此,在分子水平上研究海洋无脊椎动物PUFA的生物合成途径和调控机制具有重要意义。
尽管海洋无脊椎动物数量庞大、种类繁多,但是基于理论研究和实际生产应用的需要,有关研究报道多集中于多孔动物、刺胞动物、软体动物、甲壳动物和棘皮动物等。因此,本文对以上五类海洋无脊椎动物PUFA合成和代谢途径以及重要酶和关键基因的研究进展进行综述,为海洋无脊椎动物PUFA合成、代谢与调控体系的研究提供参考资料。
1 多不饱和脂肪酸简介
碳原子≥20、双键数≥3的PUFA称为长链多不饱和脂肪酸(long-chain polyunsaturated fatty acid,LC-PUFA)。主要分为n-3、n-6、n-7和n-9系列,其中,n-3和n-6系列具有重要生物学功能。距羧基最远端的双键在倒数第3个碳原子上的称为n-3 PUFA;在第六个碳原子上的称为n-6 PUFA。n-3 PUFA主要包括α-亚麻酸(linolenic acid,ALA,C18∶3n-3))、二十碳五烯酸(eicosa-pentaenoic acid,EPA,C20∶5n-3)和二十二碳六烯酸(docosahexaenoic acid,DHA,C22∶6n-3);n-6 PUFA主要包括亚油酸(linoleic acid,LA,C18∶2n-6)、γ-亚麻酸(γ-linolenic acid,GLA,C18∶3n-6)和二十碳四烯酸(又称花生四烯酸,arachidonic acid,AA,C20∶4n-6)等。它们的结构特点及在人体内代谢的相互转化方式如图1所示[7],包括了多种人和动物体维持正常生长发育及生理功能的必需脂肪酸(essential fatty acid,EFA),如AA、EPA和DHA,它们是细胞膜磷脂的重要成分,可以降低膜的相变温度,增强膜的流动性,对于维持生物膜的正常生理功能具有重要作用[8];同时,由于富含DHA的磷脂赋予了细胞膜特殊的流动性和压缩性,使得神经传输和视觉感受所需的生物膜相变能够迅速进行,因此,在人的大脑发育和心脑血管疾病等方面具有重要作用[9-10]。除此之外,PUFA还对脂类代谢、机体免疫及血液生理生化特性[11-13]等有一定程度影响,而且对海洋生物的生长、发育和繁殖发挥重要作用[14-15]。
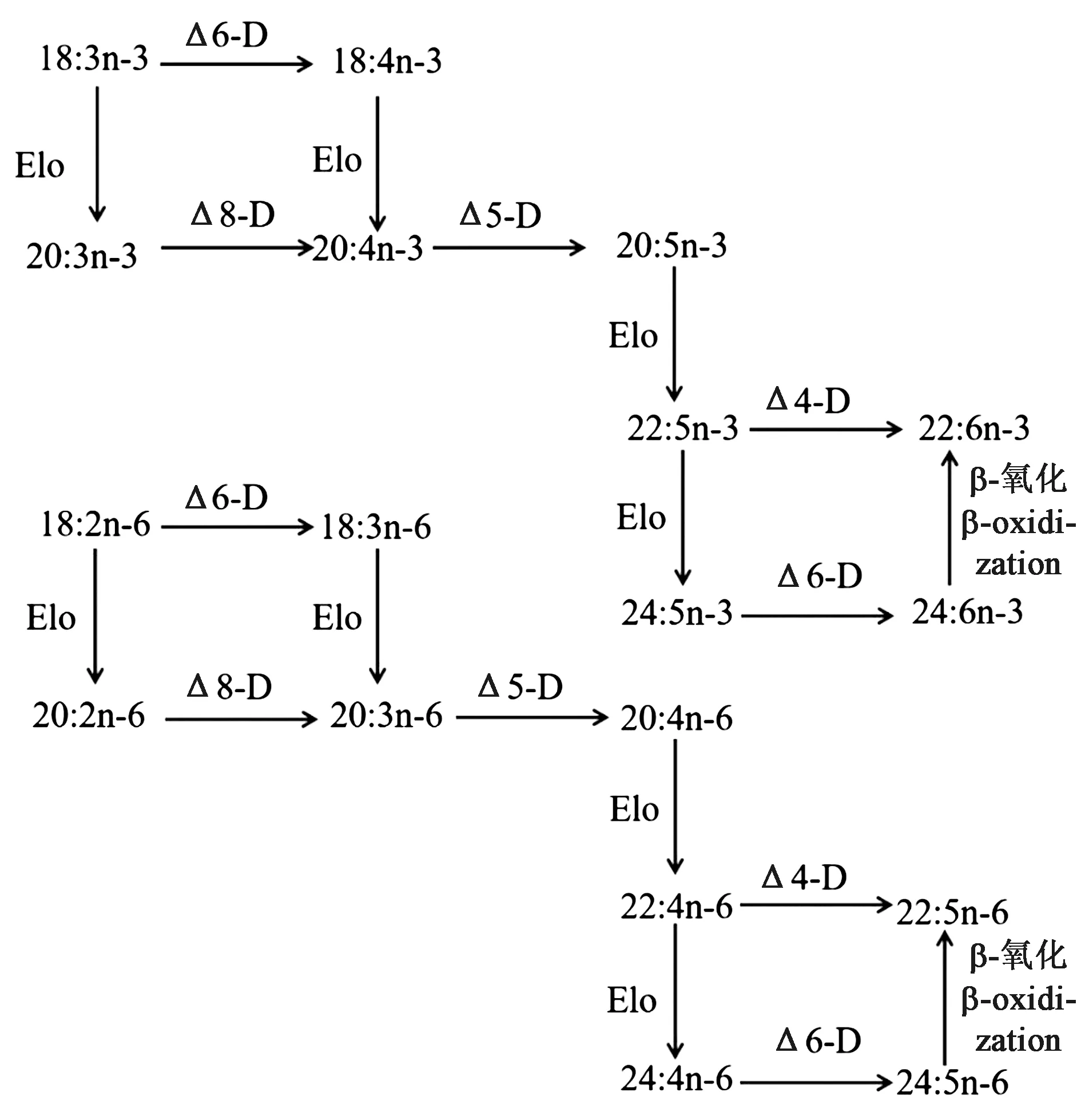
图1 脊椎动物多不饱和脂肪酸PUFA的合成途径[1]Fig.1 Biosynthetic pathways of PUFA in vertebrates[1]
在海洋无脊椎动物中,发现脂肪酸去饱和酶(fatty acid desaturase,Fad)具有非亚甲基中断脂肪酸(non-methylene-interrupted fatty acids,NMI FA)(双键之间不止有一个甲基的PUFA[16])的合成能力[17]。NMI FA最早于70年代在海藻、多孔动物(海绵)和海洋软体动物中发现,主要分为三类:第一类具有常见的亚甲基中断不饱和结构,但其中缺少一个双键结构,如20∶3Δ5,11,14,20∶4Δ5,11,14,17;第二类主要存在于海绵动物中,具有典型D5Z,9Z不饱和结构的中长链(C16-C34)NMI FA,如18,2Δ7,11,20∶2Δ9,13;第三类主要存在于软体动物中,如20∶2Δ5,11,20∶2Δ5,13,22∶2Δ7,13,22∶2Δ7,15,20∶3Δ5,11,14,22∶3Δ7,13,16[18]。
2 PUFA合成代谢的关键酶
PUFA合成代谢的关键酶主要包括脂肪酸去饱和酶(fatty acid desaturase,Fad)、长链脂肪酸延长酶(elongase of very long chain fatty acid,Elovl)、脂肪酸合成酶(fatty acid synthetase,Fas)、乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和硬脂酰辅酶A去饱和酶(stearoyl-coenzyme A desaturase,SCD)。
Fad主要位于真核生物的内质网膜,因此具有膜整合酶特有的三个保守组氨酸富集区,由一个NADH-细胞色素b5还原酶和细胞色素b5协助其完成碳链脱氢。具体过程是 NADH和脂酰-CoA分别贡献一个电子与氧分子结合,从而形成一个双键并释放两分子水[19]。在脊椎动物中,Fads家族包括Fad1、Fad2、Fad3三种基因。Fad1和Fad2基因的产物分别具有Δ5和Δ6 Fad酶活性,而Fad3的表达产物没有活性[20]。此外,也有研究证明,Fads基因不仅具有Δ5和Δ6活性,还具有Δ8和Δ4去饱和功能[21],可将ALA和LA转化为22∶5n-3和22∶4n-6,或者将20∶3n-3和22∶5n-3 转化为 20∶4n-3 和 DHA。
Elovl催化聚缩反应是碳链延长的限速步骤。Elovl催化脂肪酸和丙二酰CoA缩合,是C18以上PUFA合成LC-PUFA过程中的关键酶。在脊椎动物中,延长酶家族存在7个成员,根据它们作用底物的特异性不同,分别命名为Elovll~Elovl7,其中Elovl2、Elovl4和Elovl5是PUFA合成的关键酶[22]。
Fas是脂肪酸合成的关键酶,主要位于脊椎动物的脂肪和肝脏等组织中,FAS途径是以乙酰CoA、丙二酸单酰-CoA 为底物,首先在FAS复合酶的作用下生成软脂酸,再在碳链延长酶作用下生成硬脂酸,随后在一系列脂肪酸去饱和酶和延长酶的作用下生成包括终产物 DHA在内的一系列不饱和脂肪酸[23],其活性高低直接影响体内脂肪的合成,不饱和脂肪酸对FAS活性具有抑制作用。
ACC是脂肪酸合成代谢过程中的限速酶,催化乙酰CoA合成丙二酰CoA,并在脂肪酸延长酶的作用下合成长链脂肪酸。ACC是磷酸腺苷激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)的下游靶点,AMPK可通过其磷酸化水平来抑制ACC表达,并调控脂肪的分解与合成代谢[24]。
SCD 是脂肪酸去饱和化的限速酶,催化饱和脂肪酰基CoAΔ9-cis的去饱和化,生成单不饱和脂肪酸(monounsaturated fatty acid,MUFA),将C16∶0和C18∶0 转化成棕榈油酸(C16∶1)和油酸(C18∶1),C18∶1也可以被SCD去饱和化为共轭亚油酸(conjugated linoleic acid,CLA,C18∶2)。SCD是脂肪酸形成和肌肉间脂肪沉积过程中的重要调控因子[25]。
3 初级生产者与脊椎动物PUFA合成代谢途径
PUFA的初级生产主要由海洋中光合微藻、异养原生生物以及细菌完成。微藻为从头合成PUFA,主要通过给饱和脂肪酸依次添加双键的有氧途径,即通过Δ9和Δ12(或ω6)去饱和酶将C18∶0(16∶0)合成C18∶2n-6(亚油酸,LA),进而通过Δ15(或ω3)去不饱和酶,合成C18∶3n-3(α-亚麻酸,α-linolenic acid,LNA)[26](图2)。通过一系列在Δ9位置与羧基末端之间插入双键的去饱和酶以及延长酶的作用下将LNA转化为EPA与DHA。传统程序是Δ6 去饱和酶→延长酶→Δ5去饱和酶→延长酶→Δ4去饱和酶,但在某些物种中,最初的步骤可以是通过Δ8去饱和化延长为C20∶3n-3或C20∶4n-6的Δ17去饱和化生成EPA[26]。近年来发现,原核生物和真核生物都可以通过多聚乙酰合成酶(polyketide synthase,PKS)参与的全新厌氧途径来合成PUFA[27]。PKS途径最初在希瓦氏菌Shewanellasp.中被发现,随即在弧菌Vibriosp.以及从鱼类和无脊椎动物肠道中分离出的大多数生产PUFA细菌中均有发现[25],因此,海洋细菌即可通过有氧途径,也可通过厌氧途径进行PUFA的合成。

图2 初级生产者PUFA合成代谢途径[32]Fig.2 Biosynthetic pathways of PUFA in primary producers[32]
与所有脊椎动物相同,鱼类不能从饱和脂肪酸和单不饱和脂肪酸合成PUFA,因此PUFA是必需的膳食营养物质[28]。尽管DHA和EPA多存在于鱼类及鱼油中,但它们最初是由微藻合成。鱼类通过“营养升级(trophic upgrading)”过程,使体内的必需脂肪酸含量增加从而具有更高的营养价值,也可以通过代谢C18 PUFA、LNA和LA,生成LC-PUFA,不过这取决于该物种是否具有合成EPA或DHA的能力。在脊椎动物中,EPA的合成首先通过C18∶3n-3的Δ6去饱和作用生成C18∶4n-3,再通过Δ5去饱和作用后在延长酶的作用下生成C20∶4n-3,与C18∶2n-6合成花生四烯酸(arachidonic acid,ARA )过程中所涉及的酶相同[29](图1)。鱼类将C18 PUFA转化为LC-PUFA的能力与Fad、Elovl的补充有关[30]。为了揭示这些酶活性的分子基础,近些年来有研究通过酶基因cDNA克隆的方法,使用不同种酵母载体Saccharomycescerevisiae(没有内生LC-PUFAFad或Elovl基因的表达)来研究它们的表达功能,并通过培养转化的酵母酶活性与适当的PUFA基质确定酶的活性。目前一些海水鱼和淡水鱼中已完成了Δ6Fad、Δ5Fad的 cDNA克隆与特征描述,也发现了具有双功能Δ6 /Δ5 Fad表达的鱼类[31]。在哺乳动物中,已知的参与LC-PUFA生物合成Elovl的基因至少有两个,分别为Elovl2和Elovl5[22]。不同物种的PUFA生物合成能力不同,许多海水鱼类明显地缺少了Δ5Fad和Elovl2[31]。
4 海洋无脊椎动物PUFA合成代谢
与脊椎动物不同,海洋无脊椎动物中LC-PUFA的生物合成途径仍然知之甚少[1](图3)。研究表明,一些海洋无脊椎动物通过Fads和Elovl酶进行LC-PUFA的生物合成[18],然而PUFA合成代谢途径较为复杂,因此,本文根据生物进化历程,按照由低等到高等的顺序分别对多孔动物、刺胞动物、软体动物、甲壳动物和棘皮动物共五类海洋无脊椎动物PUFA合成代谢途径及相关酶基因的研究进展进行概述,着重总结了水产经济物种中软体动物、甲壳动物和棘皮动物LC-PUFA合成代谢的分子机制。

图3 无脊椎动物多不饱和脂肪酸合成途径[1]Fig.3 Putative biosynthetic pathways of PUFA in invertebrates[1]
4.1 多孔动物
多孔动物(Porifera)又称海绵动物,其脂肪酸具有独特的结构特点,包括长脂酰链(可达34个碳)、支链、官能团、相对较高的未饱和度(可达6个双键)和一个特定模式内的未饱和脂酰链[33]。在多孔动物中,NMI FA以Δ5,9双键模式为主,可将C16∶0转化为C26∶0,而两个双键可以按任意顺序添加[34]。有研究报道,在大堡礁海绵(Amphimedonqueenslandica)的基因组中发现了Fad和Elovl基因,表明该物种中存在参与LC-PUFA生物合成途径的候选酶[35],包括一个Fad和两个延长酶Elovl2、Elovl4,具体序列详见表1。因此,在海绵动物中存在着活跃的去饱和系统和延长系统[33]。多孔动物的脂肪酸具有很好药用价值,例如从花萼海绵(Discodermiacalyx)和南海海绵(Theonellaswinhoei)中提取出的蛋白磷酸酯酶抑制剂(Calyculin A),Calyculin A是一种八甲基多羟基二十八碳脂肪酸[36],可以抑制小鼠L1210和P388白血病细胞系的增殖,特定地抑制蛋白磷脂酶I和蛋白酯酶IIA的活性,其衍生物可选择性地作用于增值细胞而非正常静止细胞,有开发成新型药物的潜力[37],具有良好的应用前景[38]。
4.2 刺胞动物
刺胞动物(Cnidaria)又称腔肠动物,能够与PUFA的初级生产者及一些无脊椎动物等产生共生作用,使得PUFA/LC-PUFA生物合成途径更加复杂化[39]。有研究报道,在三趾双壳类软体动物(巨型蛤)以及刺胞动物珊瑚虫纲(珊瑚和海葵)和钵水母纲(水母)中会发生脂肪酸易位现象[40]。虫黄藻中的饱和脂肪酸和不饱和脂肪酸会主动转运到宿主体内,且共生产生的脂质可占珊瑚组织干重的46%[41]。因此,珊瑚等多养生物的脂肪酸组成可以反映营养素来源,包括虫黄藻等内源藻类和细菌,而脂肪酸可以作为这些来源的标记[42]。分析PUFA在虫黄藻、珊瑚虫组织和软珊瑚(Sinulariasp.)、硬珊瑚(Acroporasp.)中完整菌落的分布为解析不同部位合成PUFA的生化途径提供了线索[43],结果表明,C18∶3n-6、C18∶4n-3、EPA、C22∶5n-3和DHA主要由虫黄藻合成;C20∶3n-6、ARA和C22∶4n-6由珊瑚虫组织合成;软珊瑚珊瑚虫也能合成24∶5n-6和24∶6n-3。无论有没有虫黄藻,这些四环素多烯脂肪酸都可作为软珊瑚化学分类的标记[44],说明C22 PUFA的生物合成只发生在珊瑚虫体内;虫黄藻还可以合成C16∶2n-7、C16∶3n-4和C16∶4n-1。Imbs等[43]推测,在Sinulariasp.中合成C16∶2n-7和在Acroporasp.中合成C18∶3n-6都经过了Δ6 去饱和酶催化,因此C18∶2n-6、C18∶3n-6和C16∶2n-7在不同虫黄藻和珊瑚虫上的分布相对均匀。珊瑚虫合成了C18∶2n-7,表明C16延长酶在珊瑚中发挥作用。然而在对海葵(Aiptasiapulchella)的研究中发现,使用纯度稳定的同位素(13C)标记溶解无机碳,脂肪酸合成率只与共生腰鞭毛虫体内的脂肪生成途径有关,且共生体派生的同位素标记脂肪酸并未被直接用于宿主PUFA合成[45]。海蜇中脂肪酸组成丰富,并且,其脂肪组成与它们主要捕食对象的脂肪酸组成有关,含有30多种脂肪酸,PUFA含量在36.2%~38.7%之间,其中DHA、EPA和AA含量较高,具有很高的营养与药用价值。
4.3 软体动物
软体动物(Mollusca)作为海洋无脊椎动物中一个大的群体,不仅具有很高的经济价值,而且具有很高的营养价值(能为人类提供“omega-3”),因此,对软体动物中PUFA的生物合成进行了广泛研究[46]。早在1989年就有关于各种软体动物中脂肪酸组成的综述性文章[47],后续的研究证明,软体动物中腹足类和双壳类具有生产内源PUFA的能力[48-49]。一般认为,软体动物具有一定的PUFA生物合成能力,但这种能力因物种不同而存在差异,这主要取决于参与这些代谢反应的去饱和酶和延长酶的酶补充作用。与其他海洋无脊椎动物类似,软体动物也可以内源性合成NMIFA,其生物合成途径已经有详细描述,在大多数软体动物中至少有两个不同的去饱和作用,具有Δ5,9不饱和模式特征的NMI FA[16]。首先,硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturease,SCD)已被证实存在于软体动物中[50],具有Δ9去饱和酶活性,可分别将棕榈油酸(C16∶0)和硬脂酸(C18∶0)转化成棕榈酸(C16∶1n-7或Δ9C16∶1)和油酸(C18∶1n-9或Δ9C18∶1)[20]。其次,去饱和酶需要在Δ5位置加入一个双键才能带有Δ5去饱和活性。在软体动物中广泛分布着具有Δ5、Δ6特异性的脂肪酰基去饱和酶[51]。
LC-PUFA是头足类动物必需的营养物质,尤其在生命周期的早期阶段[52]。Monroig等[53]对头足类动物LC-PUFA合成途径中起关键作用的Fad和Elovl酶基因进行了克隆和功能分析,其cDNA包含三个组氨酸盒(HXXXH、HXXHH和QXXHH)、一个推测的细胞色素b5样结构域和一个类似于脊椎动物去饱和酶“Fads”家族的血红蛋白结合序列(HPGG)。章鱼Fad对饱和、不饱和脂酰基底物均表现出Δ5去饱和酶活性,可分别将酵母内源的C16∶0和C18∶0有效地转化为Δ5去饱和的C16∶1n-11(Δ5-C16∶1)和C18∶1n-13(Δ5-C18∶1),同样也可以转化为Δ5去饱和活性的C18∶1n-13和C20∶1n-15(Δ5-C20∶1)[46]。虽然头足类动物Fad的Δ5样特异性可分别将C20∶4n-3和C20∶3n-6转化为EPA和ARA,但并没有发现具有明显的Δ4、Δ6和Δ8活性,也没有证据显示在头足类动物中有类似于脊椎动物的替代途径[54]。
研究表明,软体动物中仅存在单一Fad基因[53],随着分子生物学技术的发展,越来越多软体动物的全基因组研究计划相继而出,软体动物Fad与Elovl序列数据库也得到不断扩充(表1)。在皱纹盘鲍(Haliotisdiscushannai)、霸王莲花青螺(Lottiagigantea)等基因组中均存在多个编码Fad与Elovl的基因,因此,数据库的扩充将有助于新基因或酶的发掘,且有利于阐明Fad和Elovl的合成代谢机制,充分了解它们在LC-PUFA生物合成中的作用。
4.4 甲壳动物
PUFA合成代谢对水产养殖的生态和经济效益等方面具有重要意义。目前,甲壳动物(Crustacea)中PUFA的相关研究主要集中于甲壳动物(虾蟹等)和浮游动物。研究表明,不同种类甲壳动物中LC-PUFA的生物合成能力存在差异,但与物种的系统发育(类/亚类)或栖息地(淡水/海洋)无显著相关性。例如,桡足类哲水蚤(Harpacticoidcopepods)具有参与PUFA生物合成的去饱和酶和延长酶,能够合成LC-PUFA,可能与其栖息地中取食的食物质量有关。淡水桡足类锯缘真剑水蚤(Eucyclopsserrulatus)在投喂不含DHA的微藻时也有内源产生DHA的能力[1]。虽然桡足类甲壳动物能够内源性合成LC-PUFA,但是合成效率较低[55]。鳃足类蚤状溞(Daphniapulex)暴露于低温时,LC-PUFA含量会显著增加[56]。卤虫可以将带有放射性标记n-6系列脂肪酸LA(C18∶2n-6)转化为n-3系列脂肪酸LNA(C18∶3n-3)[57],由此表明,甲壳动物中存在n-3(或Δ15)去饱和酶。
甲壳动物内源性LC-PUFA的生物合成能力多数是通过间接分析(成分)来证明的,很少有直接的证据(比如生化/分子),因此甲壳动物中LC-PUFA的具体合成途径尚不明确。目前研究发现,在中华绒螯蟹(Eriocheirsinens)、拟穴青蟹(Scyllaparamamosain)和凡纳滨对虾(Litopenaeusvannamei)等甲壳动物中克隆出Fad样基因,但尚没有进行功能分析[18]。这些Fad样基因序列具有去饱和酶的典型结构,包括血红素结合区域(HPGG)和多个跨膜区域的细胞色素b5样结构域以及三个组氨酸盒。其中第三个组氨酸盒的氨基酸序列是HXXHH,而不是通常在去饱和酶中发现的QXXHH。系统发育分析表明,虾蟹类甲壳动物的去饱和酶与其他无脊椎动物(如软体动物和棘皮动物)的去饱和酶在功能特征上具有显著差异,它们形成了一个独立的非功能特征序列群。甲壳动物中Elovl基因具有典型的延长酶基因结构特点,虽然尚未进行功能分析,但是有研究发现饵料可以调节中华绒螯蟹Fad和Elovl表达,在投喂食用植物油(大豆油)含量相对较高的饵料时其表达量增加,类似于脊椎动物对去饱和酶表达的调节反应[58]。具体甲壳动物Fad和Elovl序列见表1。
山东、河北、辽宁等沿海省份是我国海盐主要产地,卤虫卵产量大、营养丰富、脂肪酸含量高,卤虫卵作为水产苗种培育过程中常用且极为重要的饵料,对水产动物的幼体发育、能量储存、体组织脂肪酸组成都有着重要作用。虽然有报道卤虫卵、初孵无节幼体中脂肪酸组成及含量的研究[59],但是卤虫本身PUFA合成能力的研究鲜见报道,有待进一步深入研究。
4.5 棘皮动物
棘皮动物(Echinoderm)PUFA合成的研究处于起步阶段,尤其是PUFA合成中关键性酶功能的研究相对较少。目前已经获得了刺参(Apostichopusjaponicus)、中间球海胆(Strongylocentrotusintermedius)和紫色海胆(Paracentrotuslividus)等棘皮动物的Fad基因序列[18]。Kabeya等[60]从P.lividus中克隆了FadsA、FadsC1和FadsC2三种去饱和酶的cDNA序列,并对它们进行了功能分析,结果表明,它们都具有典型的去饱和酶特征,包括细胞色素b5结构域、血红蛋白结合序列(HPGG)和三个组氨酸盒(HXXXH,HXXHH和QXXHH);尽管具有共同的去饱和酶特征,但系统发育分析显示,海胆和其他棘皮动物都具有特异的序列域。研究证实,FadsA是Δ5 去饱和酶,且在海星(Patiriaminiata)、海蛇尾(Ophiothrixspiculata)和海参(Parastichopusparvimensis)等棘皮动物中也发现了FadsA的同源体;而海星、海蛇尾和海参中检测到的FadsB去饱和酶在海胆中未检测到;系统发育分析表明,棘皮动物FadsB更接近于脊椎动物的Fads样去饱和酶。P.lividus含有丰富的LC-PUFA、EPA和ARA,可通过去饱和反应“Δ8途径”将C18 PUFA的ALA(C18∶3n-3)和LA(C18∶2n-6)转化成EPA(C20∶5n-3)和ARA(C20∶4n-6)[61](图3),因此即使在投喂低含量ARA时,海胆性腺中ARA含量也较高[62]。与软体动物中去饱和酶相似,从P.lividus中发现的FadsA能将C18∶0去饱和化为C18∶1n-13(Δ5C18∶1),但是不能把C16∶0去饱和化为C16∶1n-11(Δ5C16∶1)。另外,在海胆中也存在NMI FA,FadsA在合成NMI FA的过程中起作用[63];在另一种绿海胆(Strongylocentrotusdroebachiensis)中也有NMI FA的生物合成途径[64],即可通过C20∶1n-9(Δ11C20∶1)和C20∶1n-7(Δ13C20∶1)的Δ5去饱和化合成Δ5,11C20∶2和Δ5,13C20∶2。然而,海胆FadsA具有从C20∶3n-3 (20∶3Δ11,14,17)和20∶2n-6(20∶2Δ11,14)合成NMI FAs C20∶4Δ5,11,14,17 和C20∶3Δ5,11,14的能力。尽管克隆了刺参(A.japonicus)、中间球海胆(S.intermedius)等棘皮动物的Elovl基因序列[18],但是其功能却鲜有报道。刺参(A.japonicus)的Elovl5不同于软体动物Elovl2/5,它可以将γ亚麻酸与EPA转化为加2个碳的对应产物[18]。
Wang等[65]对性腺各发育时期(即PUFA蓄积阶段)进行了转录组和代谢组联合分析,共筛选出49个与脂肪酸相关的基因,包括常见的Fads及Elovl等基因,还包括参与脂肪酸合成代谢的Cyp4v2、Fas、乙酰辅酶A酰基转移酶(ACAA2)等基因[66]。通过代谢组分析筛选出一些主要代谢物,如AA、α-亚麻酸、DPA(C22∶5n-3)、EPA、DHA等,并进一步研究了花生四烯酸代谢、α-亚麻酸代谢以及亚油酸代谢通路[65]。其中,DPA作为EPA和DHA的中间产物同样具有调节血脂、软化血管、优化神经、防止癌症和监管脂质的功能,其调节血脂的功能比有“血管清道夫”之称的EPA还要强。
5 展望
饮食(营养调节)和环境因素(包括温度、压力和盐度)会影响海洋无脊椎动物PUFA的合成能力。因此,研究海水养殖物种PUFA合成途径的营养调控具有重要意义。一般来说,增加植物油的摄入量 (缺乏≥C20 PUFA)会促进Fad和Elovl基因上调表达,从而弥补以植物油为基础的饲料中≥C20 PUFA的不足。然而,海洋无脊椎动物PUFA合成代谢是一个复杂的过程,参与调节Fad和Elovl表达的分子机制尚不明确。现有研究表明,海洋无脊椎动物体内含有参与PUFA合成的关键酶,且对内源性PUFA合成起作用,但其分子机制尚不完全清楚。基因组学的迅猛发展、新兴基因编辑技术的不断完善有利于无脊椎动物PUFA合成代谢机理的深入研究,包括关键酶的空间结构、底物识别区域和活性区域、转录后调控机制等,为人们更深入地理解海洋经济无脊椎动物PUFA合成代谢与调控体系、开展海洋经济无脊椎动物的可持续绿色健康养殖等应用研究提供有价值的参考资料。
