聚醚醚酮生物支架制备和短期安全性的研究
2021-11-02钟自玲韩星吴迪瞿申红
钟自玲 韩星 吴迪 瞿申红


摘要:目的:通过3D打印技术制备出聚醚醚酮生物支架,进一步评估支架材料的生物安全性。材料与方法:运用熔融沉积成型工艺打印机打印出聚醚醚酮支架,制备材料浸提液用于体外试验,制备方片用于动物体内试验。结果:溶血试验、热原试验、急性全身毒性试验、肌肉植入试验均证明了聚醚醚酮支架材料符合生物利用吸收的应用要求。结论:3D打印聚醚醚酮支架材料短期内具有良好的生物安全性。
关键词:3D打印技术;聚醚醚酮支架材料;生物学评价;安全性研究。
【中图分类号】G644.5 【文献标识码】A 【文章编号】1673-9026(2021)11-02
前言
耳部缺损修复目前所面临的多种挑战中包括耳廓重建,尽管耳廓只占人体很小比例,但却有着极其复杂的三维结构。多年以来,重建出满意的外耳已经成为广大学者和科研人员共同追求的目标[1]。随着外科技术和生物组织工程技术的发展,生物工程培养软骨成为耳廓重建的可能选择以及临床应用最有希望和潜力的领域。耳廓重建的目标不仅是形成精细的软骨支架,还要尽可能做到耳廓支架不随时间变化[2]。3D技术作为近年来迅猛发展的新技术,已广泛应用于各个行业,在生物医学的发展中也起着重要的作用。
聚醚醚酮(Polyetheretherketone, PEEK)作为一种生物替代材料,由于其与人骨相当的弹性模量、优越的机械性能和优良的生物相容性而受到广泛的欢迎。曾经,PEEK的疏水性和生物惰性限制了其临床应用,其较差的生物活性和骨融合性能导致种植体脱位,最终导致种植体失败 [3-4] 。为了改善PEEK种植体的骨融合,人们做了许多尝试。为研究3D打印技术打印出的PEEK支架是否具有良好的生物相容性,本研究设计了溶血试验和热原试验对支架材料进行评价,以期了解聚醚醚酮生物材料是否具有成功替代人体组织的可能性。
1材料和方法
PEEK材料浸提液的制备 用3D打印机打印出大小为10mm×10mm×1mm的PEEK支架材料的小方片,将方片用双抗加PBS溶液清洗后通过酒精浸泡30min及紫外照射2h后备用。用生理盐水作为浸提介质,按照试样表面积/浸提介质=3cm2-6cm2/mL浸提,37℃ 72h,制得3D打印PEEK支架材料浸提液,4℃保存备用。
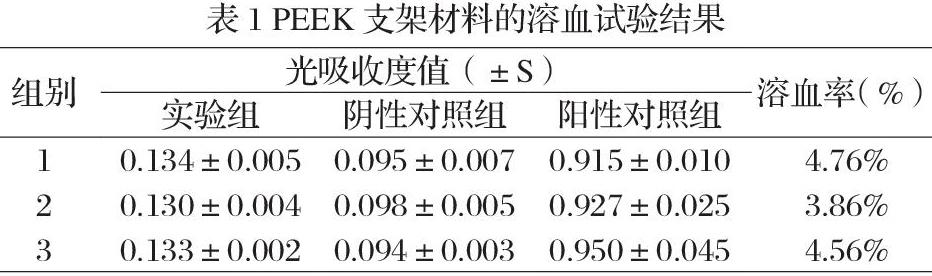
溶血试验 浸提液置37℃恒温水浴箱中保温30min;用抗凝采血管经兔耳中央动脉收集兔血10ml/只,按新鲜抗凝血:生理盐水=4:5的比例制成稀释兔血;设生理盐水为阴性对照,蒸馏水为阳性对照,每试管10mL浸提液/生理盐水/蒸馏水加稀释兔血0.2ml,混匀,在37℃恒温水浴箱中保温60min,2500r/min,离心5min,取上清,用96孔板200μL/孔,在545nm波长测其吸光度。溶血率(%)=(实验组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)×100%,溶血率大于5%为有溶血现象。
热原试验 选取健康家兔6只,普通级,体质量2.0-3.0kg。实验前禁食2h,将电子体温计插入家兔肛门,深度约6cm,时间1min;间隔30min测3次体温,取其平均值为正常值。设0.9%生理盐水为阴性对照。浸提液/生理盐水置于37℃恒温水浴箱中预热后按10ml/kg沿耳缘静脉缓慢注入,注射后每隔1h测量1次体温,共测3次,以3次中体温最高值减去正常体温即为体温升高度数,观察动物体温的动态变化。
急性全身毒性试验 选取昆明系小鼠10只,SPF级,体质量18-25g,随机分成两组,每组5只。按50mL/kg剂量由尾静脉缓慢注入材料浸提液,对照组注射等量生理盐水。观察实验动物注射后一般状态、毒性表现及死亡情况,并记录注射后体重变化。
肌肉植入试验 制备10mm×10mm×1mm大小的聚醚醚酮小方片,经灭菌处理后备用。选健康新西兰白兔3只,雌雄不限,体重为2.Okg-3.0kg之间。腹腔注入10%水合氯醛2m1/kg,麻醉生效后,脱去术区背毛,严格消毒铺敷,在兔脊柱旁1.5cm处做一纵形切口,约1-2cm,钝性分离肌肉组织,深度约为1-2cm,植入聚醚醚酮支架后缝合肌筋膜和皮肤切口。于术后一周切取支架周围0.5-1.Ocm厚肌肉组织,立即置于4%多聚甲醛中固定。将固定好的标本置入包埋盒中,酒精梯度脱水,石蜡包埋,常规组织切片,伊红—苏木精染色(HE)染色,光学显微镜下行组织学观察。
2结果
溶血试验结果 实验中阳性对照组吸光度值为0.931±0.016,阴性对照组吸光度值为0.096±0.002,实验组吸光度值为0.132±0.002,支架材料浸提液的平均溶血率为4.39%,小于5%,即认为PEEK支架材料无溶血反应,符合溶血试验要求。
热原试验结果 耳缘静脉注射实验组材料浸提液及生理盐水后,兔体温未见明显升高。实验组中体温升高值最高为0.4℃,阴性对照组体温升高值最高为0.3℃,小于0.6℃,且体温升高总值小于1.4℃,说明PEEK支架材料浸提液检测合格,没有明显热原物质存在,符合实验要求。
急性全身毒性试验结果 所有实验小鼠均无死亡,活动、进食及大小便均正常,精神状态良好,无惊厥、瘫痪、呼吸抑制等毒性反應。不同观察期动物体重均有一定程度的增加,结果见表3。实验组与对照组对比,二者体重差异无统计学意义。
肌肉植入试验结果 病理切片HE染色结果如图所示,术后一周,镜下见肌肉组织排列整齐,呈现特殊横纹形肌纤维组织,细胞核呈蓝色,肌原纤维间肌质网呈红色或紫红色,炎症反应分级:0级。肌肉周围纤维包膜无明显炎症反应,无液化、肥大等病理反应,无脓肿形成。
3讨论
最近,使用融合沉积建模(FDM)技术制造PEEK支架已被描述,它具有许多优点,如材料损耗少、成本效益高、易于操作人员培训、更快的植入物生产和提高患者特异性[5]。在生物医学应用中使用PEEK的一个主要问题是缺乏生物相容性和生物活性[6-8]。Feng等的死/活染色研究显示,大量绿色染色的活细胞和少量红色染色的死细胞存在于支架表面,所有测试的PEEK支架都具有生物相容性[9]。Gu等[10]通过建立兔眼眶缺损模型,将PEEK植入物实验组与空白对照组对比,发现PEEK植入后无感染和排斥反应发生,生物相容性良好。术后实验组血管内皮生长因子(VEGF)蛋白相对表达量显著高于对照组(P<0.05)。实验组骨缺损修复效果明显优于同期对照组,并有一定的成骨效果。
耳廓由皮膚血管及内部的耳廓软骨构成,用PEEK材料制作的完整耳廓硬度明显高于正常组织。因此,由于实心的生物支架往往与正常组织差异较大且不符合生物体原本组织结构的力学性能,目前的研究已经报道了几种制备表面多孔PEEK支架的方法。Yuan等[11]采用化学方法(酸磺化处理和模拟流体培养的仿生矿化)建立多孔PEEK支架,其骨融合和力学稳定性优于致密PEEK支架。Evans等[12]通过物理方法(熔体挤压和盐浸)制备了表面多孔的PEEK支架,增强了大鼠股骨缺损模型的骨融合。然而,这些传统技术无法精确控制孔隙大小、孔隙率或支架的连通性。此外,残留杂质或死区问题也已被注意到[13]。因此,孔隙结构对多孔PEEK支架力学性能和生物性能的影响仍有待进一步研究。
就单纯PEEK材料缺乏生物活性的问题,已经制定了一些策略来解决这一限制。羟基磷灰石(HA)-聚醚醚酮(PEEK)复合材料的制备β-磷酸三钙(β-TCP)已被证明可以增强生物活性[14,15]。Zhu和他的同事等[7] 开发了一种简单的浸泡方法来生成生物相容性和生物活性的PEEK,从而诱导骨分化。他们的研究发现,与PEEK对照相比,改性PEEK在体外显示出了显著改善细胞增殖、成骨分化和骨样磷灰石形成的能力。在耳廓重建中是否有着同样的问题和效果尚需更深入的研究。
4结论
溶血试验和热原试验是国际标准化组织规定的生物材料应用于生物体必须通过的实验研究,通过对PEEK材料的体内体外实验,我们验证了其具有良好的生物相容性,可用于进一步的组织工程学研究。但由于其硬度与正常耳廓相差较大,有必要对其力学性能进行改进,通过改变表面特性、增加孔隙、添加复合物等手段使PEEK材料更接近正常耳廓,具体设计方案尚需进一步探索。
参考文献:
[1] Sinwar PD. Auricle injury due to human bite - A rare case report and review literature. Int J Surg Case Rep 2015; 6c: 5-7.
[2] Han SE, Lim SY, Pyon JK, Bang SI, Mun GH, Oh KS. Aesthetic auricular reconstruction with autologous rib cartilage grafts in adult microtia patients. J Plast Reconstr Aesthet Surg 2015; 68(8): 1085-94.
[3] Wang S, Yang Y, Li Y, et al. Strontium/adiponectin co-decoration modulates the osteogenic activity of nano-morphologic polyetheretherketone implant. Colloids Surf B Biointerfaces 2019; 176: 38-46.
[4] Phan K, Hogan JA, Assem Y, Mobbs RJ. PEEK-Halo effect in interbody fusion. J Clin Neurosci 2016; 24: 138-40.
[5] Zhao F, Li D, Jin Z. Preliminary Investigation of Poly-Ether-Ether-Ketone Based on Fused Deposition Modeling for Medical Applications. Materials (Basel, Switzerland) 2018; 11(2).
[6] Zhang J, Tian W, Chen J, Yu J, Zhang J, Chen J. The application of polyetheretherketone (PEEK) implants in cranioplasty. Brain Res Bull 2019; 153: 143-9.
[7] Zhu Y, Cao Z, Peng Y, Hu L, Guney T, Tang B. Facile Surface Modification Method for Synergistically Enhancing the Biocompatibility and Bioactivity of Poly(ether ether ketone) That Induced Osteodifferentiation. ACS Appl Mater Interfaces 2019; 11(31): 27503-11.
[8] Lu T, Wen J, Qian S, et al. Enhanced osteointegration on tantalum-implanted polyetheretherketone surface with bone-like elastic modulus. Biomaterials 2015; 51: 173-83.
[9] Feng X, Ma L, Liang H, et al. Osteointegration of 3D-printed fully porous polyetheretherketone scaffolds with different pore sizes. ACS omega 2020; 5(41): 26655-66.
[10] Gu RD, Xiao F, Wang L, Sun KJ, Chen LL. Biocompatibility of polyetheretherketone for the treatment of orbital bone defects. International journal of ophthalmology 2020; 13(5): 725-30.
[11] Yuan B, Cheng Q, Zhao R, et al. Comparison of osteointegration property between PEKK and PEEK: Effects of surface structure and chemistry. Biomaterials 2018; 170: 116-26.
[12] Evans NT, Torstrick FB, Lee CS, et al. High-strength, surface-porous polyether-ether-ketone for load-bearing orthopedic implants. Acta Biomater 2015; 13: 159-67.
[13] Li F, Li J, Xu G, Liu G, Kou H, Zhou L. Fabrication, pore structure and compressive behavior of anisotropic porous titanium for human trabecular bone implant applications. J Mech Behav Biomed Mater 2015; 46: 104-14.
[14] Kokubo T, Kim HM, Kawashita M. Novel bioactive materials with different mechanical properties. Biomaterials 2003; 24(13): 2161-75.
[15] Kane RJ, Converse GL, Roeder RK. Effects of the reinforcement morphology on the fatigue properties of hydroxyapatite reinforced polymers. J Mech Behav Biomed Mater 2008; 1(3): 261-8.
基金资助:2018年广西科技计划项目重点研发计划(桂科AB1850010);2018年广西医療卫生适宜技术开发与推广应用项目(S2018039);广西研究生教育创新计划项目(YCSW2021215)
作者简介:*瞿申红,主任医师,博士生导师。研究方向:3D打印在耳鼻咽喉头颈外科中的应用研究。邮箱:2510243342@qq.com
