三氯乙醇和三氯乙酸在诱发三氯乙烯药疹样皮炎中的作用
2021-11-02伊梦楠臧丹易娟刘帅周伟王俊程沈美丽王婷段化伟黄先青戴宇飞
伊梦楠,臧丹,2,易娟,刘帅,周伟,王俊程,沈美丽,王婷,段化伟,黄先青,戴宇飞
1.中国疾病预防控制中心,职业卫生与中毒控制所/化学污染物与健康重点实验室,北京 100050
2.北京市丰台区市场监督管理局,北京 100050
3.深圳市职业病防治院,广东 深圳 510000
三氯乙烯是一种无色易挥发的有机溶剂,具有良好的去污、脱脂能力,主要用于去除金属部件的杂质以及织物清洁和染色等各种工艺中。鉴于其溶剂特性,三氯乙烯可以通过吸入和皮肤接触进入人体[1]。流行病学调查显示职业暴露于三氯乙烯是导致职业性三氯乙烯药疹样皮炎(trichloroethylene-induced hypersensitive dermatitis,TIHD)发生的直接原因[2],职业性三氯乙烯暴露后2 周至2 个月出现四肢、面部、颈部或躯干皮疹,伴有不同程度的发烧、淋巴结肿大等[3]。机体暴露于三氯乙烯后,三氯乙烯经由肝脏细胞色素P450氧化代谢等通路生成的代谢产物为三氯乙醛和水合氯醛,后经由醇脱氢酶和醛脱氢酶催化生成三氯乙醇和三氯乙酸[4];而水合氯醛在机体内能够被乙醇脱氢酶迅速代谢为三氯乙酸和三氯乙醇,导致水合氯醛在血液和尿液中含量均较低。研究证实三氯乙醇是机体内三氯乙烯和水合氯醛的主要代谢产物[5];三氯乙酸也被认为是引起肝损伤的三氯乙烯主要代谢产物[4]。目前国内外针对三氯乙烯代谢产物三氯乙酸和三氯乙醇是否参与TIHD的发病过程存在争议[5],因此本研究拟分为两部分,第一部分为体外细胞实验:受试物为三氯乙酸和三氯乙醇,体外实验选取人髓系白血病单核细胞株(THP-1),检测三氯乙烯代谢产物对炎症因子白细胞介素-8(interleukin-8,IL-8)和一氧化氮(nitric oxide,NO)合成过程中重要的限速酶诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的影响。第二部分为人群研究:检测三氯乙酸和三氯乙醇对TIHD患者外周血单个核细胞增殖能力的影响,从代谢角度解析三氯乙烯诱发致敏反应起始阶段的关键分子。
1 对象与方法
1.1 主要试剂及仪器
三氯乙酸、三氯乙醇、DMSO(Sigma,美国);RPMI 1640培养基、胎牛血清、青霉素-链霉素(Gibco,美国);兔抗人 iNOS 多克隆抗体(Abcam,英国);山羊抗兔抗体(北京中杉金桥试剂,中国);高效化学发光试剂盒(Santa Cruz,美国);DC 蛋白测定试剂盒、酶标仪(Bio-Rad,美国);异丙醇、甲醇、电泳液、电转液等试剂均为国产试剂。
1.2 体外细胞实验
1.2.1 细胞培养THP-1细胞株购买于中国医学科学院基础医学院细胞中心。配制含有10%~15%(体积分数,后均相同)胎牛血清和1%青霉素-链霉素的完全培养基,于37℃、5% CO2培养箱中培养THP-1 细胞,每隔24 h 观察细胞形态。待细胞数量达到显微镜视野下80%左右时,进行细胞传代。
1.2.2 THP-1 细胞存活率的检测用CCK-8 法检测各处理组中细胞相对存活率。调整THP-1 细胞密度为2×105个·mL-1,将2×104个THP-1 细胞接种于96 孔板内,并设置至少3 个平行孔,设置空白组、对照组及染毒组,于37℃、5% CO2培养箱中培养44 h。每孔加入10 μL CCK-8,继续培养4 h。设置酶标仪波长为450 nm检测每孔光密度(D)值,按照公式:细胞相对存活率=(D染毒组-D空白组)/(D对照组-D空白组)×100%,计算不同浓度三氯乙酸和三氯乙醇对细胞存活率的影响。
1.2.3 THP-1 细胞IL-8 表达的检测用完全培养基调整细胞密度为5×105个·mL-1,取2 mL 细胞悬液接种于6 孔板中;根据文献[6]报道和细胞对化学物的敏感性设置三氯乙酸和三氯乙醇的染毒剂量均为:0、0.5、1.0、2.0、4.0 mmol·L-1,各浓度组均设置3 个平行孔,培养48 h 后,分离细胞上清和细胞。利用细胞上清液检测IL-8 表达水平,利用细胞提取全蛋白进行Western blotting检测。
1.2.4 THP-1 细胞内iNOS 表达的检测每个染毒处理组细胞用2 mL PBS 清洗3 遍后,加入250 μL 的RIPA裂解液,涡旋混匀,冰上充分裂解2 h,14 000×g离心15 min 后取上清为全蛋白。每组蛋白定量吸取35 μg,并与5×上样缓冲液按照4∶1 的比例混匀,配制上样体系体积为20 μL,100℃水浴加热10 min。配制10%的凝胶,加入5 μL 的蛋白marker 和10 μL 的各处理组蛋白,60 V 电泳1 h 后转为90~110 V 继续电泳1~2 h;250 mA转膜2.5 h。转膜完成后,PVDF膜浸泡于10~15 mL 1×TBST 中摇床漂洗10 min×3 次;用5%脱脂奶粉溶液浸泡PVDF 膜,室温封闭1 h;稀释比为1∶500的iNOS抗体4℃冰箱孵育过夜或超过12 h。漂洗PVDF 膜10 min×3 次。以1∶5 000 比例稀释二抗,室温孵育1 h后,水平摇床漂洗PVDF 膜10 min×3 次。加入化学发光试剂曝光后,以β-actin为内参,采用Image pro plus 6.0软件进行灰度分析。
1.3 TIHD患者研究
1.3.1 研究对象选择标准研究对象共57人,分为4组。非接触对照组:20人,选择深圳职业病防治院体检科上岗前健康体检结果处于正常范围的职业工人,均未接触过三氯乙烯,排除职业性有机溶剂接触史及药物食物过敏史;接触对照组:20人,选择与病例同车间同工种接触三氯乙烯但未发病的健康工人,排除药物食物过敏史;病例组:共17 人,选择2008—2010年在深圳市职业病防治院进行治疗的TIHD 患者,均为按照GBZ 185—2006《职业性三氯乙烯药疹样皮炎诊断标准》临床确诊的病例,有明确三氯乙烯接触史,接触时间不超过3 个月,平均约30 d,排除其他药物食物过敏史,发病前2 周均无药物服用史;其中10 人正在接受治疗,为入院病例组,另7人激素用量减至每天2 mg或停用,血常规和肝功能检查未发现异常,身体各项机能均基本恢复,为出院病例组。所有研究对象经过详细的人口学调查以及职业病接触史、既往疾病史、家族遗传病史等资料收集,均排除糖尿病、哮喘、过敏性皮炎、系统性红斑狼疮、类风湿关节炎、特应性皮炎、遗传性过敏性疾病等免疫系统相关疾病以及其他类似的职业有害因素接触史和药物食物过敏史。本研究已经中国疾病预防控制中心职业卫生与中毒控制所医学伦理委员会审查批准(批准号:无)。
1.3.2 研究对象外周血单个核细胞存活率的测定采集所有被纳入人员晨起空腹肘静脉血5 mL,1∶1 加入淋巴细胞分离液,800×g离心20 min 后,小心吸取淋巴细胞层,加入2 倍体积的PBS 混匀,300×g离心10 min 后,收集沉淀即为外周血单个核细胞,用含有10%胎牛血清和1%双抗的完全培养液稀释细胞,调节各组细胞浓度为1×106个·mL-1接种于96 孔板,加入0.5 mmol·L-1和2 mmol·L-1的三氯乙酸和三氯乙醇后,置于37℃、5% CO2培养箱中培养44 h,检测细胞存活率,方法同“1.2.2”。
1.4 统计学分析
IL-8 数据不符合正态分布和方差齐性,采用完全随机化设计的多组独立样本的秩和检验(Kruskal-Wallis 法)进行比较,数据采用M(Min,Max)表示。其他符合正态分布和方差齐性的指标,采用方差分析比较,组间比较采用LSD 法,数据采用±s表示。所有统计检验均为双侧检验,检验水准α=0.05。
2 结果
2.1 THP-1细胞实验结果
2.1.1 THP-1 细胞相对存活率和IL-8 的表达水平与对照组相比,0.5 mmol·L-1三氯乙酸和三氯乙醇组细胞存活率略有增加,但差异无统计学意义(P>0.05);1.0 mmol·L-1及以上剂量组,随着三氯乙酸和三氯乙醇浓度的增加,细胞存活率逐渐降低;IL-8 表达水平逐渐增多,表现为剂量依赖性(均P<0.05)。见表1。
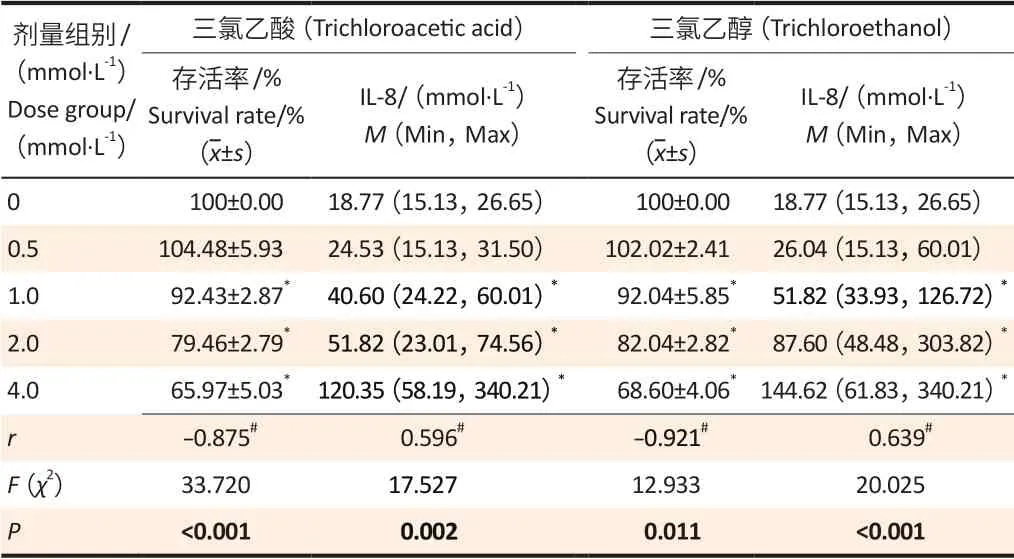
表1 不同浓度三氯乙酸和三氯乙醇对细胞存活率和IL-8的影响(n=3)Table 1 Effects of different concentrations of trichloroacetic acid and trichloroethanol on cell survival rates and IL-8 (n=3)
2.1.2 THP-1 细胞iNOS 的表达水平与对照组相比,0.5 mmol·L-1三氯乙酸和三氯乙醇组iNOS 表达量差异无统计学意义(P>0.05);随着染毒浓度增高,1.0、2.0、4.0 mmol·L-1三氯乙酸组iNOS 的表达水平分别增高93.73%、87.08%、238.06%(P<0.05),1.0、2.0、4.0 mmol·L-1三氯乙醇组iNOS 的表达水平分别增高95.99%、486.29%、735.72%(P<0.05);但1.0 mmol·L-1和2.0 mmol·L-1三氯乙酸两个处理组之间iNOS 表达水平差异无统计学意义 (P>0.05)。见图1。
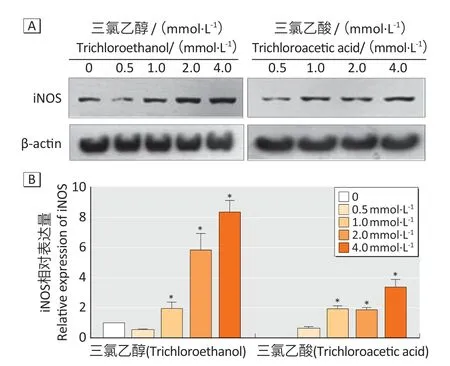
图1 不同浓度受试物对THP-1 细胞iNOS表达水平的影响Figure 1 Effects of different concentrations of trichloroacetic acid and trichloroethanol on iNOS expression in THP-1 cells
2.2 职业接触人群的研究结果
2.2.1 研究对象一般情况各组研究对象基本情况见表2。其中,非接触对照组均无三氯乙烯接触史,接触对照组平均接触工龄为(466.09±280.65)d,入院病例组和出院病例组的平均接触工龄分别为(32.00±19.81)、(29.17±10.82)d。
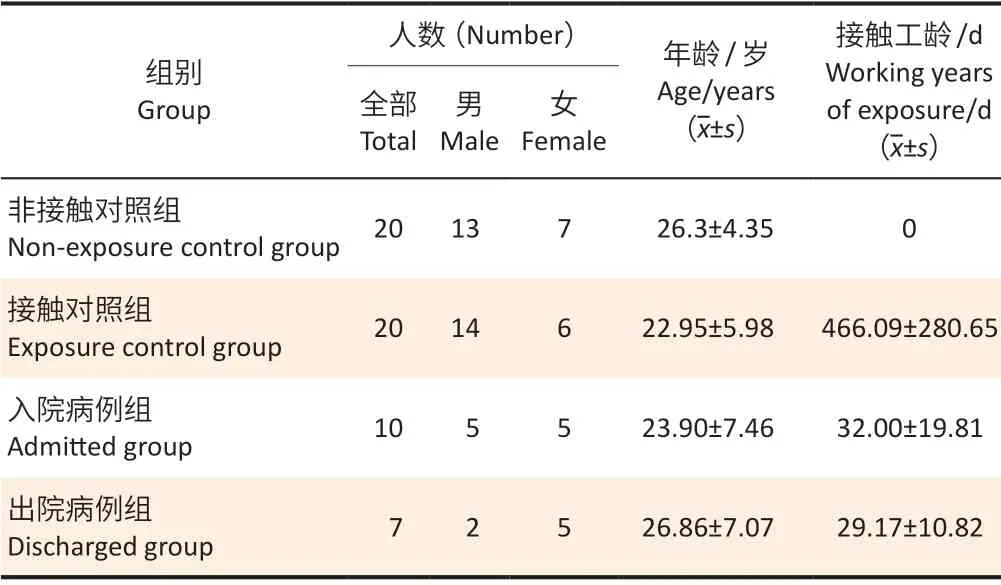
表2 2008—2010年深圳市职业病防治院研究对象基本资料Table 2 General information of participants from Shenzhen Preventive and Treatment Center for Occupational Diseases in 2008—2010
2.2.2 研究对象外周血单个核细胞增殖能力的变化各组人群外周血单个核细胞在加入不同浓度三氯乙酸和三氯乙醇处理后,与未染毒细胞相比,各组细胞存活率均降低(P<0.05)。与非接触对照组相比,0.5、2.0 mmol·L-1三氯乙酸处理细胞后,出院病例组细胞存活率分别增加5.81%和5.64%(P<0.05);而接触对照组、入院病例组的细胞存活率差异无统计学意义(P>0.05)。4 组人群外周血单个核细胞经0.5、2.0 mmol·L-1三氯乙醇处理后的细胞存活率差异无统计学意义(P>0.05)。见表3。
表3 不同浓度三氯乙酸和三氯乙醇对外周血单个核细胞存活率的影响(±s)Table 3 Effects of different concentrations of trichloroacetic acid and trichloroethanol on survival rate of peripheral blood mononuclear cells (±s)单位(Unit):%
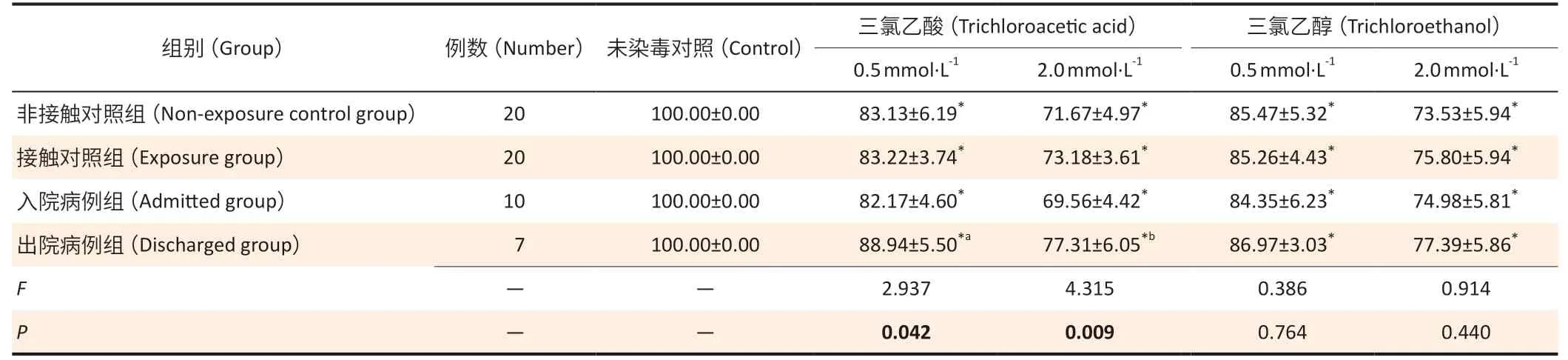
表3 不同浓度三氯乙酸和三氯乙醇对外周血单个核细胞存活率的影响(±s)Table 3 Effects of different concentrations of trichloroacetic acid and trichloroethanol on survival rate of peripheral blood mononuclear cells (±s)单位(Unit):%
[注]*:与未染毒对照相比,P<0.05;a:与非接触对照组相比,P=0.012;b:与非接触对照组相比,P=0.007。[Note]*:Compared with the control group,P<0.05;a:Compared with the non-exposure control group,P=0.012;b:Compared with the non-exposure control group,P=0.007.
三氯乙酸(Trichloroacetic acid) 三氯乙醇(Trichloroethanol)0.5 mmol·L-1 2.0 mmol·L-1 0.5 mmol·L-1 2.0 mmol·L-1非接触对照组(Non-exposure control group) 20 100.00±0.00 83.13±6.19* 71.67±4.97* 85.47±5.32* 73.53±5.94*接触对照组(Exposure group) 20 100.00±0.00 83.22±3.74* 73.18±3.61* 85.26±4.43* 75.80±5.94*入院病例组(Admitted group) 10 100.00±0.00 82.17±4.60* 69.56±4.42* 84.35±6.23* 74.98±5.81*出院病例组(Discharged group) 7 100.00±0.00 88.94±5.50*a 77.31±6.05*b 86.97±3.03* 77.39±5.86*F——2.937 4.315 0.386 0.914 P——0.042 0.009 0.764 0.440组别(Group) 例数(Number) 未染毒对照(Control)
3 讨论
大量研究表明,职业接触三氯乙烯是引起TIHD发生的直接原因[3]。根据三氯乙烯引起的超敏反应的特征及发病机制,将其划分为IV 型超敏反应即迟发型超敏反应,该反应是由效应T 淋巴细胞与抗原作用后引起单个核细胞浸润和组织损伤,并且伴有严重的炎症反应[6]。由于三氯乙烯进入机体后产生多种代谢产物例如水合氯醛、三氯乙酸、三氯乙醇等,因此三氯乙烯是否需经过代谢以后才具体致敏作用一直存在争议,有研究指出三氯乙烯及其代谢产物三氯乙酸和三氯乙醇可能均是引起TIHD 的致敏原[7-8]。本次研究结果表明:三氯乙酸在TIHD 发病过程中,发挥其致敏能力;但三氯乙醇是否在TIHD 发病过程中发挥其致敏能力尚无证据。
多数具有致敏性的化学物能够促进THP-1 细胞分泌细胞因子,例如IL-8、IL-1β、肿瘤坏死因子-α 等,因而THP-1 细胞株被广泛应用于验证、检测小分子化学物的致敏性[9],并且在致敏性化学物的作用下THP-1细胞IL-8 的表达水平增加,因此IL-8 被认为是THP-1细胞体外验证化学物致敏能力的重要筛查指标[9-10]。此外,机体在致敏原的诱导下可以促进iNOS 的表达,在iNOS 的催化作用下促进机体内释放大量的NO,参与炎症过程,对机体造成损伤[10-11]。iNOS 作为NO 合成过程中重要的限速酶,影响NO 的产生,在一定程度上同样可以作为化学物致敏能力的筛查指标。本研究结果表明:随着三氯乙酸、三氯乙醇浓度增加,IL-8 表达水平增加,并且THP-1 细胞iNOS 表达水平增加,该趋势与IL-8 变化趋势一致(P<0.05)。上述体外实验结果初步证明了三氯乙酸和三氯乙醇均具有致敏能力。
三氯乙烯致敏主要包括两个过程:诱导过程和激发过程[12]。诱导过程中,化学物或其活性代谢物与内源性肽相互作用形成复合物,即形成具有免疫原性的完全抗原。完全抗原在机体内能够被抗原呈递细胞识别加工,进而促进T 淋巴细胞的增殖分化,使得机体内记忆T 淋巴细胞大量增加;激发过程中,当机体再次接触相同的抗原时,记忆T 淋巴细胞活化为效应T 淋巴细胞,引起机体免疫应答[13-14]。目前,利用抗原特异性T 淋巴细胞特点检测外源性化学物具有免疫原性的方法包括淋巴细胞转化实验和皮肤斑贴实验[15]。为验证三氯乙酸和三氯乙醇是否在TIHD 过程中发挥其致敏作用,本研究采取淋巴细胞转化实验检测三氯乙酸和三氯乙醇对三氯乙烯职业暴露人群和非暴露人群外周血T 淋巴细胞的增殖能力的影响。结果发现:相对于非接触对照组,出院病例组,分离其外周血单个核细胞与三氯乙酸共培养,细胞存活率上升,提示患者体内可能存在三氯乙酸抗原特异性的T淋巴细胞,当这类细胞再次接触特异性半抗原三氯乙酸时,T 细胞发生增殖;而入院治疗组细胞存活率无明显变化,可能是因为患者入院后,治疗TIHD 的药物(如糖皮质激素)对机体的免疫应答具有一定的抑制作用;当患者出院后激素停用,药物对机体的免疫抑制作用减弱,因此特异性抗原的促增殖效应能够被检测出来。
此外,Huang等[16]采用皮肤斑贴试验对致敏原进行了检测,发现19例TIHD康复病例中,对0.05%、0.5%和5.0%三氯乙醇斑贴呈阳性的比率分别为52.6%、73.7%、89.5%;5.0%三氯乙酸阳性率为47.4%,0.5%三氯乙酸斑贴试验均为阴性;Watanabe 等[5]发现三氯乙醇、三氯乙酸均能引起TIHD 患者皮肤斑贴试验阳性。结合本研究的淋巴细胞转化实验和文献报道的斑贴试验结果,可以认为三氯乙酸是参与TIHD 的发病过程的致敏原之一;而本研究结果尚无法确定三氯乙醇是否参与TIHD 的发病。导致研究结果差异性的原因可能是由于淋巴细胞转化实验所使用的淋巴细胞与斑贴试验中皮肤角质细胞的敏感性差异、受试物浓度差异等多种因素引起。为进一步验证试验结果的准确性,后续需扩大样本量,增设化学物的干预剂量和干预时间,进一步验证三氯乙醇、三氯乙酸以及其他代谢产物在TIHD 发病过程中的作用。
