血清肌酐与胱抑素C比值在糖代谢异常中的临床意义
2021-11-01李少博于浩泳肖云峰包玉倩韩峻峰
杨 迪 李少博 于浩泳 肖云峰 陆 靖 顾 耕 包玉倩 韩峻峰
中国人群2型糖尿病的患病率已达11.2%[1],且有36.5%的人群未能及时确诊为糖尿病[2]。一项调查研究[1]结果显示,截至2017年,超重或肥胖人群糖尿病患病率分别增加13.8%和20.1%。故探索2型糖尿病高风险人群的早期预警指标具有重要临床意义。
低肌肉量或腹部脂肪过度累积是2型糖尿病发生的重要危险因素[3-5]。2型糖尿病患病人群体型差异较大,骨骼肌肉量或内脏脂肪面积的绝对值难以有效评估该人群的患病风险程度。Wang等[6]在一项横断面研究中证实,骨骼肌肉量与腹内脂肪面积(visceral fat area,VFA)比值是2型糖尿病和代谢综合征发生的独立危险因素。因此,明确骨骼肌肉量与VFA的关系可有助于早期筛查2型糖尿病高风险人群;但由于需要MRI、CT等检查设备及专业技术人员,该方法难以作为临床常规筛查手段[7]。Osaka等[8]的研究证实了血清肌酐与胱抑素C比值(serum creatinine to cystatin C ratio,CCR)作为衡量相对肌肉量标志物的有效性。同时,内脏脂肪累积可增加胱抑素C的表达和分泌,致使肥胖个体胱抑素C水平明显升高[9]。故CCR可能同时反应骨骼肌肉量与脂肪含量。然而,目前鲜见有关CCR与糖代谢异常(2型糖尿病及糖尿病前期)关联的临床研究证据。本研究根据CCR三分位值将受试者进行分组,研究CCR与糖代谢异常发生的风险关系,评估该指标早期筛查2型糖尿病的潜在临床价值。
1 对象与方法
1.1 研究对象 采用横断面调查研究方法收集2019年5月—2020年9月在上海交通大学附属第六人民医院内分泌科初诊为血糖异常的104例患者资料,同期收集122名血糖正常志愿者的资料。其中男78例、女148例,年龄为(31.83±9.21)岁,BMI为(26.91±15.00) kg/m2。血糖异常患者纳入标准:年龄>18岁,资料完整。排除标准:①肾功能不全[血清肌酐>105 μmol/ L或肾小球滤过率(GFR)<60 mL/min]或已接受肾脏替代治疗;②有其他器质性疾病、1型糖尿病或特殊类型糖尿病病史;③缺少重要的研究数据,如年龄、性别、血清肌酐值和胱抑素C水平等;④近3个月服用过糖皮质激素类药物;⑤妊娠或正在使用免疫抑制剂等特殊药物。纳入或排除信息来自病史资料和检查前询问。本研究经医院伦理委员会审核、批准(审批号:2020-070),受试者均已签署知情同意书。
1.2 研究方法与观察指标 所有受试者均接受全面的体格检查和血清学指标检测。体格检查内容包括身高、体重、腰围等。身高精确到0.1 cm;体重精确到0.1 kg;腰围测量方法为两侧腋中线肋弓下缘和髂嵴连线的中点绕腹1周,测量值精确到0.1 cm。血清学指标检测方法:隔夜禁食时间>8 h,从受试者肘前静脉抽取血液样本。室温静置30 min后,4 000 r/min(离心半径为18.87 cm)离心5 min,收集上清液。应用全自动生化分析仪器(美国贝克曼库尔特有限公司)检测血糖、血清脂质、肾功能等;采用电化学发光免疫分析法检测空腹胰岛素和C肽水平;采用免疫比浊法检测胱抑素C水平(参考范围0.40~1.10 mg /L);采用肌氨酸氧化酶法检测血清肌酐水平(参考范围为53.00~115.00 μmol/L)。CCR按照以下公式计算:CCR=血清肌酐/胱抑素C。考虑到既往研究[11]结果发现CCR存在男女性别差异,故根据性别将受试者进行三分位数分组,即CCR低分位数组(男性51.67~80.00、女性43.75~70.00,75例)、中分位数组(男性>80.00~105.00、女性71.43~97.14,75例)、高分位数组(男性105.71~170.00、女性98.00~167.50,76例)。
1.3 诊断标准 糖代谢异常包括糖尿病前期和2型糖尿病。糖尿病前期参照美国糖尿病协会(ADA)的诊断标准[10]:FBG异常(6.1≤FBG<7.0 mmol/L)和糖耐量异常(7.8≤餐后血糖<11.1 mmol/L)。2型糖尿病参照《中国2型糖尿病防治指南(2020年版)》的诊断标准[11]:出现典型糖尿病症状(烦渴多饮、多尿、多食、不明原因体重下降);随机血糖≥11.1 mmol/L,或FBG≥7.0 mmol/L,或口服葡萄糖耐量试验(OGTT)结果显示餐后2 h血糖≥11.1 mmol/L,或HbA1c≥6.5%。超重及肥胖参照2011年《中国成人肥胖症防治专家共识》的诊断标准[12]:BMI<18.5 kg/m2为低体重,18.5 kg/m2~<24.0 kg/m2为正常体重,24.0 kg/m2~<28.0 kg/m2为超重,≥28.0 kg/m2为肥胖。
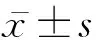
2 结 果
2.1 受试者一般资料 在受试者中,CCR低分位数组血糖异常患者所占比例为68.00%(51/75),显著高于中分位数组的52.00%(39/75)和高分位数组的18.42%(14/76,χ2=41.574,P<0.001)。CCR低、中、高分位数组受试者的BMI、腰围、FBG、餐后2 h血糖、HbA1c、空腹C肽、稳态模型评估法胰岛素抵抗指数(HOMA-IR)、空腹胰岛素、胱抑素C、TG水平依次降低,而HDL-C和血清肌酐水平依次增高;3组间上述指标的差异均有统计学意义(P值分别<0.05,0.01)。3组间的年龄、血尿素氮、估算的肾小球滤过率(eGFR)、稳态模型评估法胰岛β细胞功能指数(HOMA-β)、TC、LDL-C的差异均无统计学意义(P值均>0.05)。见表1。
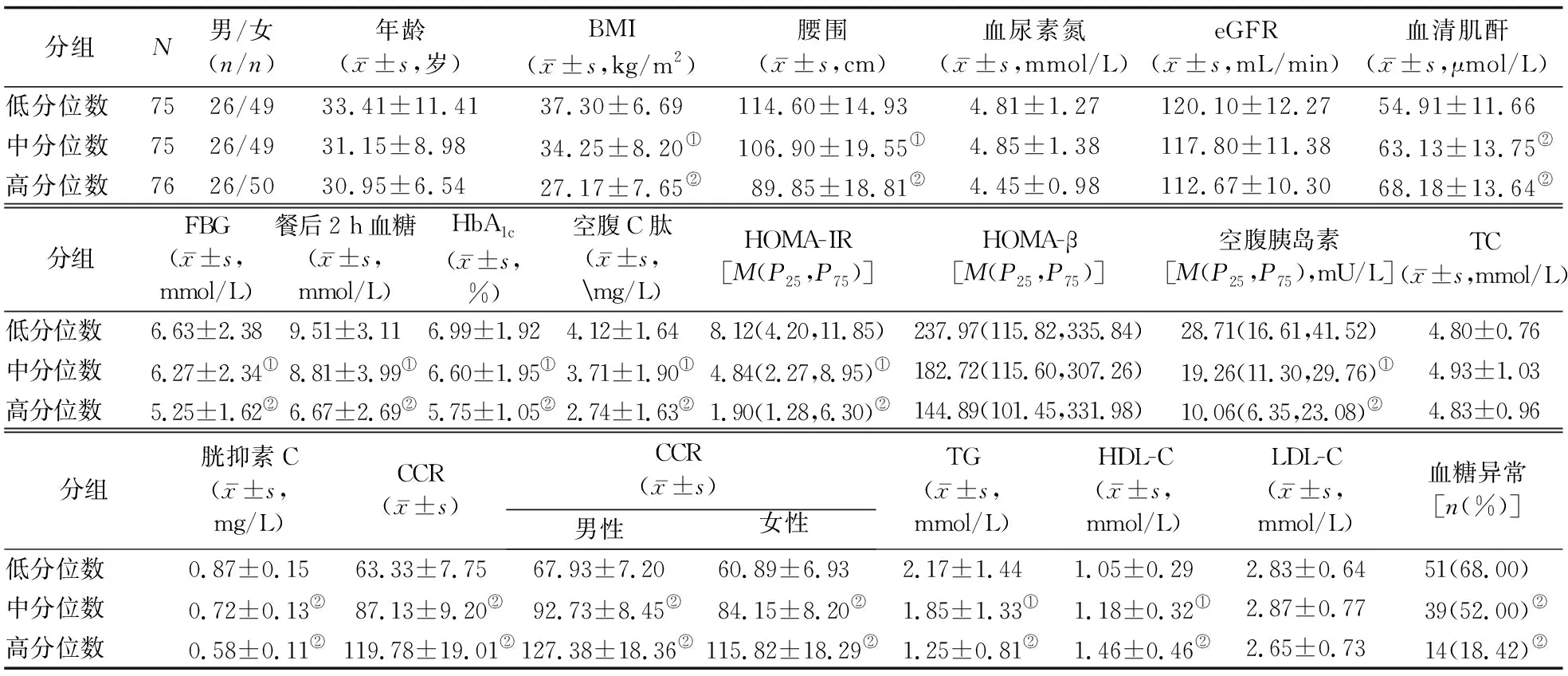
表1 受试者一般资料比较
2.2 CCR与影响糖代谢异常指标的相关性分析 男性组和女性组相关性分析结果均显示:CCR与BMI、腰围、FBG、餐后2 h血糖、HbA1c、空腹C肽、空腹胰岛素水平、HOMA-IR、TG呈显著负相关,与HDL-C呈显著正相关(P值均<0.001);与年龄、TC、LDL-C、HOMA-β无显著相关性(P值均>0.05)。见表2。
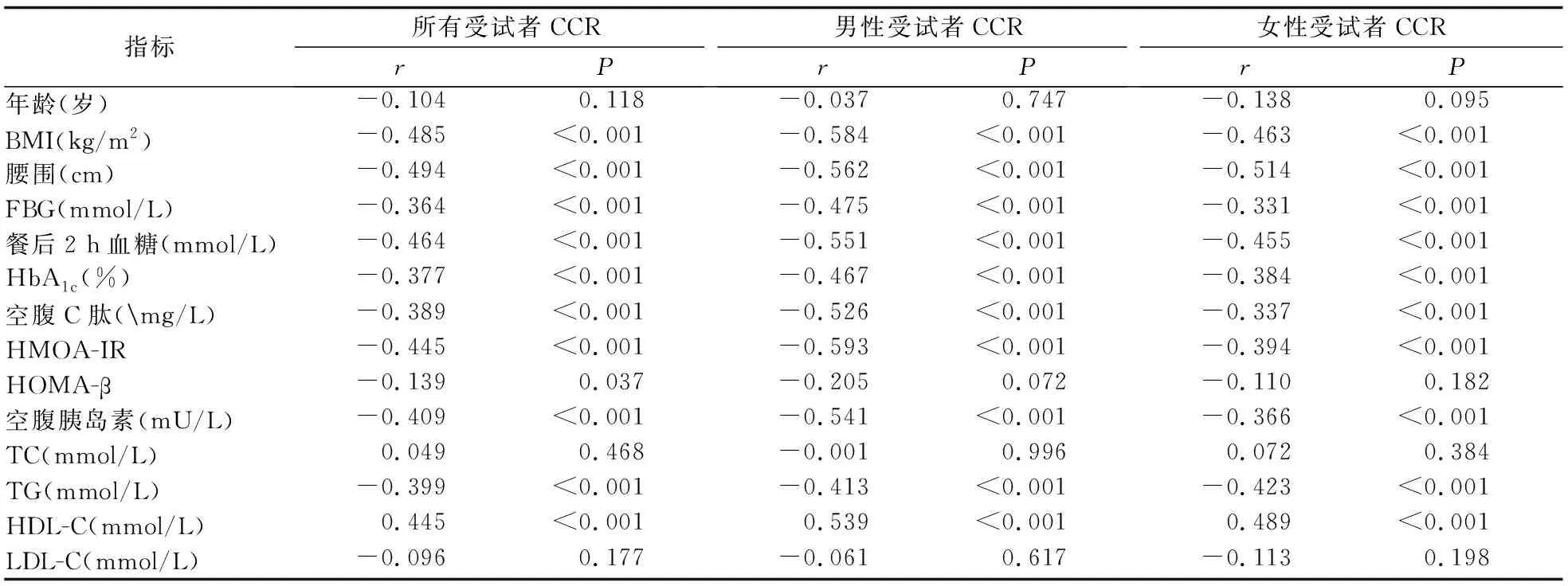
表2 CCR与影响糖代谢异常指标的相关性分析
2.3 CCR预测糖代谢异常发生风险价值 以是否发生糖代谢异常为因变量,CCR三分位数值为自变量,调整上述相关分析有统计学意义的因素,进行二元logistic回归分析。以CCR高分位数组作为参照。模型1中,中分位数组发生糖代谢异常的OR值为4.312 (95%CI为2.066~8.999),低分位数组OR值为10.012(95%CI为4.684~21.404)。模型3分别校正性别、年龄、BMI、腰围、HOMA-IR后,中分位数组OR值为2.837 (95%CI为1.157~3.041),低分位数组OR值为3.965 (95%CI为1.506~10.439)。表明CCR低值是糖代谢异常发生的重要独立危险因素。CCR高值,糖代谢异常发生率降低的趋势显著(Ptrend<0.001)。见表3。
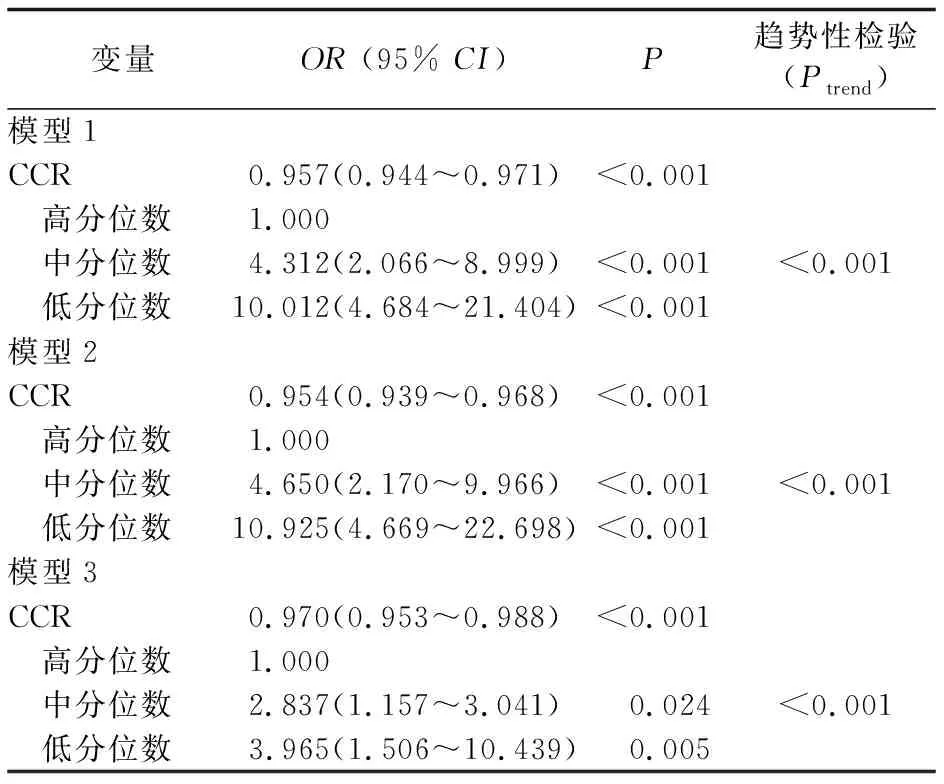
表3 CCR预测糖代谢异常的发生风险价值
模型1为未校正模型。模型2为校正性别、年龄后的模型。模型3为在模型2基础上校正BMI、腰围、HOMA-IR的模型
2.4 CCR对于早期筛查糖代谢异常的潜在价值 按照不同性别分组,对CCR用于识别受试者中糖尿病前期或2型糖尿病高风险人群的早期筛查价值进行ROC曲线分析。见图1。男性组CCR预测糖尿病前期或2型糖尿病的AUC为0.848 (95%CI为0.747~0.918,P<0.01), 截断值为92.000,灵敏度和特异度分别为0.861和0.714,约登指数为0.575;女性组AUC为0.738(95%CI为0.659~0.806,P<0.01),截断值为80.000,灵敏度和特异度分别为0.701和0.721,约登指数为0.422。
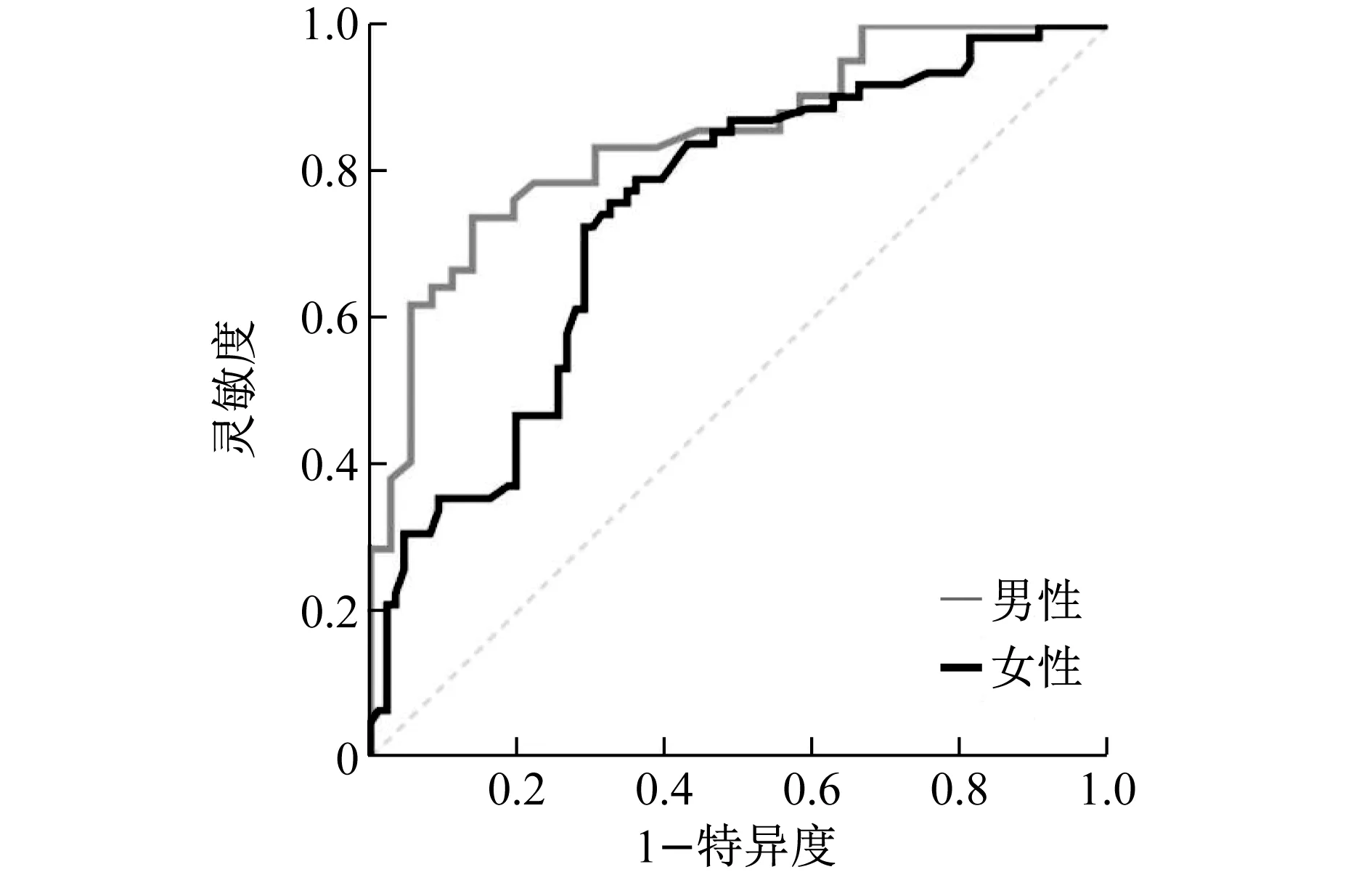
图1 CCR预测糖代谢异常的ROC曲线
3 讨 论
随着肥胖或超重患病率的增加,早期筛查出糖代谢异常风险人群有助于2型糖尿病的早期预防、诊断和治疗。本研究发现,CCR低值导致糖代谢异常风险增加,并且是糖代谢异常的独立危险因素。此外,本研究探索了将CCR作为预测糖代谢异常发生风险的生物学标志物的可行性。CCR作为血清学指标,相较电阻抗分析、双能X线、MRI、CT等方法测量身体成分、预测糖代谢异常的成本更低,且在大规模人群中重复监测糖代谢异常发生具有重要指导意义。
肌酐是肌肉分解的代谢产物,其分泌量与肌肉量成正比,但因其血清水平随肾功能差异而变化较大,故不作为评估肌肉量的指标[13]。胱抑素C经有核细胞分泌,由肾小球滤过,故其体内水平不受肌肉功能影响。鉴于胱抑素C对肌酐的校正作用,Osaka 等[8]把CCR作为评价相对肌肉量的有效血清学指标,用于筛查2型糖尿病老年患者肌肉减少症的发生情况。此外,既往研究[14]发现,肥胖人群因内脏脂肪累积引起慢性炎症反应和氧化应激致使胱抑素C表达增加及其在外周循环中的水平显著升高。本研究结果与该结论一致,即随着CCR三分位数值的增加,BMI、腰围呈显著递减趋势,且CCR与BMI、腰围呈显著负相关;表明CCR数值在肥胖特别是腹型肥胖人群中较低。本研究首次使用CCR作为肌肉与脂肪的替代指标评价糖代谢异常的潜在发生风险;在受试者中CCR低分位数组糖代谢异常患者51例(68.00%),且CCR低值是预测糖代谢异常发生的独立危险因素。在本研究中,CCR对糖代谢异常的预测价值,与近年来国内外多项关于肌肉量和VFA的量化指标对该疾病的预测价值的研究结果相符[3-5]。一项meta分析[15]结果显示,相对无肌少症性肥胖(sarcopenic obesity,SO)的患者,SO患者罹患2型糖尿病的风险增加了38% (OR值为1.38, 95%CI为1.27~1.50)。另一项纳入8 707例患者资料的横断面研究使用双能X线分析四肢肌肉量,证明肌少症是2型糖尿病患者发生胰岛素抵抗的独立危险因素[5]。Bao等[4]使用MRI分析VFA的研究结果显示,VFA≥80 cm2,或男性腰围≥90 cm2、女性腰围≥85 cm2发生代谢综合征的风险增加。这些研究结果从侧面证实CCR可作为反映肥胖者的骨骼肌质量、内脏脂肪面积的有效替代指标,结合本研究结果表明CCR与肥胖或超重人群糖代谢异常的发生、发展密切相关。
2型糖尿病早期以胰岛素抵抗为主要发病机制,多数2型糖尿病患者疾病初期都处于肥胖状态。异常的脂肪组织通过改变脂肪因子的分泌导致机体处于低水平炎症状态,并使骨骼肌中的脂肪累积增加,进而导致骨骼肌胰岛素信号通路受损,以及肌肉质和量降低[16]。骨骼肌是胰岛素介导葡萄糖摄取的重要器官,在胰岛素抵抗中起关键作用[17],肌肉因子的异常表达及信号通路的紊乱是2型糖尿病患者发生胰岛素抵抗的主要致病机制[18]。因此,身体脂肪、肌肉成分及其相应分子机制对胰岛素抵抗的发生、发展具有重要作用。从CCR与2型糖尿病的发病机制角度,本研究结果证实CCR与反应血糖状态的指标(如空腹C肽、空腹胰岛素、HOMA-IR)呈显著负相关,但与HOMA-β无显著相关性。由此解释CCR的两个主要因素(肌肉和脂肪)可能与胰岛素抵抗密切相关[19]。此外,CCR与其他代谢指标(如TG、BMI、腰围)呈显著负相关,与HDL-C呈显著正相关。这与Wang等[6]发现的骨骼肌质量和内脏脂肪面积之比与TG、BMI、腰围等代谢指标呈负相关的结论一致。在本研究中,调整血脂相关指标(HDL-C、TG)后,CCR对糖代谢异常、2型糖尿病发生影响的差异无统计学意义;故笔者推测CCR可能与血脂代谢异常等2型糖尿病发病机制相关,进而影响2型糖尿病的发生、发展。
本研究是首个在中国开展的探讨糖代谢异常与CCR之间关系的研究,结果提示CCR低值是发生糖代谢异常的独立危险因素。然而,本研究存在以下不足之处:首先,本研究为横断面研究,难以得到CCR与糖代谢异常发生、发展的直接因果关系。其次,缺乏CCR与肌肉和内脏脂肪含量比值的直接关系验证。在未来的工作中,将结合影像学和血清学指标深入研究人群身体成分变化与糖代谢异常发生、发展的相关性,挖掘相关的分子机制。同时,在临床开展多中心、大样本的前瞻性研究,以进一步探索CCR预测人群发生糖代谢异常的临床价值。
综上所述,CCR与糖代谢异常的多种影响因素密切相关,CCR有望成为早期筛查和个性化评估糖代谢异常发生风险的新型标志物。
