基于Nrf2/HO-1通路的三七总皂苷对脑栓塞大鼠的保护机制
2021-11-01魏丹丹岳孟龙
魏丹丹,李 爽,岳孟龙
血栓性中风(thrombotic stroke,TS)占中风发病率的80%以上[1]。目前针对TS的治疗以血栓发生早期再灌注时间窗内溶栓取栓和后期恢复性治疗为主[2]。影响血栓形成的因素如凝血酶原、纤溶酶等都参与氧化应激相关通路[3]。此外,丙二醛(malondialdehyde,MDA)等氧化应激产物引发的细胞毒害也是脑损伤过程中神经元凋亡的重要原因[4]。三七是常用于防治心脑血管缺血性疾病的中药,其提取物三七总皂苷(panax notoginseng saponins,PNS)具有抑制血栓形成的作用[5-6]。目前PNS相关研究多在抗栓和抗炎作用上,其在脑栓塞病理过程中抗氧化应激作用方面的研究并不多。本研究以雄性SD大鼠为研究对象,向大鼠颅内颈内动脉注入月桂酸钠进行TS造模,腹腔注射PNS和阳性药物(岩藻黄质)进行干预,观察大鼠行为,评定神经功能损伤,检测氧化应激标志物MDA和超氧化物歧化酶(superoxide dismutase,SOD),神经元核心抗原(NeuN)和胱冬肽酶3(Caspase-3)免疫组织荧光染色鉴定神经元凋亡情况,检测核因子E2相关因子(Nrf2)、Kelch样相关蛋白1(Keap1)、血红素加氧酶1(HO-1) mRNA和蛋白水平,探讨PNS对TS模型大鼠Nrf2/HO-1通路的影响及神经保护作用。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级成年雄性SD大鼠54只,体重(350±25)g,购自河南省动物实验中心,动物生产许可证号:SCXK(豫)2017-0001。饲养环境:昼夜循环光照(12 h/12 h),温度(23±3)℃,湿度(43±5)%。
1.2 主要药品及试剂 三七总皂苷(华中海威基因科技有限公司生产,纯度:HPLC>98%,货号:p31005);岩藻黄质(成都普瑞法科技开发有限公司生产,纯度:HPLC>95%,货号:BP0603);TRIzol Invitrogen、TaqMan One Step RT-qPCR Kit、BCA试剂盒均购自北京索莱宝科技有限公司,货号分别为:15596026、T2210、PC0020);GITC兔抗NeuN单克隆抗体、羊抗小鼠IgG(DyLight®650)、兔抗Nrf2多克隆抗体、兔抗Keap1多克隆抗体、兔抗HO-1多克隆抗体、HRP标记羊抗兔IgG、兔抗GAPDH多克隆抗体、大鼠MDA试剂盒均购自英国abcam公司,货号分别为ab223994、ab96874、ab137550、ab139729、ab13243、ab7090、ab9485、ab238537;小鼠抗Caspase-3单克隆抗体(美国赛默飞世尔生产,货号:MA1-16843);三用SOD ELISA试剂盒(美国R & D Systems生产,货号:DYC3419);BCA试剂盒(碧云天生产,货号:P0012);ECL试剂盒(上海炎熙生物科技有限公司生产,货号:ECL-P-100)。
1.3 动物模型建立与分组 将54只SD大鼠分为假手术组、模型组、PNS低剂量组、PNS中剂量组、PNS高剂量组和阳性药物组,每组9只。参考刘英等[7]月桂酸钠造栓法,将1.2 mg月桂酸钠溶解于2 mL生理盐水中配制成造栓工作液;25 mg/kg 3%戊巴比妥钠麻醉后剪开颈部皮肤,玻璃分针挑出右侧颈总动脉;采用连有微量进样针的PE管吸取造栓工作液300 μL,维纳斯剪剪开颈总动脉分支点附近颈内动脉,PE管沿颈内动脉推进15 mm后推注200 μL工作液,3 min后撤出PE管,缝合伤口完成造模。其中假手术组以300 μL生理盐水代替,其余步骤相同。建模后腹膜下注射给药,PNS低、中、高剂量组分别按照每天50 mg/kg、100 mg/kg、200 mg/kg注射PNS,阳性药物组按照每天50 mg/kg剂量经口饲喂岩藻黄质,连续给药14 d后进行神经功能评分及后续实验[8-9],假手术组、模型组每天注射2 mL生理盐水。
1.4 大鼠神经功能损伤评分测定 对神经功能损伤程度进行连续评分(mark),大鼠行为表现在0~5分之间。正常(0分);轻度障碍(0~1分),即大鼠提尾悬空,左右前肢伸展程度有明显差异;中度障碍(>1~2分),即大鼠拽尾后拖时左前肢无力反抗;中重度障碍(>2~3分),即大鼠前行时向左侧打圈;重度障碍(>3~4分),即大鼠站立不稳,向左侧倾倒;严重障碍(>4~5分),即大鼠意识不清,无法行动。多次评估结果取均值为该只大鼠的神经功能损伤评分[10]。
1.5 ELISA检测大鼠脑脊液中MDA和SOD含量 加注样品稀释液后加注标准品或样本50 μL,封板37 ℃孵育,注洗板3次后加注酶标抗体孵育,拍干加注底物室温显色,终止反应后上酶标仪读板。通过标准曲线计算MDA和SOD含量。
1.6 样本采集 从每组大鼠中随机抽取3只用于免疫组化试验,其余6只用于实时荧光定量聚合酶链式反应(RT-PCR)和蛋白免疫印迹法(Western Blot)检测。大鼠麻醉后俯卧于鼠台上,用一端连有微量进样器的头皮针穿入寰枕大池,抽出150 μL脑脊液,4 ℃暂存。大鼠取完脑脊液后仰置于蜡盘上,剪开胸腔暴露出心脏,先快速灌入200 mL生理盐水,后灌入4 ℃ 4%多聚甲醛150 mL。用刀片冠状截取A5.5 mm至A7.5 mm(距后囟)之间脑组织固定,用于组织切片。大鼠抽完脑脊液后取脑低温匀浆,置于-80 ℃冻存。
1.7 免疫组织荧光检测大鼠脑组织中NeuN和Caspase-3染色细胞数量 组织切片脱蜡复水后放入SSC(0.1 M,Ph=6.0)中漂洗,封闭,加一抗4 ℃过夜(NeuN 1∶500,Caspase-3 1∶2 000)后磷酸缓冲盐溶液(PBS)冲洗。加二抗37 ℃孵育1 h后冲洗、封片。荧光显微镜拍照后使用imageJ 15.1软件进行细胞计数。神经元凋亡比例=Caspase-3阳性细胞数/NeuN阳性细胞数×100%。
1.8 RT-PCR检测大鼠脑组织Nrf2、Keap1、HO-1 mRNA水平 提取脑组织匀浆总RNA,使用TaqMan一步法试剂盒进行PCR定量扩增。反应体系(25 μL):25×One Step RT-qPCR RTase mix(1 μL)、5×One Step RT-qPCR Buffer(5 μL)、前后引物各100 nmol/L(2.5 μL)、TaqMan Probe 500 nmol/L(4 μL)、RNA(4 μL)、无酶双蒸水(6 μL)。循环体系:反转录 52 ℃ 20 min;预变性 95 ℃ 5 min;变性95 ℃ 15 s;退火延伸 60 ℃ 40 s,40个循环。引物由金唯智生物科技有限公司完成。序列见表1。

表1 RT-PCR引物序列
1.9 Western Blot检测大鼠脑组织中Nrf2、Keap1、HO-1蛋白表达量 大鼠脑组织匀浆0.1 g提取蛋白,检测总蛋白含量和纯度。再将蛋白浓度稀释至5 μg/μL,热变性后上样。电泳、转膜后,NC膜脱脂奶清室温封闭2 h,加一抗(均为 1∶1 000)4 ℃孵育过夜。二抗室温孵育2 h后冲洗,增强化学发光法(ECL)显色,凝胶成像仪拍照进行分析。
2 结 果
2.1 各组神经功能损伤评分 与假手术组比较,模型组神经功能损伤评分明显升高,差异有统计学意义(P<0.05);与模型组比较,阳性药物组及PNS低、中、高剂量组神经功能损伤评分明显降低,差异均有统计学意义(P<0.05);与阳性药物组比较,PNS高剂量组神经功能损伤评分明显降低,差异均有统计学意义(P<0.05);与PNS低剂量组比较,PNS中、高剂量组神经功能损伤评分明显降低,差异有统计学意义(P<0.05);与PNS中剂量组比较,PNS高剂量组神经功能评分明显降低,差异有统计学意义(P<0.05)。详见表2。

表2 各组大鼠神经功能损伤评分比较(±s) 单位:分
2.2 各组脑脊液MDA和SOD水平比较 与假手术组比较,模型组脑脊液SOD水平明显降低、MDA水平明显升高,差异均有统计学意义(P<0.05);与模型组比较,阳性药物组、PNS低剂量组、PNS中剂量组、PNS高剂量组MDA水平明显降低,差异均有统计学意义(P<0.05),阳性药物组及PNS中剂量组、高剂量组SOD水平明显升高,差异有统计学意义(P<0.05);与阳性药物组比较,PNS高剂量组MDA水平明显降低,SOD水平明显升高,而PNS低剂量组SOD水平明显降低,MDA水平明显升高,差异均有统计学意义(P<0.05);与PNS低剂量组比较,PNS中剂量组、高剂量组MDA水平明显降低,SOD水平明显升高,差异均有统计学意义(P<0.05);与PNS中剂量组比较,PNS高剂量组MDA水平明显降低,差异有统计学意义(P<0.05)。详见表3。

表3 各组大鼠脑脊液MDA和SOD水平比较(±s) 单位:pg/mL
2.3 各组NeuN和Caspase-3染色结果比较 与假手术组比较,模型组神经元凋亡比例明显升高,差异有统计学意义(P<0.05);与模型组比较,阳性药物组、PNS中剂量组、PNS高剂量组神经元凋亡比例明显降低,差异均有统计学意义(P<0.05);与阳性药物组比较,PNS高剂量组神经元凋亡比例明显降低,差异有统计学意义(P<0.05);与PNS低剂量组比较,PNS中剂量组、高剂量组神经元凋亡比例明显降低,差异均有统计学意义(P<0.05);与PNS中剂量组比较,PNS高剂量组脑神经元凋亡比例明显降低,差异有统计学意义(P<0.05)。详见图1、表4。

表4 各组大鼠脑组织神经元凋亡情况比较(±s) 单位:%

图1 各组大鼠脑组织NeuN、Caspase-3免疫荧光染色结果(×400)
2.4 各组Nrf2 mRNA、Keap1 mRNA、HO-1 mRNA水平比较 与假手术组比较,模型组Nrf2 mRNA、HO-1 mRNA水平明显降低,差异均有统计学意义(P<0.05),Keap1 mRNA水平明显升高,差异有统计学意义(P<0.05);与模型组比较,阳性药物组、PNS低剂量组、PNS中剂量组、PNS高剂量组Keap1 mRNA水平明显降低,差异均有统计学意义(P<0.05),Nrf2 mRNA、HO-1 mRNA水平明显升高,差异均有统计学意义(P<0.05);与阳性药物组比较,PNS高剂量组Keap1 mRNA水平明显降低,差异有统计学意义(P<0.05),Nrf2 mRNA、HO-1 mRNA水平明显升高,差异均有统计学意义(P<0.05);与PNS低剂量组比较,PNS高剂量组Keap1 mRNA水平明显降低,差异有统计学意义(P<0.05),Nrf2 mRNA、HO-1 mRNA水平明显升高,差异均有统计学意义(P<0.05);与PNS中剂量组比较,PNS高剂量组HO-1 mRNA水平明显升高,差异有统计学意义(P<0.05)。详见表5。

表5 各组大鼠脑组织中Nrf2、Keap1、HO-1的mRNA水平比较(±s)
0.05;与PNS中剂量组比较,⑤P<0.05。
2.5 各组大鼠脑组织中Nrf2、Keap1、HO-1蛋白表达比较 与假手术组比较,模型组Nrf2、HO-1蛋白表达明显降低,Keap1蛋白表达明显升高,差异均有统计学意义(P<0.05);与模型组比较,阳性药物组及PNS中剂量组、PNS高剂量组Keap1蛋白水平明显降低,Nrf2、HO-1蛋白水平明显升高,差异均有统计学意义(P<0.05);与阳性药物组比较,PNS低剂量组Nrf2、HO-1蛋白水平明显降低、PNS高剂量组Keap1蛋白水平明显降低,差异均有统计学意义(P<0.05),PNS高剂量组Nrf2、HO-1蛋白表达明升高,PNS低剂量组Keap1蛋白表达明显升高,差异均有统计学意义(P<0.05);与PNS低剂量组比较,PNS高剂量组Keap1水平明显降低,PNS中剂量组、PNS高剂量组Nrf2、HO-1蛋白水平明显升高,差异均有统计学意义(P<0.05);与PNS中剂量组比较,PNS高剂量组Keap1蛋白水平明显降低,Nrf2、HO-1蛋白水平明显升高,差异均有统计学意义(P<0.05)。详见图2、表6。
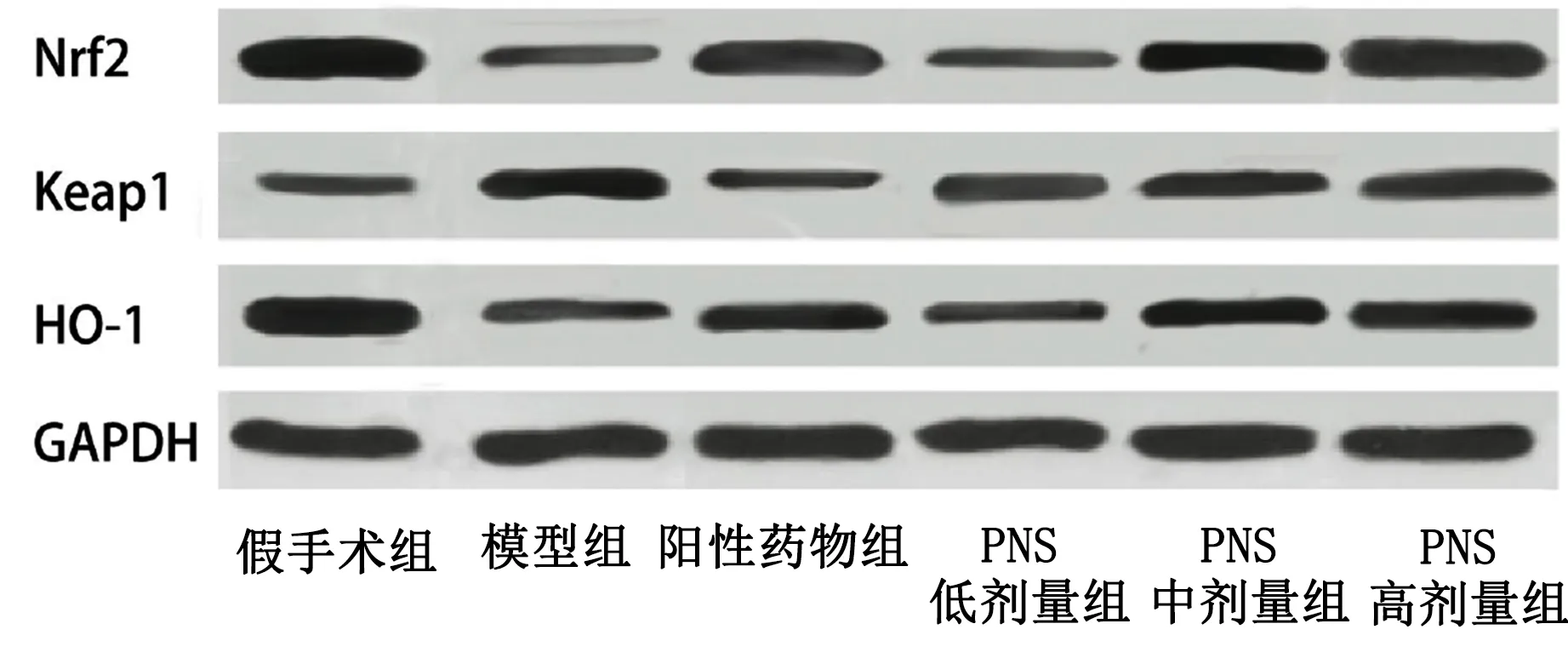
图2 各组大鼠脑组织Nrf2蛋白、Keap1蛋白、HO-1蛋白水平表达条带图

表6 各组大鼠脑组织中Nrf2、Keap1、HO-1蛋白表达比较(±s)
3 讨 论
脑缺血后,神经组织细胞内活性氧反应性地急剧上升是导致氧化应激的直接原因[11]。在创伤性脑病的病理过程中,Nrf2/HO-1途径是抗氧化应激和细胞毒性抵抗的关键通路之一[12]。上调Nrf2/HO-1通路可诱导一系列抗氧化酶和解毒酶系,加快酶促反应,使SOD等抗氧化物质水平均升高,并降低自由基及其他氧化应激产物水平,同时有利于维持细胞膜正常电位[13-14]。Nrf2通过与Keap1动态结合实现胞内水平稳定,二者在细胞抗氧化调节中处于中心地位[15]。ROS等氧化应激产物激活蛋白激酶C调控可诱导Nrf2磷酸化,使其与Keap1蛋白解聚倾向增大,能够与核内多种抗氧化剂反应元件结合的Nrf2量也相对增加,从而上调HO-1等下游因子的转录水平。研究表明,HO-1可调节应激活化蛋白激酶(JNK)、低氧诱导因子1α、高迁移率族蛋白等下游抗氧化信号通路[16-17]。氧化应激产生的MDA和其造成的线粒体损伤是神经元凋亡的重要原因[18]。因此,上调Nrf2/HO-1通路有利于抑制神经元凋亡。脑栓塞在中医辨证上属于气滞血瘀,治疗上应以行气活血、疏通经络为主[19]。三七能散瘀止血、消肿祛痛。传统中医通过针对性的炮制使三七发挥不同功效[20]。现有研究表明,三七主要药效成分为三七素和PNS,三七素是一种具有强效止血作用的特殊非蛋白氨基酸,PNS是活血抗栓的主要药效成分[21]。
本研究结果显示,模型组神经功能损伤评分、MDA水平、神经元凋亡比例明显高于假手术组,SOD水平和Nrf2/HO-1通路水平比假手术组明显下降。Hu等[22]研究表明,岩藻黄质能上调脑缺血再灌注模型大鼠Nrf2/HO-1通路,改善神经功能损伤。有研究显示,岩藻黄质可使皮肤细胞Nrf2/HO-1转录水平上调[23]。阳性药物组与模型组比较,脑组织中Nrf2、HO-1 mRNA和蛋白水平、脑脊液中SOD水平明显升高,神经功能损伤评分、神经元凋亡比例、脑脊液中MDA水平明显降低,结果符合上述研究。PNS各剂量组神经功能损伤评分、MDA水平、神经元凋亡比例、Keap1 mRNA和蛋白水平均降低,Nrf2、HO-1 mRNA和蛋白水平、SOD水平均升高。实验中PNS治疗机制与岩藻黄质相似,高剂量时治疗效果优于岩藻黄质。说明PNS可能通过影响Nrf2和Keap1转录,上调Nrf2/HO-1通路,降低大鼠脑部神经细胞的氧化应激水平,抑制神经元凋亡,从而减轻神经功能损伤,而且这种治疗效果与剂量呈正相关。
综上所述,在TS大鼠治疗过程中,PNS能够下调Nrf2/HO-1通路,降低组织氧化应激水平,减轻神经元凋亡,发挥神经保护作用。实验并未排除PNS的溶栓通血作用对神经元凋亡可能造成的影响,是本研究的不足之处。
