外源CaCl2对盐胁迫下苹果砧木T337生理特性的影响
2021-11-01高彦龙张仲兴王双成王延秀
高彦龙,张 德,张 瑞,张仲兴,赵 婷,王双成,王延秀
(甘肃农业大学 园艺学院,甘肃 兰州 730070)
苹果(MalusdomesticaBorkh.)是我国西北地区重要的经济果品[1],但该地区日趋加剧的土壤盐渍化严重制约了苹果产业的进一步发展,影响果实产量和品质的形成[2]。生产发现,一定浓度的硝普钠(SNP)、亚精胺(Spd)和水杨酸(SA)能够提高麻黄幼苗的抗盐性能[3],外源SAM(S腺苷甲硫氨酸)也可显著缓解盐胁迫对植株的伤害[4]。故适宜的外源物质对植物在逆境下生长具有重要意义。
在生产中应用外源物质以期提高植物抗逆性的研究已成为焦点。研究发现,外源钙处理可增强干旱胁迫下水稻的渗透调节能力,使其保持较高的组织含水量[5],赵小红[6]发现外源CaCl2处理可增加植株脯氨酸和SSC含量,从而提高其抗旱性;低温容易引起植物细胞膜结构的破坏,而钙离子可与磷脂发生聚合作用,来增强膜的硬度和完整性[7],以上研究均表明,适宜浓度的CaCl2可减缓干旱及低温胁迫对植物造成的伤害。盐胁迫下,外源CaCl2处理可提高百合体内渗透调节物质的含量及抗氧化酶活性[8],还会引起质膜上Ca2+内流,从而激活SOS、CBL-CIPK等通路以增强耐盐性[9];此外,张浩等[10]在玉米的研究中证实外源CaCl2可改变气孔结构特征增强叶片光合作用,提高其耐盐性。目前,外源CaCl2在植物盐胁迫中的应用多集中蔬菜[11]和主要的粮食作物[12-13]上,在梨[14]、酸枣[15]等木本植物中也有研究,而在苹果砧木逆境胁迫中鲜见应用及报道。
T337是英国东茂林试验站选育的优良矮化砧木,苹果生产中应用较广,具有育苗简单、苗圃整齐、结果早、产量高、品质优等特点[16]。本试验以T337为试材,研究盐胁迫下外源喷施不同浓度CaCl2对其叶片光合及生理特性影响,并利用主成分综合评价不同浓度间效果,以期为CaCl2在苹果砧木抗性研究及栽培生产中提供理论依据,从而实现苹果高产优质栽培。
1 材料和方法
1.1 材料与处理
本试验于2020年5-9月在甘肃农业大学(N 36°1′~37°9′,E 106°21′~107°44′)避雨棚中进行,选择长势相似且生长健壮的二年生苹果砧木T337 90株,栽植于盛装3.5 kg基质(蛭石∶珍珠岩∶泥炭=1∶1∶3,按比例混合后钙含量约为0.02 mg/kg,对试验的影响可忽略不计)、质量约为0.65 kg的大营养钵中(25 cm×38 cm),每盆一株,置于避雨棚中统一管理。
试验共设6个处理(表1),对照(CK)浇灌去离子水,T2~T5处理浇灌盐溶液,每个处理3次重复,每个重复5株。各处理均隔7 d分别浇灌4 L去离子水和盐溶液,在浇灌盐溶液的同时,CK和T1叶面喷施200 mL去离子水,对T2~T5处理每盆叶面喷施相同体积的CaCl2溶液。此外,喷施时间一般选择晴天的清晨(9∶00-10∶30)进行,从胁迫处理次日开始,第1次取样时间为2020年5月11日,后每隔5 d取生长一致的幼苗顶端相同节位叶片进行各项指标测定。
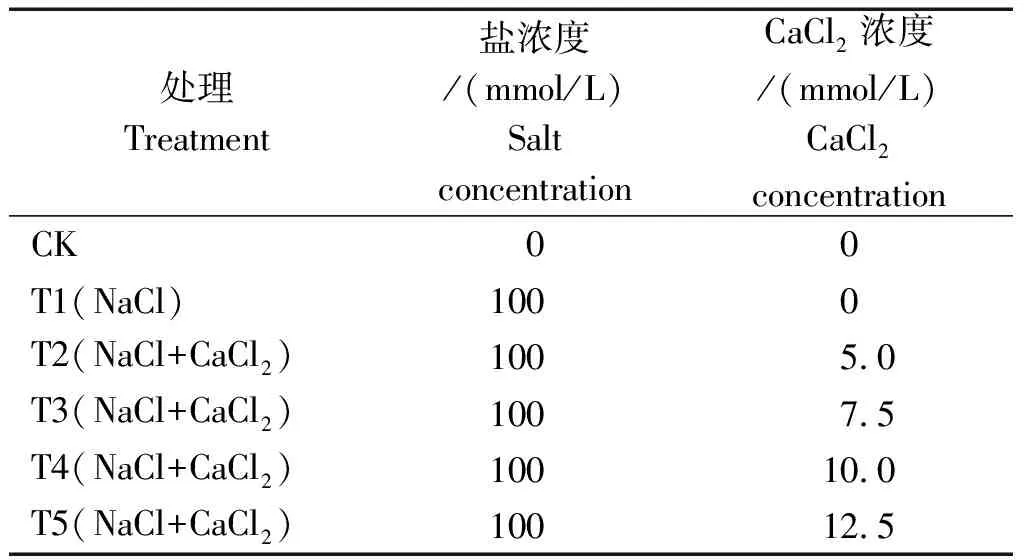
表1 试验设计方案Tab.1 Test design scheme
1.2 生理指标的测定
1.2.1 叶绿素含量的测定 相对叶绿素含量(SPAD)用SPAD-502叶绿素计测量,使用前进行校准。于胁迫0,5,10,15,20 d后,采植株中上部大叶节以上的功能性叶片,洗净擦干表面污物,选用中脉两边宽度一致且对称的叶片进行指标测定,重复3次,取平均值。
1.2.2 光合及荧光参数的测定 光合参数测定:光合特性在早晨9:00-11:00测定,于胁迫0,5,10,15,20 d后选取向阳枝条上的成熟功能叶片,使用 LI-6400XT便携式开放气体交换器系统(Li-COR Biosciences,Lincoln,美国)测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2(Ci)、气孔导度(Gs),光合有效辐射为400~600 μmol/(m2·s),叶室内空气流量设定为500 mL/min,室内CO2浓度为(385±10)μL/L,每个处理选取3株。
荧光参数测定:暗处理30 min后使用Imag-ing-Pam叶绿素荧光计和成像WinGegE软件(Walz,Effeltrich,德国)测定初始荧光(F0)、PSⅡ最大光能转化率 (Fv/Fm)、光合电子传递效率(ETR)的变化,测定时间与光合参数测定同步。
1.2.3 抗氧化酶活性及渗透调节物质的测定 在胁迫0,5,10,15,20 d后,采取植株中上部大叶节以上的功能性叶片,用蒸馏水洗净并去除叶脉磨碎,用于测定生理指标。相对电导率采用电导仪法[17];超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)参照Singh等[18]的方法测定;丙二醛(MDA)、脯氨酸含量参照Rozi等[19]的方法测定,重复3次。
1.3 数据处理
利用SPSS 22.0(BM,Armonk,NY,美国)进行显著性分析、相关性和主成分分析,Origin 9.1软件(OriginLab,Hampton,MA,美国)作图。显著性分析检验统计差异,Duncan检验比较平均差异(P< 0.05)。
2 结果与分析
2.1 盐胁迫下外源CaCl2处理对T337叶片光合特性影响
由图1-A可知,随着盐胁迫的持续,叶片的Tr呈持续下降趋势,具有明显浓度效应。胁迫至20 d,T2~T5处理下的Tr降至最低,分别为1.39,1.32,1.54,1.29 mmol/(m2·s),均显著高于T1(1.21 mmol/(m2·s),显著低于CK(2.42 mmol/(m2·s))。相较于T1,Tr分别提高了14.88%(T2),9.09%(T3),27.27%(T4),6.61%(T5),以T4处理效果最佳。
叶片的Pn呈现出与Tr相同的趋势,且在同一时间点Tr随CaCl2处理浓度的增加呈先升后降的趋势(图1-B)。胁迫至20 d,各处理Pn降至最低值,其中T4处理值最高(3.45 μmol/(m2·s)),T2处理值最低(3.14 μmol/(m2·s)),均显著高于T1(3.02 μmol/(m2·s)),相对于T1,T2和T4处理Pn增幅分别为3.97%,14.24%。
由图1-C可得,随胁迫时间延长,叶片Ci呈持续上升趋势,但各处理下的增幅不同。胁迫至10 d后,Ci随CaCl2处理浓度的增加呈先降后升的趋势。胁迫至20 d,各处理下Ci差异显著,其中T4增幅最小,相对于CK,增幅为44.03%。
图1-D可知,T337砧木叶片的Gs随处理时间的延长呈持续下降趋势,胁迫至20 d,各处理下的Gs降至最低值,均显著低于CK,其中T2降幅最小,为CK的44.97%,以T2处理效果最佳。
2.2 盐胁迫下外源CaCl2处理对T337叶片荧光特性和相对叶绿素含量的影响
由图2-A、B、C可知,随胁迫时间的持续,T337叶片的F0、Fv/Fm、ETR均呈持续下降的趋势,且具有明显的浓度效应,即不同浓度的CaCl2均能够有效降低胁迫对植株光合的影响,但不同浓度下其降幅不同。胁迫至20 d,各处理下的F0、Fv/Fm、ETR降至最低值且各处理之间差异显著。与CK相比,F0在T4下降幅最小,为45.17%,Fv/Fm在T5下降幅最小,为48.92%;与T1相比,ETR在T3下升幅最大,为8.51%。
随胁迫时间的延长,T337叶片的SPAD呈持续下降的趋势,不同处理下SPAD的降幅不同(图2-D)。胁迫5 d后,各处理下SPAD均显著低于CK且差异显著。胁迫至20 d,各处理下SPAD下降至最低值,分别为57.94(T2),56.39(T3),58.99(T4),57.06(T5),与T1相比,SPAD分别提高3.08%,1.80%,5.49%,2.03%,其中,以T4处理下效果最好。
2.3 盐胁迫下外源CaCl2处理对T337叶片Pro、REC的影响
由图3可知,随胁迫时间的延长,REC呈持续升高的趋势,在胁迫至15 d各处理之间差异显著。胁迫至20 d,CaCl2处理下REC达到最大值。相对于CK,T4处理下叶片REC上升了14.76百分点。
胁迫0~15 d,T2~T5处理下Pro含量随CaCl2浓度的增加呈下降趋势。胁迫至20 d,T1处理使Pro含量降至最低值,T3处理下Pro含量最高,与CK相比,T3处理下Pro含量上升了43.67%。
2.4 盐胁迫下外源CaCl2处理对T337叶片MDA含量和抗氧化酶活性的影响
图4-A显示,各处理下的MDA含量随盐胁迫时间的延长呈持续上升的趋势,且不同浓度下增幅不同。胁迫至20 d,叶片MDA含量达到峰值,各个处理下MDA含量均显著高于CK(P<0.05),分别为CK的2.19(T2),2.05(T3),1.88(T4),2.11倍(T5),其中以T4效果最佳。
随着胁迫时间的延长,叶片的CAT活性呈先升后降趋势(图4-B)。胁迫至15 d,叶片CAT活性在各处理下达到峰值,分别为229.678(T2),209.151(T3),230.611(T4),210.712(T5)。胁迫至20 d,CAT活性降至最低,各处理下CAT活性均显著低于CK(P<0.05),显著高于T1,与T1(125.266 U/(g·min))相比,T2~T5处理升幅分别为14.26%,20.04%,11.15%,3.16%,以T3效果最为显著。
由图4-C、D可知,盐胁迫下T337叶片的SOD和POD活性均呈先升后降的趋势。各处理分别在胁迫10 d达到峰值后不断下降,且随CaCl2浓度的增加,其活性也表现出先升后降的趋势。胁迫至20 d,SOD和POD活性在各处理下降至最低,均显著高于T1(P<0.05),与T1相比,T4处理升幅最大,升幅分别为37.30%(SOD),36.05%(POD)。
2.5 外源CaCl2对盐胁迫下苹果砧木T337叶片生理效应的综合评价
2.5.1 相关性分析 利用SPSS软件对盐胁迫后的14个指标进行相关性分析,获得相关系数矩阵(表2)。结果表明,T337砧木的Pn与Tr、Gs、F0、Fv/Fm、ETR、SPAD呈极显著正相关(P<0.01),与MDA、Ci、REC呈极显著负相关(P<0.01),与CAT呈显著正相关(P<0.05)。表明可以用Pn、Tr、Gs、F0、Fv/Fm、ETR、SPAD、MDA、Ci、REC等指标来评价外源CaCl2对T337在盐胁迫下的缓解程度。
2.5.2 主成分分析 为综合评价盐胁迫下不同浓度外源CaCl2对苹果砧木T337生理特性的影响,将胁迫后的14个耐盐指标进行主成分分析,并提取特征值大于1的2个主成分(特征值分别为11.190,2.295)(表3)。第一、二主成分的方差贡献率依次为79.930%,16.394%,累计方差贡献率达到96.324%,符合分析要求。第一主成分代表了SPAD、ETR、POD、CAT、Pn、Ci、Gs、Tr、F0和Fv/Fm等10个指标,第二主成分综合了REC、MDA、SOD和Pro等指标,说明钙对盐胁迫下植株的调节主要是通过提高叶绿素含量和增强叶片光合能力,其次是通过提高渗透调节物质含量来增强耐盐性。
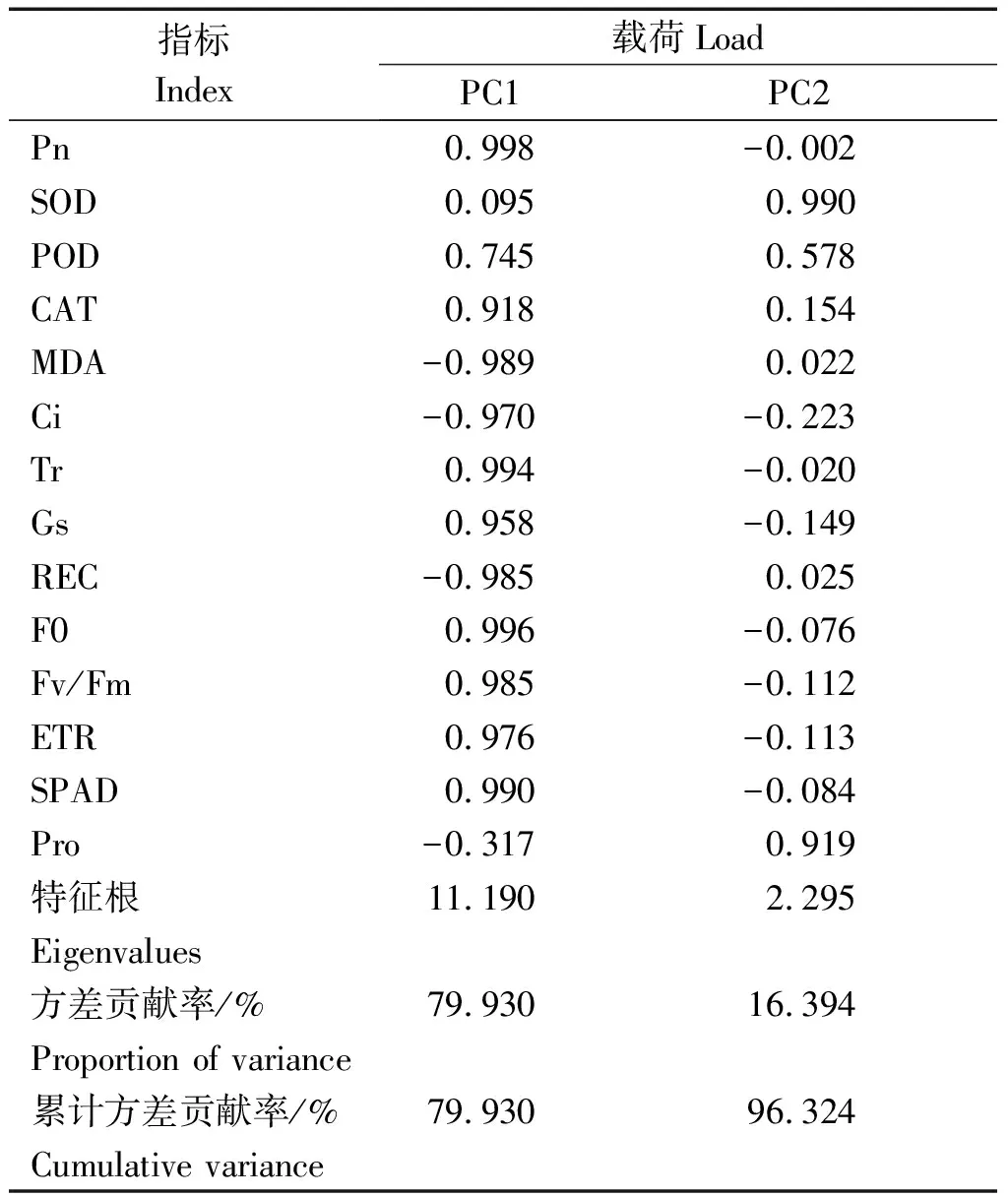
表3 主成分分析方差解释Tab.3 Total variance explained
综合得分(F)是每个主成分得分与对应贡献率的乘积之和,即:F=F1×79.930%+F2×16.394%。由表4可知,各处理下的综合得分分别为1.516 57(CK)、-0.887 92(T1)、-0.314 76(T2)、-0.115 08(T3)、0.133 29(T4)、-0.332 11(T5)。因此,盐胁迫下不同浓度外源CaCl2对苹果砧木T337叶片生理特性的影响排名依次为:CK>T4>T3>T2>T5>T1。
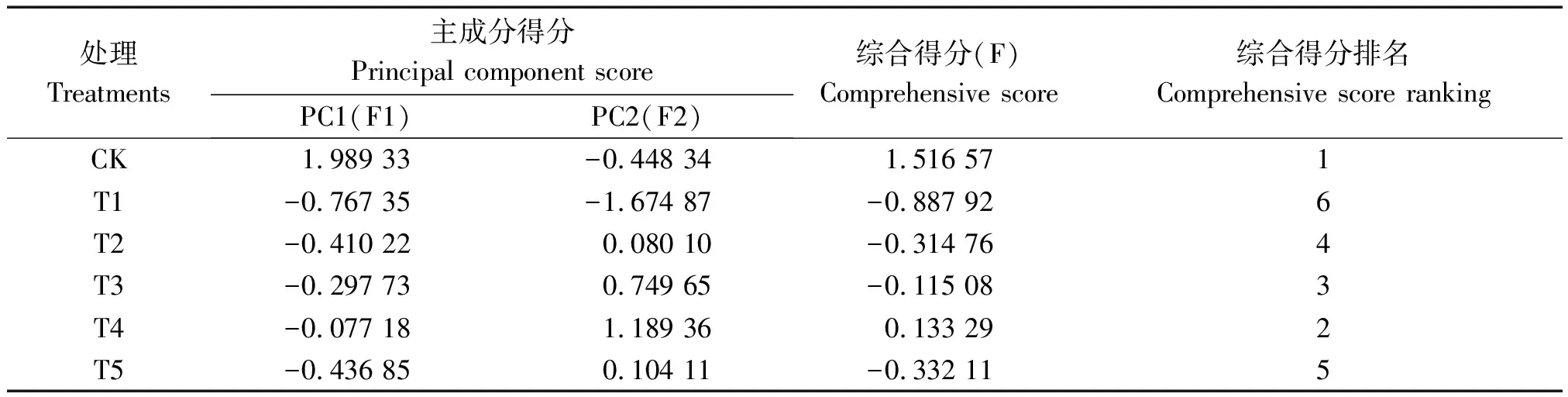
表4 苹果叶片在不同浓度CaCl2处理下的综合得分及排名Tab.4 The comprehensive score and ranking of apple leaves treated with different concentrations of exogenous calcium chloride
3 讨论与结论
叶绿素含量会直接影响植物耐盐性[20],盐胁迫会破坏叶绿体结构,直接或间接影响叶绿素含量[21]。本试验中,T337砧木叶片的叶绿素含量在盐胁迫后显著下降,可能是盐胁迫破坏了叶绿体结构,抑制了光合色素的生成[22],这与李青云等[23]在草莓中的研究结论相一致;施加外源CaCl2后,其叶绿素含量降幅减缓,可能是CaCl2维持了良好的叶绿体片层结构,保持其结构完整性,这与刘艺平等[24]提出CaCl2可调节叶绿素合成观点一致。
光合作用对保障植物正常生长发育有重要意义[25],研究发现,在植物遭受逆境时,气孔限制或非气孔限制都会引起植物光合速率的下降[26]。气孔限制是由于CO2进入叶片受阻所致,非气孔限制则是由于光合细胞机构和功能受损所致[27];本研究发现,NaCl胁迫下T337砧木叶片的Pn和Gs均随胁迫时间的延长呈下降的趋势,Ci却升高,说明该光合速率的下降是由气孔限制所致,这可能是盐胁迫使叶片气孔下腔到叶绿体羧化点CO2的路径受损,导致叶片气孔导度降低和叶片蒸腾速率下降[28]。
施加外源CaCl2后,Gs和Pn降幅减小,Ci逐渐下降,说明Ca2+可通过改善气孔开张程度来提高植株光合性能,这与Farquhar等[29]观点相同。叶绿素荧光参数在一定程度上可反映环境对光合作用的影响,一般认为,F0降低表明PS Ⅱ天线色素的热耗散增加,而F0升高表明PS Ⅱ反应中心受到伤害[30]。Fv/Fm的变化反映胁迫下PS Ⅱ的损伤程度,Fv/Fm下降越多,表示PS Ⅱ损伤越大[31]。在本试验中,随胁迫时间的延长,T337叶片的F0、Fv/Fm和ETR均逐渐降低,说明盐胁迫破坏了PS Ⅱ反应中心,电子传递效率下降。喷施CaCl2后,T337砧木光合性能得到有效改善,并具有明显的浓度效应,这与张士功等[32]在小麦上的研究结果一致,说明外源CaCl2可缓解盐胁迫对PS Ⅱ系统的损伤,维持PS Ⅱ光化学活性及光合电子传递的正常进行,从而维持较高的光合效率。
MDA和REC是反映逆境胁迫对植物细胞膜脂过氧化伤害程度的重要指标[33]。本研究中,盐胁迫下T337叶片REC、MDA含量均显著增加,表明胁迫下可能加剧了细胞膜脂过氧化程度,质膜遭到破坏[34]。喷施外源CaCl2后,REC下降、MDA含量显著降低,这可能是钙与磷脂和蛋白质结合影响膜的相变和流动性,导致膜透性降低,同时钙离子缓解细胞膜脂过氧化程度减缓了MDA生成,这与Yang等[35]在黄瓜幼苗中研究结论一致。研究表明,逆境胁迫会促进植物积累大量脯氨酸来调节细胞内外渗透压,以维持细胞的动态平衡[36-37]。本试验中,脯氨酸含量随胁迫时间延长呈上升趋势,可能是盐胁迫激活脯氨酸合成酶并抑制脯氨酸降解酶,使得脯氨酸大量积累[38];在喷施外源CaCl2后,T337叶片的脯氨酸含量显著高于未施CaCl2处理,这与黄健等[39]、周双云等[40]在豌豆和巴西蕉研究结果一致,可能是Ca2+参与了脯氨酸的另一条合成路径,促进鸟氨酸和精氨酸的合成[41],从而加速脯氨酸的积累。非生物胁迫下,植物自身会启动酶促和非酶促两类保护系统来减轻或消除活性氧自由基的伤害[42-43],SOD、POD活性通常表现出先升后降的趋势[44],本研究中,T337叶片在盐胁迫下POD、SOD、CAT均呈先升后降趋势,这可能是长期盐胁迫下过氧化程度加剧,质膜受损所致[45];喷施CaCl2后,T337砧木叶片的POD、SOD降幅减小,可能是Ca2+缓解了自由基对膜的破坏,从而维持细胞内正常的活性氧水平,这与王策[46]在酸枣中的研究结果相似,说明钙对抗氧化酶的保护可能是Ca2+可以与钙调蛋白结合增强过氧化酶的活性,相比之下,关于钙在盐胁迫下促进脯氨酸积累的机制尚不明确,有待下一步深入研究。
植物耐盐性的强弱取决于多种因素的共同作用,本试验对盐胁迫后T337叶片的14个生理指标进行抗盐性综合评价,通过相关性和主成分分析得出外源CaCl2调节T337抗盐性的主要生理指标,同时可知,盐胁迫下不同浓度外源CaCl2对T337生理特性的影响排名依次为:T4>T3>T2>T5。
盐胁迫下,外源CaCl2可通过维持植物叶绿体片层结构保持较强的光合效率,通过改善抗氧化酶活性和调节渗透物质的积累,从而清除过量的活性氧,以提高生物膜的稳定性来缓解盐胁迫对植株的伤害,且具有浓度效应。10 mmol/L CaCl2能有效改善苹果砧木T337的耐盐性。
