西尼罗河病毒感染与免疫机制研究进展
2021-10-30卫芳芳程昌勇宋厚辉浙江农林大学动物科技学院动物医学院浙江省畜禽绿色生态健康养殖应用技术研究重点实验室中澳动物健康大数据分析联合实验室浙江杭州311300
孙 静,何 展,蔡 畅,卫芳芳,程昌勇,宋厚辉 (浙江农林大学 动物科技学院/动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室 中澳动物健康大数据分析联合实验室,浙江 杭州 311300)
西尼罗河病毒(West Nile virus,WNV)属于黄病毒科(Flaviviridae)家族成员,为分节段的单股正链 RNA 病毒,基因组长度约为11 kb(图1)。该病毒的生命周期如图2所示,首先附着于细胞表面受体(未知),被细胞内吞后与吞噬体膜融合,释放病毒基因组RNA进入细胞质,被翻译为一个单一的多聚蛋白,该多聚蛋白随后被病毒和宿主蛋白酶裂解,产生3个结构蛋白(C、prM和E)和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[1]。结构蛋白会包裹病毒RNA参与病毒粒子的形成,非结构蛋白形成负向和正向病毒RNA合成所需的复制复合体。病毒粒子在宿主体内完成组装并通过宿主分泌途径进行转运,成熟的病毒粒子通过胞吐作用从感染细胞释放出来,从而进行新一轮感染[2]。

图1 WNV结构
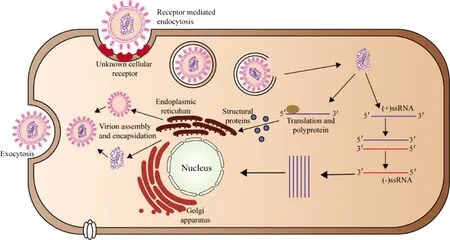
图2 WNV生命周期
在自然界中,WNV主要在蚊(主要是库蚊)和鸟类之间循环传播,但偶尔出现循环外溢,从而感染人类和一些马属动物。有研究显示,WNV在一些哺乳动物(如松鼠)和爬行类动物(如鳄鱼)中存在[3]。因此,目前建立的基于小鼠、仓鼠和一些非人类灵长类动物的WNV感染动物模型,为人类进一步了解其感染机制提供了研究基础。现综述WNV的发病机制,重点介绍先天免疫激活、先天免疫应答与适应性免疫应答之间的相互干扰以及针对病毒免疫逃逸对策等方面的最新研究进展并围绕这些进展进行了讨论,以期为新型治疗方法的研制及疫苗接种期间如何提高免疫力的策略方面提供新思路。
1 WNV的发病机制
WNV可在蚊虫的肠上皮细胞中复制,并通过血液、淋巴传播到唾液腺和其他器官,由此可知,限制WNV传播能力的关键步骤在于蚊虫的肠道屏障,该屏障主要依赖于产生抗菌肽和围食基质(由几丁质、蛋白质、糖蛋白和蛋白聚糖组成)作为物理和免疫屏障,共同限制病毒在昆虫内的复制和传播[4-5]。WNV感染可激活无脊椎动物先天免疫系统(如Toll、JAK-STAT介导的先天免疫信号通路和抗菌肽),从而限制其感染。另外,蚊虫携带的沃尔巴克氏体细菌(一种共生细菌),可以抑制WNV在昆虫体内的复制。
WNV感染机体后会呈现3个不同的阶段,包括初始感染和传播(早期阶段)、外周病毒扩增(内脏器官传播阶段)和神经侵袭(中枢神经系统阶段)。人体一旦被感染,机体免疫系统会发挥不同程度的抗病毒作用:(1)先天免疫应答包括细胞内抗病毒防御、Ⅰ型干扰素(IFN)应答和免疫细胞介导的应答(包括中性粒细胞、自然杀伤细胞和γδT细胞),协调WNV的早期控制;(2)适应性免疫应答包括体液和适应性免疫细胞(CD4+、CD8+和调节性T细胞)介导的应答。
在协助WNV传播感染过程中,蚊虫发挥了重要的作用。首先,根据蚊虫种类的不同,每次叮咬可将多达106个噬斑形成单位(plaque forming unit,PFU)的病毒注入宿主体内。蚊子唾液中除了含有阻断宿主免疫反应的病毒因子外,还含有抗止血、减少炎症和改变宿主免疫的分子,导致宿主局部免疫反应失调,包括细胞因子水平的改变、局部免疫抑制,减少中性粒细胞、树突状细胞(DCs)和T细胞向感染原发部位的募集等。
在突破皮肤表层结构后,病毒首先感染角质细胞和皮肤原位DCs(包括真皮DCs和朗格汉斯细胞),随后在引流淋巴结内扩增,导致病毒血症并扩散到脾脏等内脏器官,其中,脾脏是病毒在外周组织中复制的主要场所。截止目前,WNV在脾脏和其他外周组织感染的特异性靶细胞尚不清楚,但被认为可能与DCs、巨噬细胞的亚群,中性粒细胞有关。WNV感染的第3阶段即严重危害感染者的中枢神经系统。其主要发病机制依赖于病毒进入中枢神经系统并在靶细胞(包括神经元和髓细胞)内的有效传播能力。就病毒本身而言,其结构蛋白对于侵袭神经系统也有重要作用。研究显示,WNV的E蛋白结构上的N链接聚糖能够控制神经侵袭,但其具体机制尚未清楚,可能与内皮细胞的渗透有关。神经侵袭更常见的则是血脑屏障的破坏,这种变化主要由血管活性细胞因子如肿瘤坏死因子(TNF)和基质活化调节的内皮细胞通透性变化触发。其他进入中枢神经系统的机制还包括嗅觉神经元感染和一种“特洛伊木马”机制,其主要借助被感染的免疫细胞将病毒传递至中枢神经系统。综上所述,病毒能够通过多种方式感染宿主细胞,因此,细胞的免疫防御机制显得尤为重要[6]。
2 WNV引起的细胞内免疫应答
2.1 RLRs抗病毒机制先天性抗病毒防御对于控制WNV感染至关重要。这些防御包括Ⅰ型IFN(研究显示IFN具有潜在的抵抗多种RNA病毒感染的能力)和促炎性细胞因子的产生,细胞内相关的抗病毒基因表达和后期细胞内适应性免疫应答反应的发生[7]。伴随着免疫应答的发生,细胞内相关信号通路同样被激活,病毒的病原相关分子模式(pathogen associated molecular patterns,PAMPs)会被相应的宿主细胞模式识别受体(pathogen-recognition receptors,PRRs)识别,例如视黄酸(维甲酸)诱导酸诱导基因Ⅰ样螺旋酶受体(RIG-Ⅰ-like receptors,RLRs)活化过程中的PAMPs,主要包括视黄酸诱导基因Ⅰ蛋白(retinoic-acid-inducible protein Ⅰ,RIG-Ⅰ),黑素瘤分化抗原5(melanoma differentiation antigen 5,MDA5,亦称IFIH1)和LPG2(亦称DHX58)等,这些病毒模式识别受体在细胞内表达水平升高,激活下游效应子,最终导致IFN调节因子(IRF)介导的靶基因转录和Ⅰ型IFN的产生[8]。体外WNV感染小鼠原代细胞的研究表明,RIG-Ⅰ在感染早期很重要,而MDA5的功能是维持和放大先天免疫反应。这表明,WNV编码的病毒PAMPs可以触发RIG-Ⅰ和MDA5信号。在后期研究中发现,RIG-Ⅰ可以检测正链和负链的WNV RNA,从而引起抗病毒免疫[9]。
2.2 TLRs抗病毒机制另一个关键的先天性免疫信号通路是由TLRs介导的。与RLRs类似,TLRs识别PAMPs,随后激活下游信号通路,激发先天免疫防御应答。其中,TLR3可识别双链RNA (dsRNA),而TLR7和TLR8可识别GU-rich ssRNA。随着配体的结合,TLR3募集接头分子TRIF (TIR域内接头诱导IFN-β),并激活转录因子IRF3、IRF7和核因子κB (NF-κB),最终引起IFN-β的转录和Ⅰ型IFN和促炎细胞因子的产生[10]。TLR7和TLR8可在细胞核内表达,与ssRNA结合后,招募接头分子MYD88,激活转录因子IRF7和NF-κB,从而引发Ⅰ型IFNs和促炎因子的表达[11]。
2.3 Ⅰ型干扰素信号介导的抗病毒机制RLR和TLR信号都能激活IRF转录因子,尤其是IRF3和IRF7,它们对于调节病毒感染后的Ⅰ型IFN应答至关重要[12]。这些IRFs可诱导Ⅰ型IFN分泌,并与IFN-α和IFN-β受体复合物(IFNAR)结合,激活受体相关的激酶如酪氨酸激酶2 (TYK2)和JAK1,随后STAT1和STAT2发生磷酸化并引起ISG因子3 (ISGF3)复合物的组装,该复合物由STAT1-STAT2异质二聚体和IRF9组成[13]。该复合物形成后会移至细胞核并启动IFN刺激基因(ISGs)的转录。此外,NF-κB激酶ε抑制剂(IKKε)可使STAT1的708位丝氨酸位点磷酸化,导致ISGF3复合物的特异性发生改变,从而增强依赖IKKε抗病毒基因的表达[14]。虽然IRF3和IRF7均可限制病毒在外周和中枢神经系统中的复制,不同细胞选择激活的IRF也存在差异。在WNV感染的小鼠胚胎成纤维细胞和皮质神经元中,Ⅰ型IFN-α的诱导依赖于IRF3并被IRF7放大,而在DCs和巨噬细胞中,IFN转录仅需要IRF7[15]。而IRF3和IRF7的表达量降低并不会阻断这些细胞中IFN-β的转录和ISG的表达,表明在RLR或TLR信号下游存在额外的IRFs或其他转录因子起协调作用,调节Ⅰ型IFN分泌[16]。
2.4 炎性小体调节免疫程序炎性小体是一种先天免疫信号复合物,可通过分泌IL-1β家族的促炎细胞因子(包括IL-1β、IL-18和IL-33)调节免疫程序并促进病毒的清除。IL-1β是一种多效细胞因子,具有双向作用:一方面它可以通过促进免疫细胞运输和分泌抵抗病原感染引起保护性免疫;另一方面它可以通过程序性细胞死亡,触发病理反应。
在多种类型炎性小体中,NLRP3(含NOD、LRR和pyrin结构域蛋白3)炎性小体的激活以及随后IL-1β家族促炎细胞因子的分泌被认为与抵抗WNV感染有关[17]。研究显示,感染WNV的患者在发病过程中全身IL-1β水平增加,而缺乏IL-1β信号或NLRP3的小鼠更容易感染WNV[18]。感染机理为IL-1β利用朗格汉斯细胞向引流淋巴结迁移以及CD45+巨噬细胞和病毒特异性CD8+T细胞向WNV感染小鼠中枢神经系统迁移促进免疫细胞运输到WNV感染部位[19-20]。
IL-1β与Ⅰ型IFN信号通路之间通过相互干扰控制WNV感染,当选择性抑制IL-1β或IFN-β其一,只能抑制部分WNV的复制,而同时抑制两者后,神经元细胞几乎完全消除了WNV感染[21]。目前,这些途径如何在神经元细胞内(可能存在于其他细胞类型)聚合引起细胞的抗病毒作用机理尚未清楚,目前能够确定的是,对WNV的有效免疫反应可能依赖于IL-1β的保护功能和病理功能之间的平衡。
3 WNV的先天免疫逃避策略
随着进化演变,WNV已经衍生出对抗先天免疫的机制。针对RLRs途径,WNV主要通过被动逃避,掩盖或隔离病毒RNA,使其不被RLRs所识别。这种机制使得WNV能够顺利完成病毒粒子的组装与合成,并有助于其阻断下游信号通路的传导。
此外,WNV也被证实具有干扰Ⅰ型IFN表达的作用[22]。WNV非结构蛋白通过溶酶体和蛋白酶体依赖的途径介导IFNAR1的降解;WNV逃避IFN信号转导的其他策略包括将细胞胆固醇重新分配到病毒复制复合体的位置,从而改变膜相关信号转导以有利于病毒的复制及非编码亚基因组RNA的合成,后者已被确定为IFN拮抗剂[22-23]。目前已知的WNV结构与非结构蛋白(包括NS2A、NS2B、NS3、NS4A、NS4B及NS5)都被报道能够通过不同机制积极协助WNV逃逸IFIT1(IFIT1是一种ISG蛋白,被病毒感染诱导后高表达,在多条信号通路中发挥抗病毒作用)的抗病毒作用[24]。
4 WNV的免疫防控策略
目前尚没有WNV疫苗或批准的治疗方法用于人类预防或治疗WNV感染。由于WNV的出现和持续传播在世界各地造成重大的公共卫生风险,迫切需要制定干预战略。目前,WNV的研究主要集中在确定宿主信号成分和调节免疫感染的途径。这些研究揭示了感染细胞和组织内的调节节点,利用它们影响细胞和适应性免疫对WNV感染的某些特征反应,筛选出能够引起人体免疫反应的最佳抗原片段,为后期WNV疫苗开发奠定基础。
WNV主要在老年人中引起严重疾病,且年龄越大,免疫衰老和免疫反应性降低就越相关。要使WNV疫苗对老年人达到充分保护性,可能需要其能够诱导一种强大的、持久的保护性免疫反应。迄今为止,中和抗体是保护黄病毒感染的最可靠屏障之一。此外,WNV特异性T细胞同样发挥着重要的作用[17]。临床试验表明,WNV嵌合病毒候选疫苗可诱导WNV E蛋白特异性CD8+T细胞反应长达1年[25]。
通过对WNV感染和免疫过程的解析有利于探明宿主对病原体的免疫应答机制,包括先天性免疫防御、Ⅰ型干扰素抗病毒机制和免疫细胞介导的体液免疫控制机制。揭示这些机制为后续开发WNV特异性疫苗提供了重要的参考价值,但仍有几个问题有待解决。首先需要进一步确定细胞和组织特异性基因表达的环境依赖性功能以及编码蛋白的作用机制。其次,一些研究已经确定了介导免疫逃避的病毒因子,但作用机制尚不清楚。目前,特异性针对WNV的载体疫苗尚未开发出来,更多是通过切断传染源限制病毒的感染,因此研发WNV疫苗意义重大。
