羟基红花黄色素A对LPS诱导的羊子宫内膜上皮细胞炎性反应的抑制作用
2021-10-30段景龙宣超莹刘茂军马玉忠河北农业大学动物医学院河北保定0700江苏省农业科学院江苏南京004
段景龙,宣超莹,刘茂军,马玉忠* (.河北农业大学 动物医学院,河北 保定 0700;.江苏省农业科学院,江苏 南京 004)
近年来,我国羊养殖量越来越大[1],羊的各种疾病也随之而来,尤其是生殖类疾病[2]。子宫内膜炎是常见的羊生殖类疾病,该病发生的主要原因是当难产、流产及胎衣不下时病原菌侵入子宫[3]。导致子宫内膜炎发生的病原菌主要为大肠杆菌,脂多糖作为其主要活性成分在致病过程中发挥着重要作用[4-5]。目前常用的治疗子宫内膜炎的方法是抗生素和激素疗法,但抗生素的大量使用会造成耐药细菌的产生,并且抗生素残留会对人类健康造成不良影响,这给养羊业的健康发展、公共卫生及食品安全带来了巨大影响。因此,急需寻找一种安全高效且可保护子宫内膜的药物。羟基红花黄色素A(HYSA)是红花中最主要的水溶性成分,该成分属于查耳酮类化合物[6],具有抗炎等作用。研究发现,HYSA可以减弱香烟烟雾提取物对肺泡Ⅱ型上皮细胞的诱导作用,降低炎症因子IL-6、IL-1β和TNF-α在细胞上清的表达量[7]。本试验用脂多糖(LPS)构建羊子宫内膜上皮细胞炎性反应模型,用HYSA处理,探究其对LPS诱导的羊子宫内膜炎性上皮细胞的影响,以便为HYSA的临床应用提供理论依据。
1 材料与方法
1.1 实验动物2岁左右健康绵羊,体质量25~30 kg,来自河北农业大学实验动物中心。在温度16~28℃,相对湿度40%~60%条件下饲养。该研究经河北农业大学动物管理委员会批准实验。
1.2 主要试剂DMEM/F12培养基由Gibco公司提供;HYSA购自上海绿源生物科技有限公司;Hepes、CCK-8溶液和台盼蓝购自北京索莱宝科技有限公司;LPS购自Sigma公司;胎牛血清由杭州四季青公司提供;羊TNF-α、IL-1β和IL-6 ELISA试剂盒购自DG Biotech公司;p-JNK、p-p38抗体购自安诺伦(北京)生物科技有限公司。
1.3 羊子宫内膜细胞的原代培养在无菌条件下取羊子宫角,用含有双抗的PBS漂洗3次,去除结缔组织及脂肪,剖开子宫角,取子宫内膜,修剪成3 mm×3 mm×2 mm大小的组织块,放入6孔板内,于37℃、5% CO2条件下培养过夜。次日,加入2 mL 含有15% FBS的DMEM/F12,于37℃、5% CO2条件下培养,每2~3 d更换培养液1次,观察细胞生长状况,并在10 d左右去除组织块。
1.4 细胞传代待孔内细胞铺满培养板底的80%~90%时,去除培养基,每孔用2 mL PBS洗2次,每孔加入500 μL 0.25%的胰酶,于37℃消化2 min,当显微镜下观察到大部分细胞开始变圆、回缩、细胞间隙变大后,每孔加入1 mL含FBS的DMEM/F12培养基终止消化,刮取细胞,转移至细胞瓶中继续培养。
1.5 CCK-8法检测HYSA对子宫内膜上皮细胞活力的影响将处于对数生长期的子宫内膜上皮细胞消化下来并调整细胞浓度为1×105个/mL,按照100 μL/孔将细胞悬液接种于96孔板中,置于37℃、5% CO2的细胞培养箱中培养12 h。弃旧培养基,加入10,20,40,60,80,100 mg/L HYSA,每个质量浓度设5个重复,放入细胞培养箱培养12 h。每孔加入10 μL CCK-8,孵育2 h,用酶标仪测定450 nm 处的吸光度。
1.6 HYSA处理将子宫内膜上皮细胞稀释成5×105个/mL,按1 mL/孔将细胞悬液接种于24孔板中。随机分为5组:对照组、LPS处理组、60 mg/L HYSA处理组、80 mg/L HYSA处理组、100 mg/L HYSA处理组。待细胞铺满培养板底的80%~90%后,去除旧培养基,对照组加入新的培养液,其余各组加入50 mg/L LPS。12 h后,用60,80,100 mg/L HYSA处理12 h。
1.7 IL-1β、IL-6和TNF-α的含量检测收集24孔板内的细胞培养液,10 000 r/min离心5 min,收集上清液,检测炎症因子TNF-α、IL-1β和IL-6的含量。
1.8 Western blot法检测p-p38、p-JNK蛋白的表达提取总蛋白,测定蛋白浓度。取38 μg总蛋白,经12% SDS-PAGE分离,通过半干法转膜,用5%脱脂牛奶封闭,TBST洗膜,加入p-p38、p-JNK抗体(1∶1 000稀释),常温孵育2 h,用TBST洗膜,加入碱磷酶标记二抗(1∶2 000稀释),孵育1 h,用TBST洗膜,用BCIP/NBT显色。

2 结果
2.1 羊子宫内膜上皮细胞形态观察倒置显微镜下可见,培养9 d时,细胞呈离散型从组织块向周围爬出(图1A); 14 d时,细胞铺满整个孔底,多为上皮细胞和成纤维细胞(图1B);纯化后获得子宫内膜上皮细胞,呈铺路石状(图1C)。
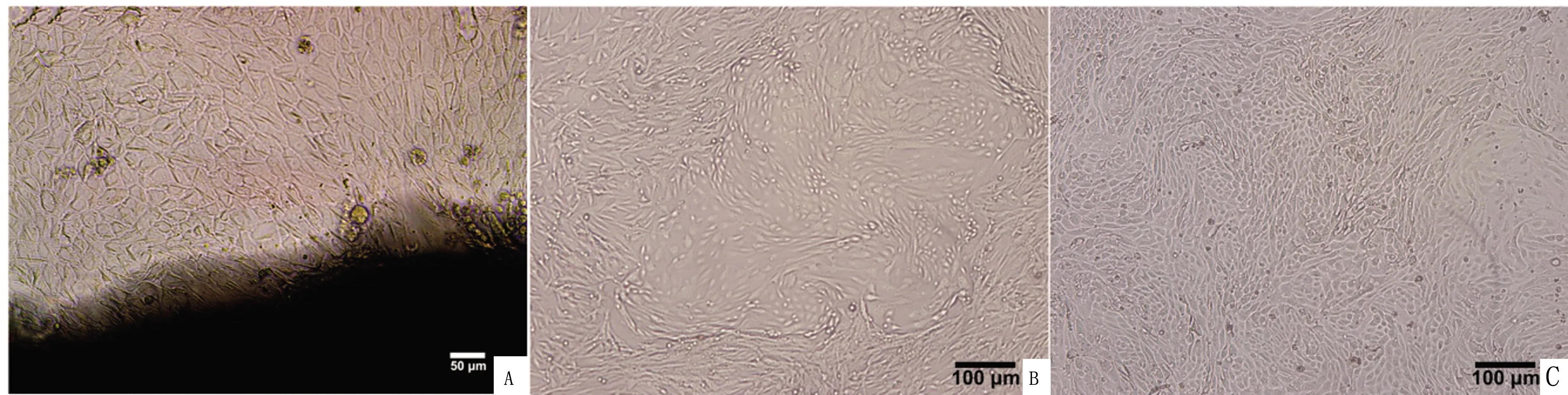
A.培养9 d时细胞从组织块迁出;B.培养14 d时的羊子宫内膜上皮细胞及成纤维细胞;C.纯化后的子宫内膜上皮细胞图1 羊子宫内膜上皮细胞形态
2.2 HYSA对羊子宫内膜上皮细胞增殖的影响如表1所示,通过CCK-8法检测发现,用10,20,40,60,80,100 mg/L HYSA处理12,24 h,对羊子宫内膜上皮细胞的生长均有促进作用(P<0.01),80 mg/L 时促进增殖的效果最好。子宫内膜上皮细胞经HYSA处理12 h的活力比24 h高,因此选用80 mg/L HYSA处理羊子宫内膜上皮细胞,时间为12 h。

表1 HYSA对子宫内膜上皮细胞增殖活力的影响 %
2.3 HYSA对LPS诱导的羊子宫内膜上皮细胞TNF-α、IL-1β和IL-6含量的影响如表2所示,用60,80,100 mg/L HYSA作用经LPS处理12 h的羊子宫内膜上皮细胞,12 h后,细胞上清中IL-β、IL-6和TNF-α的含量均有所下降,其中60,100 mg/L HYSA处理组的IL-1β、IL-6含量与模型组相比无显著性差异; 80 mg/L HYSA处理组的IL-1、IL-6含量与模型组相比显著降低(P<0.05);60,80,100 mg/L HYSA处理组的TNF-α含量与对照组相比极显著降低(P<0.01)。

表2 HYSA对子宫内膜上皮炎性细胞分泌IL-1β、IL-6和TNF-α的影响 ng/L
2.4 HYSA对LPS诱导的羊子宫内膜上皮细胞p-p38、p-JNK含量的影响利用 Western blot检测p-p38、p-JNK蛋白含量,结果见图2,与对照组相比,LPS 处理后p-p38、p-JNK蛋白水平显著升高(P<0.01),80,100 mg/L HYSA处理组的p-p38、p-JNK含量与模型组相比极显著降低(P<0.01);60 mg/L HYSA处理组p-JNK含量与模型组相比极显著降低(P<0.01),p-p38含量与模型组相比无显著变化。

*表示与模型组相比差异显著(P<0.05),**表示与模型组相比差异极显著(P<0.01);##表示与对照组相比差异极显著(P<0.01)图2 HYSA对LPS诱导的子宫内膜上细胞p-p38、p-JNK蛋白表达的影响
3 讨论
子宫内膜炎是常见的母羊生殖器官疾病,会影响母羊早期的妊娠,造成母畜的不孕[8]。引起子宫内膜炎发生的原因多种多样,主要原因是病原微生物入侵机体所致。大肠杆菌作为一种革兰阴性菌,是导致子宫内膜炎发生的主要致病菌之一[2]。革兰阴性菌细胞壁内的LPS在细菌死亡时会被释放,与Toll样受体4结合,激活机体免疫应答,诱导炎症因子IL-1β、IL-6和TNF-α的分泌,促使机体发生炎症[9]。研究发现,TNF-α是炎症早期产生的细胞因子,具有多种生物学活性,可以促进中性粒细胞黏附到上皮细胞,进而导致机体产生局部炎性反应[10]。IL-1β是一种致炎性因子,参与诱导炎症,可以促进黏附分子的分泌,且可以诱导IL-6的分泌[11]。IL-6是一种多效应细胞因子,在免疫应答中发挥重要作用,IL-6浓度的变化可以在一定程度上反映疾病的变化[12]。张兴云等[9]研究发现,藏羊子宫内膜上皮细胞经过大肠杆菌刺激后会导致炎性因子IL-1β、IL-6和TNF-α的分泌量增加。本试验中,用50 mg/L LPS刺激绵羊子宫内膜上皮细胞12后,IL-1β、IL-6和TNF-α的分泌量显著增加,说明绵羊子宫内膜上皮细胞发生炎症,炎症模型构建成功。
HYSA是一种重要的黄酮类化合物,是中药红花的重要成分,具有抗炎、抗肿瘤等功效[13]。张园等[14]对大鼠采取灌胃的方式饲喂HYSA,发现HYSA可降低心肌缺血再灌注损伤大鼠血清中炎性因子IL-6和TNF-α的水平,并降低了NF-κB蛋白的表达,减轻炎症反应,说明HYSA可以抑制心肌细胞炎症反应,减轻心肌细胞损伤。DONG等[15]采用腹腔注射HYSA治疗急性软组织损伤的小鼠,发现经过HYSA治疗后,小鼠血清中IL-1β、IL-6和TNF-α的含量降低,肌肉中p-p38 MAPK含量降低,说明HYSA可能通过抑制p38 MAPK的磷酸化,从而降低IL-1β、IL-6和TNF-α的表达[15]。本试验结果显示,HYSA可以降低炎症因子IL-1β、IL-6和TNF-α的分泌,在质量浓度为80 mg/L时,炎症因子IL-1β、IL-6和TNF-α含量与模型组相比显著降低,表明80 mg/L HYSA对LPS诱导的羊子宫内膜上皮细胞炎性反应的抑制作用最佳。
MAPK信号通路是哺乳动物体内重要的传导通路之一,它可被LPS激活,进而产生酶促级联反应,将刺激传递至细胞内引起生物学反应[16]。JNK、ERK、p38/MAPK信号通路是MAPK信号通路的组成部分。JNK、p38/MAPK信号通路与炎症相关。李金等[17]研究发现,白藜芦醇可以抑制p-JNK、p-p38蛋白的活化,降低RAW264.7细胞的炎性反应。本试验结果表明,HYSA可以降低p-JNK、p-p38蛋白的表达,说明HYSA可以降低p-JNK/MAPK、p-38/MAPK信号通路的活化,从而抑制炎性反应进程。
