PCV2/PCV3二价重组杆状病毒疫苗的构建与鉴定
2021-10-30姜宇航宋利娜李乐天郝鹏飞金宁一任林柱吉林大学动物科学学院吉林长春13006中国医学科学院人兽共患病毒病防控关键技术研究创新单元中国农业科学院长春兽医研究所吉林长春1301
徐 鹏,姜宇航,许 汪,宋利娜,李乐天,陈 竞,郝鹏飞,金宁一,任林柱,李 昌* (1.吉林大学 动物科学学院,吉林 长春 13006;.中国医学科学院 人兽共患病毒病防控关键技术研究创新单元,中国农业科学院 长春兽医研究所,吉林 长春 1301)
猪圆环病毒(porcine circovirus,PCV)为单链环状无囊膜DNA病毒,属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),是迄今为止发现的最小动物病毒之一[1]。目前PCV分为PCV1、PCV2、PCV3和PCV4共4个基因型。PCV1是在PK-15细胞中被发现的,不具有致病性[2]。PCV2于1991年在患有断奶仔猪多系统衰竭综合征(PMWS)和猪皮炎与肾病综合征(PDNS)的病猪中被发现,具有较强致病性与传染性[3]。2016年,在美国发现的PCV3同样可以引起PMWS、PDNS等猪圆环病毒相关疾病(porcine circovirus associated diseases,PCVAD),具有致病性。2019年,周继勇团队在湖南省患有呼吸道、消化道疾病和PDNS的猪群中首次发现一种新型猪圆环病毒——PCV4,其与PCV1~3型具有明显的遗传差异[5-6]。
PCV2全基因组的大小为1 767 bp或1 768 bp,具有11个开放阅读框(ORF)[4]。其中ORF2负责编码病毒的衣壳蛋白(Cap),是病毒的主要抗原决定簇。PCV2是引起PCVAD的重要病原之一,患猪主要症状为消瘦、黄疸、贫血、皮肤苍白[3],还可以导致仔猪产生PMWS,引起大量死亡,死亡率最高可达30%[7],给我国养猪业造成巨大经济损失。PCV3基因组全长约为2 000 bp,含有3个开放阅读框,其中ORF2编码的衣壳蛋白(Cap)是主要的结构蛋白与抗原决定簇[8]。PCV3感染的猪多会出现腹下黑斑、产死胎或木乃伊胎[9],但种猪采食量和精神状态良好,保育猪多发生混合感染,主要症状为精神状态极差、高烧、扎堆、腹式呼吸等[9-10],发病严重的猪场死亡率超过15%,给养殖业造成一定的经济损失[10]。
当前,PCV2与PCV3引起的PCVAD对世界各国的养猪业构成威胁,由于这2种圆环病毒具有相似的病理特征与免疫抑制的特点,常常存在混合感染,严重威胁全球养猪业的发展。目前,市场上存在针对PCV2的多种不同类型疫苗,例如灭活疫苗、亚单位疫苗、重组杆状病毒灭活疫苗等,但是对于新发现的PCV3,由于该病毒的病原学研究尚不明确,国内外尚未有PCV3疫苗临床审批与上市的报道。
病毒样颗粒(virus-like particles,VLPs)是一类由病毒的部分或全部结构蛋白自动组装成的,具有与天然病毒结构基本一致的空心蛋白颗粒[11],不具有病毒的遗传物质,不能自主复制,作用于机体后能够引起机体产生类似于天然病毒感染的免疫应答反应[12]。因其具有免疫原性良好、安全性较高等特点,目前已成为研制预防人或动物病毒性感染疾病潜在的安全高效的候选疫苗之一[13]。为此,本研究以PCV2、PCV3为研究对象,利用杆状病毒表达系统构建可同时表达PCV2 Cap与PCV3 Cap的VLPs疫苗,可用于同时预防PCV2、PCV3引起的疫病,具有重要现实和临床意义。
1 材料与方法
1.1 材料含有目的基因PCV2 Cap及PCV3 Cap的质粒、DH10 Bac大肠杆菌感受态、Sf9细胞(贴壁与悬浮)由军事医学研究院军事兽医研究所分子病毒学与免疫学实验室合成并保存;T4DNA Ligase,Color Prestained Protein Standard Broad Range购自NEB公司;DL5000 DNA Marker、Trans5α感受态细胞购自TaKaRa公司;胶回收试剂盒购自BioFluX公司; TransStartFastPfu Fly Polymerase、pEASY-Blunt Simple购自北京全式金生物有限公司;胎牛血清(FBS)、青-链霉素溶液购自Gibco公司;Anti-6×His tag、HA tag抗体购自Abcam公司;pFastBacTMDual双载体、EcoRⅠ、NotⅠ、XhoⅠ、KpnⅠ限制性内切酶购自Thermo Scientific公司;BSA、PBS、IPTG、X-gal购自索莱宝公司;DAPI、Western blot及IP用细胞裂解液、HRP-山羊抗鼠IgG、HRP-山羊抗兔IgG、FITC标记山羊抗鼠IgG、Cy3标记山羊抗兔IgG购自碧云天生物技术公司。
1.2 引物设计与合成参考PCV2和PCV3的Cap基因设计引物,由吉林省库美生物科技有限公司合成。扩增PCV2 Cap基因的引物上游添加了NotⅠ酶切位点和HA标签,下游添加了HindⅢ酶切位点;扩增PCV3-Cap基因的引物上游添加了XhoⅠ酶切位点与His标签,下游添加了KpnⅠ酶切位点。引物相关信息见表1。

表1 PCV2和PCV3的Cap基因扩增引物相关信息
1.3 Cap基因的扩增与重组穿梭质粒的构建分别以含有PCV2 Cap、PCV3 Cap基因的质粒为模板,用相应引物扩增目的基因,PCV2-Cap扩增条件:95℃ 5min;95℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 5 min。PCV3-Cap扩增条件:95℃ 5 min;95℃ 30 s,65℃ 30 s,72℃ 30 s,35个循环;72℃ 5 min。通过1%琼脂糖凝胶电泳分离PCR产物,回收目的片段,将之克隆至pEASY-Blunt载体,并转化至Trans5α感受态细胞,涂布于氨苄抗性的LB固体平板上,37℃倒置培养12 h。挑取单克隆菌株至氨苄抗性的LB培养基中,振荡培养12 h后提取质粒,分别用HindⅢ和NotⅠ、XhoⅠ和KpnⅠ进行双酶切鉴定,对酶切正确的质粒进行测序鉴定,鉴定正确的质粒分别命名为pEPC2、pEPC3。
将含有PCV2 Cap基因的质粒pEPC2与pFBD-Dual载体分别用HindⅢ和NotⅠ进行双酶切,回收目的基因片段和载体片段,通过T4DNA连接酶过夜连接,获得含有PCV2 Cap基因的pFBD-Dual质粒(pFBD-PCV2)。用XhoⅠ和KpnⅠ酶切pEPC3,回收目的基因片段PCV3 Cap,将其克隆至pFBD-PCV2,得到重组穿梭质粒pFBD-PC2-PC3。将重组穿梭质粒转化到Trans5ɑ感受态细胞,过夜培养后提取质粒,分别用HindⅢ和NotⅠ、XhoⅠ和KpnⅠ、HindⅢ和KpnⅠ进行双酶切鉴定。
1.4 重组杆粒的制备将质粒pFBD-PC2-PC3转化到DH10BacTM感受态细胞,涂布于含有四环素(10 mg/L)、硫酸卡纳霉素(50 mg/L)、庆大霉素(7 mg/L)、IPTG/X-Gal的蓝白斑筛选平板上,37℃倒置培养48 h。挑取白色菌落加入SOC培养基中,37℃振荡培养3 h,按照表1所示通用引物(pUC/M13-F,p10R;pHF,pUC/M13R)进行菌液PCR鉴定,选取鉴定正确的菌株扩增后提取杆粒,命名为Bacmid-PC2-PC3。
1.5 重组杆状病毒的拯救接种Sf9贴壁细胞至6孔板中,27℃培养12 h后,更换原培养基为1 mL Grace's培养基。使用Grace's培养基稀释阳性重组杆粒Bacmid-PC2-PC3(3 μg)和PEI(4 μL),轻轻混匀,静置20 min后加入6孔板。27℃静置培养6 h,更换培养基为含有10% FBS、1%双抗的SF-900Ⅱ培养基。于27℃静置培养,每天观察细胞状态,待60%细胞出现病变(CPE)时,收取上清液为第1代重组杆状病毒,用其继续感染Sf9细胞,并传至第3代,命名为rBV-PC2-PC3。
1.6 Western blot验证PCV2、PCV3 Cap蛋白在Sf9细胞中的表达低速离心收集感染rBV-PC2-PC3的SF9细胞,使用细胞裂解液裂解细胞并进行超声破碎,12 000 r/min离心3 min,收取上清液。SDS-PAGE后,转印至NC膜上,以1∶1 000稀释的Anti-6× His tag及HA tag为一抗,1∶5 000稀释的HRP山羊抗鼠IgG及山羊抗兔IgG为二抗,进行Western blot鉴定。
1.7 间接免疫荧光(IFA)鉴定PCV2、PCV3 Cap蛋白的表达取生长状态良好的Sf9贴壁细胞均匀铺入6孔板,待细胞增殖至培养面积的70%,每孔接种10 μL重组杆状病毒rBV- PC2-PC3,27℃培养48 h后弃掉培养基,用4%甲醛固定液固定30 min,用0.1% Trion X-100透化处理10 min,5%脱脂乳封闭1 h;加入1∶1 000稀释的Anti-6× His tag与HA tag抗体,孵育2 h;加入1∶1 000稀释的FITC-标记的山羊抗鼠IgG与Cy3标记的山羊抗兔IgG,避光孵育1 h;加入1∶1 000稀释的DAPI,避光孵育4 min,用荧光显微镜观察。每步操作结束均使用PBST清洗3次。
1.8 电镜观察用rBV-PC2-PC3感染悬浮的Sf9细胞,27℃培养4 d即60%细胞出现明显CPE时,收取细胞沉淀,超声破碎后通过蔗糖密度梯度超速离心获得浓缩样品,1%磷钨酸负染3 min后进行电镜观察。
2 结果
2.1 Cap基因的扩增使用特异性引物进行PCV2与PCV3 Cap基因的扩增,扩增得到750 bp(PCV2 Cap)与 680 bp(PCV3 Cap)的目的条带(图1A),与预期大小一致。分别回收目的片段并克隆至pEASY-Blunt载体,用限制性内切酶NotⅠ和HindⅢ、KpnⅠ和XhoⅠ分别进行双酶切,酶切产物电泳后可见750 bp(PCV2 Cap)与680 bp(PCV3 Cap)左右的条带,与预期大小一致(图1B)。对酶切鉴定正确的质粒进行DNA序列测定,结果显示,扩增所得的目的片段与原序列完全一致,表明成功获得目的基因。
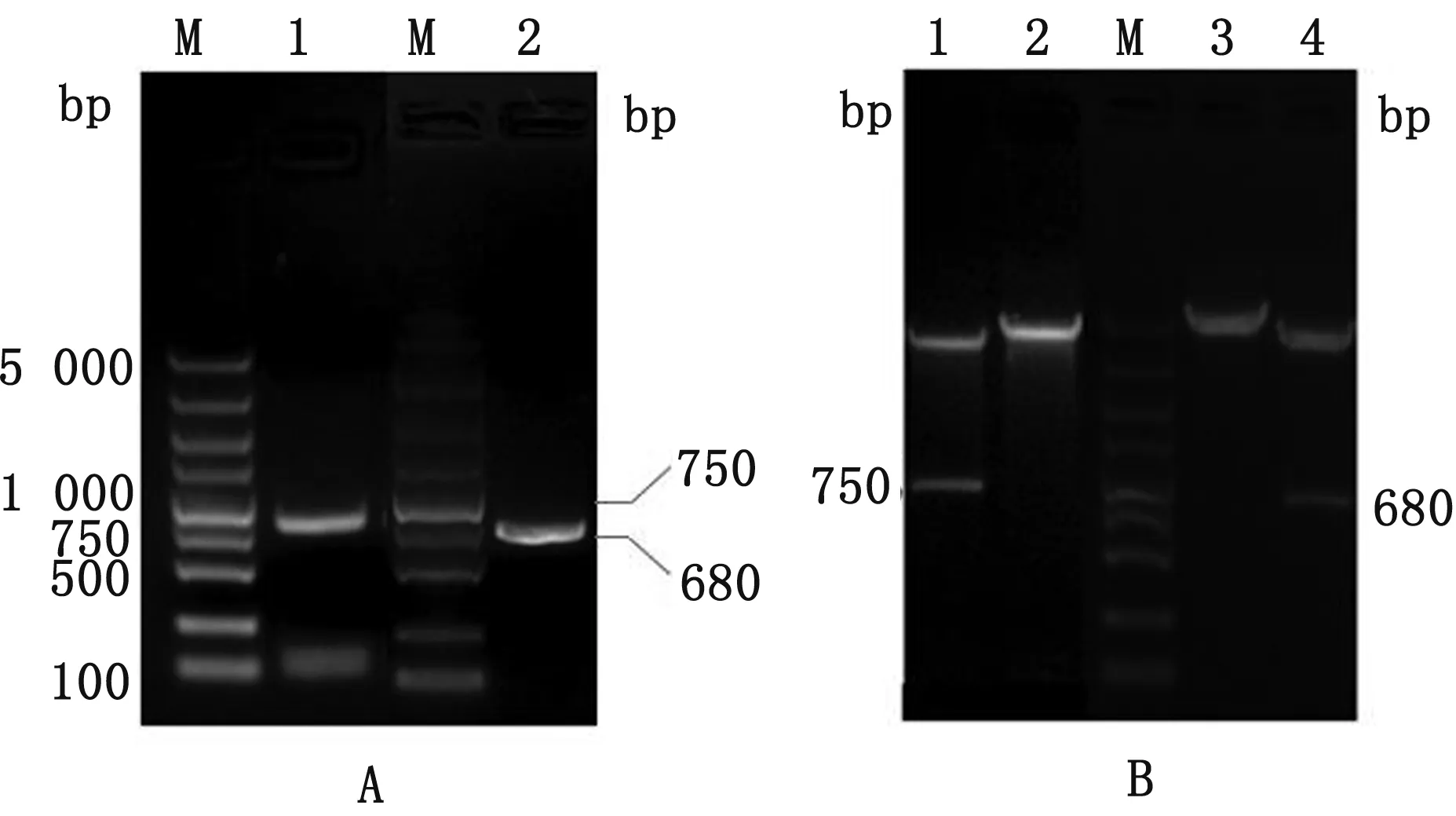
A.Cap基因PCR产物电泳结果(M.DL5000 DNA Marker;1.PCV2 Cap PCR产物;2.PCV3 Cap PCR产物);B.重组质粒酶切鉴定结果(M.DL5000 DNA Marker;1.重组质粒HindⅢ和NotⅠ酶切产物;2.pEPC2 Cap重组质粒;3.pEPC3 Cap重组质粒;4.XhoⅠ和KpnⅠ酶切产物)图1 Cap基因PCR扩增及重组质粒的酶切鉴定
2.2 重组穿梭质粒的构建将含有PCV2 Cap与PCV3 Cap基因的质粒及杆状病毒穿梭表达载体pFBD-Dual分别用相应的酶进行酶切,并依次连接到pFBD-Dual上,构建含有PCV2 Cap基因与PCV3 Cap基因的穿梭质粒pFBD-PC2-PC3(图2A)。酶切鉴定结果如图2B所示,质粒pFBD-PC2-PC3能够分别切出单个基因片段(PCV2 Cap/NotⅠ+HindⅢ、PCV3 Cap/XhoⅠ+KpnⅠ)及含有2个基因的片段(PCV2 Cap-PCV3 Cap/Hind Ⅲ+KpnⅠ),表明重组穿梭质粒构建成功。

A.穿梭质粒pFBD-PC2-PC3结构示意图;B.pFBD-PC2-PC3酶切鉴定(M.DL5000 DNA Marker;1.重组质粒;2.XhoⅠ+KpnⅠ;3.NotⅠ+HindⅢ;4.HindⅢ+KpnⅠ)图2 重组穿梭质粒pFBD-PC2-PC3结构示意图与酶切鉴定
2.3 重组杆粒的鉴定使用通用引物(pUC/M13-F+p10R;pHF+pUC/M13R)对菌液进行PCR鉴定,结果如图3所示,引物 pUC/M13-R、pHF扩增得到1 500 bp左右的条带,引物pUC/M13-F、p10R扩增得到2 400 bp左右条带,与预期结果一致,表明重组杆粒Bacmid-PC2-PC3构建成功。
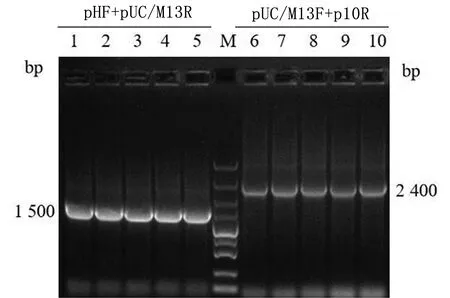
M.DL5000 DNA Marker;1~5.重组穿梭质粒pFBD-PC2-PC3的菌液PCR验证(pHF+pUC/M13-R);6~10.重组穿梭质粒pFBD-PC2-PC3的菌液PCR验证(pUC/M13-F+p10R)图3 重组穿梭质粒pFBD-PC2-PC3的菌液PCR鉴定
2.4 重组杆状病毒的拯救用重组杆粒Bacmid-PC2-PC3转染Sf9贴壁细胞产生第1代杆状病毒,转染后48 h,与正常未转染细胞(图4A)相比,Sf9细胞开始出现细胞变圆、体积变大、细胞数目减少、细胞核明显增大等现象(图4B);转染后120 h出现典型CPE现象,大部分细胞破裂,死亡(图4C);表明重组杆状病毒rBV-PC2-PC3拯救成功。
2.5 Western blot验证PCV2、PCV3 Cap蛋白在Sf9细胞中的表达用rBV-PC2-PC3接种Sf9贴壁细胞,盲传3代后,待细胞出现大约60%病变时收集细胞进行裂解,收取蛋白质上清,经SDS-PAGE后,用鼠源Anti-6×His-tag与兔源Anti-HA作为一抗进行Western blot分析。结果显示,PCV2 Cap大小为28 kDa(图5A),PCV3 Cap大小为 24 kDa(图5B),与理论值相符,而对照细胞没有条带,进一步表明PCV2-PCV3 Cap在Sf9贴壁细胞成功表达并具有反应原性。

A.正常的Sf9细胞;B.转染后48 h;C.转染后120 h图4 重组杆状病毒的拯救(200×)

A.PCV2 Cap蛋白表达鉴定 (M.蛋白Marker;1.Sf9细胞;2.Anti-6×His-tag抗体检测重组蛋白);B.PCV3 Cap蛋白表达鉴定(M.蛋白Marker;1.Sf9细胞;2.Anti-HA抗体检测重组蛋白)图5 重组蛋白的鉴定
2.6 PCV2、PCV3 Cap蛋白表达的IFA鉴定利用鼠源Anti-6×His-tag抗体与兔源Anti-HA-tag抗体,通过IFA检测Cap蛋白的表达。结果显示,正常Sf9细胞未出现特异性荧光(图6A),而感染重组病毒rBV-PC2-PC3的Sf9细胞出现特异性荧光,带有His-tag标签的PCV3表现为绿色荧光(图6B、E、F),带有HA-tag标签的PCV2表现为红色荧光(图6C、E、F),在同一细胞中共同表达呈浅紫色荧光(图6F),表明外源Cap基因在杆状病毒中成功表达。

图6 IFA鉴定Cap蛋白的表达(200×)
2.7 VLPs的电镜观察透射电子显微镜下观察经蔗糖密度梯度离心的样品,可见大量大小为20 nm左右的VLPs,呈现正二十面体结构,表面光滑、无凸起,符合PCV的基本形态特征(图7)。

图7 rBV-PC2-PC3 VLPs颗粒形态
3 讨论
PCV1最早于1974年在PK15细胞中被发现[14];PCV2是引起PMWS的主要病原之一,具有较强的致病性[15]。2016年,PALINSKI等[16]借助宏基因组测序技术从暴发PDNS疫情的美国某商品化猪场的患病猪中发现了一种新病毒,根据该病毒的基因组结构和遗传特性将其归类为新型圆环病毒,并命名为PCV3。PCV4在患有呼吸系统疾病、腹泻和PDNS的猪中被鉴定,表明PCV4可能对养猪业构成潜在威胁[4]。
Cap蛋白作为PCV2、PCV3的重要结构蛋白,同时也是病毒的抗原决定簇,是进行新型疫苗研究的首选蛋白。针对PCV2的商业化疫苗来说,国内外大多研制的是亚单位疫苗,即采用杆状病毒表达系统或原核表达系统表达的Cap蛋白与佐剂混合制成有免疫效力的疫苗[19-20]。此外,还有一小部分是PCV2全基因组灭活疫苗与嵌合病毒疫苗。随着分子生物学的不断发展,目前出现了多种基因工程疫苗,比如利用其他表达系统的亚单位疫苗,如LIU等[21]利用腺病毒共表达PCV2 Cap蛋白与猪γ干扰素,免疫小鼠后可产生较强免疫效力;CHI等[22]利用重组伪狂犬病病毒表达PCV2 Cap的VLPs免疫小鼠和豚鼠后均能使其产生针对性的特异性抗体;以及具有很好免疫效果PCV1-2嵌合疫苗。此外,还有一些处于实验室研究阶段的核酸疫苗,如SYLLA等[23]构建了Cap蛋白的重组质粒pEGFP-Cap,并将其免疫BLAB/c小鼠,使其产生大量抗Cap蛋白特异性抗体,且IFN-γ和IL-10等细胞因子的表达水平也显著升高;以及可用于区别自然感染和疫苗免疫的重组标记疫苗[24]。目前针对基于PCV3 Cap的疫苗只有通过杆状病毒表达系统制备出来的亚单位疫苗,如王俊伟[25]对PCV3 Cap蛋白进行设计,利用杆状病毒表达系统成功表达出分泌型Sc蛋白与核定位Pc蛋白,且成功构建了具有感染力的VLPs,用其免疫均可引起体液免疫与细胞免疫。
由于杆状病毒对外源蛋白的良好承载能力以及可产生类似于天然病毒结构的VLPs,所以本试验使用杆状病毒表达系统的双表达核载体对PCV2、PCV3 Cap进行同时表达,做到使用一支疫苗可同时针对于2种病毒进行免疫,降低了疫苗的生产成本。
本研究分别将PCV2、PCV3 Cap插入双表达杆状病毒载体上,获得穿梭质粒,并通过蓝白斑筛选获得杆粒Bacmid-PC2-PC3,通过脂质体转染的方法将杆粒转染Sf9昆虫细胞,成功获得具有感染力的杆状病毒rBV-PC2-PC3。将其感染Sf9细胞后,通过IFA和Western blot结果证明,利用昆虫表达系统表达了具有良好抗原性的PCV2、PCV3 Cap蛋白,所表达的蛋白相对分子质量约28 kDa与24 kDa,成功获得重组杆状病毒rBV-PC2-PC3的VLPs,可为后续研究提供借鉴。
