一种可视化双重荧光RT-LAMP方法鉴别不同毒力新城疫病毒
2021-10-30曾婷婷谢丽基谢芝勋罗思思黄娇玲张民秀张艳芳邓显文广西壮族自治区兽医研究所广西南宁530001
曾婷婷,谢丽基,谢芝勋,罗思思,李 孟,黄娇玲,张民秀,张艳芳,范 晴,邓显文 (广西壮族自治区兽医研究所,广西 南宁 530001)
新城疫(Newcastle disease,ND)是由中等毒力或强毒力的新城疫病毒(Newcastle disease virus,NDV)引起的高传染性、高致病性和高致死性的传染病。NDV可以感染超过250种禽类和鸟类[1],根据全基因组遗传进化分析,NDV被划分为ClassⅠ和ClassⅡ两大分支[2],目前引起发病的NDV绝大多数是ClassⅡNDV。世界动物卫生组织(OIE)根据NDV的3个致病指数,将NDV划分为速发型、中发型和缓发型毒株[3],即通俗称的强毒、中等毒和弱毒。决定NDV毒力的主要基础是F蛋白的前体F0蛋白能否被宿主蛋白酶裂解,所以F0蛋白裂解位点所对应的核苷酸序列可作为判断NDV毒力的分子标志[3]。目前,已有研究者建立了针对这个位点的不同的分子生物学鉴别检测方法,如RT-PCR[4]及qRT-PCR方法[5]等。环介导等温扩增(loop-mediated isothermal amplification,LAMP)是NOTOMI等[6]发明的等温扩增技术,具有使用仪器简单、检测结果可视化、反应时间短等优势,在各种疾病检测中得到了广泛的应用。本研究将分子信标引入LAMP反应体系,设计了一套能同时扩增ClassⅡNDV不同基因型F基因的LAMP引物,同时设计2条针对不同毒力NDV F0蛋白裂解位点对应核苷酸序列的分子信标,建立了一套能够通过反应后观测荧光信号判断NDV毒力的双重荧光RT-LAMP检测方法。
1 材料与方法
1.1 病毒株本实验使用病毒株均为本实验室保存,具体见表1。
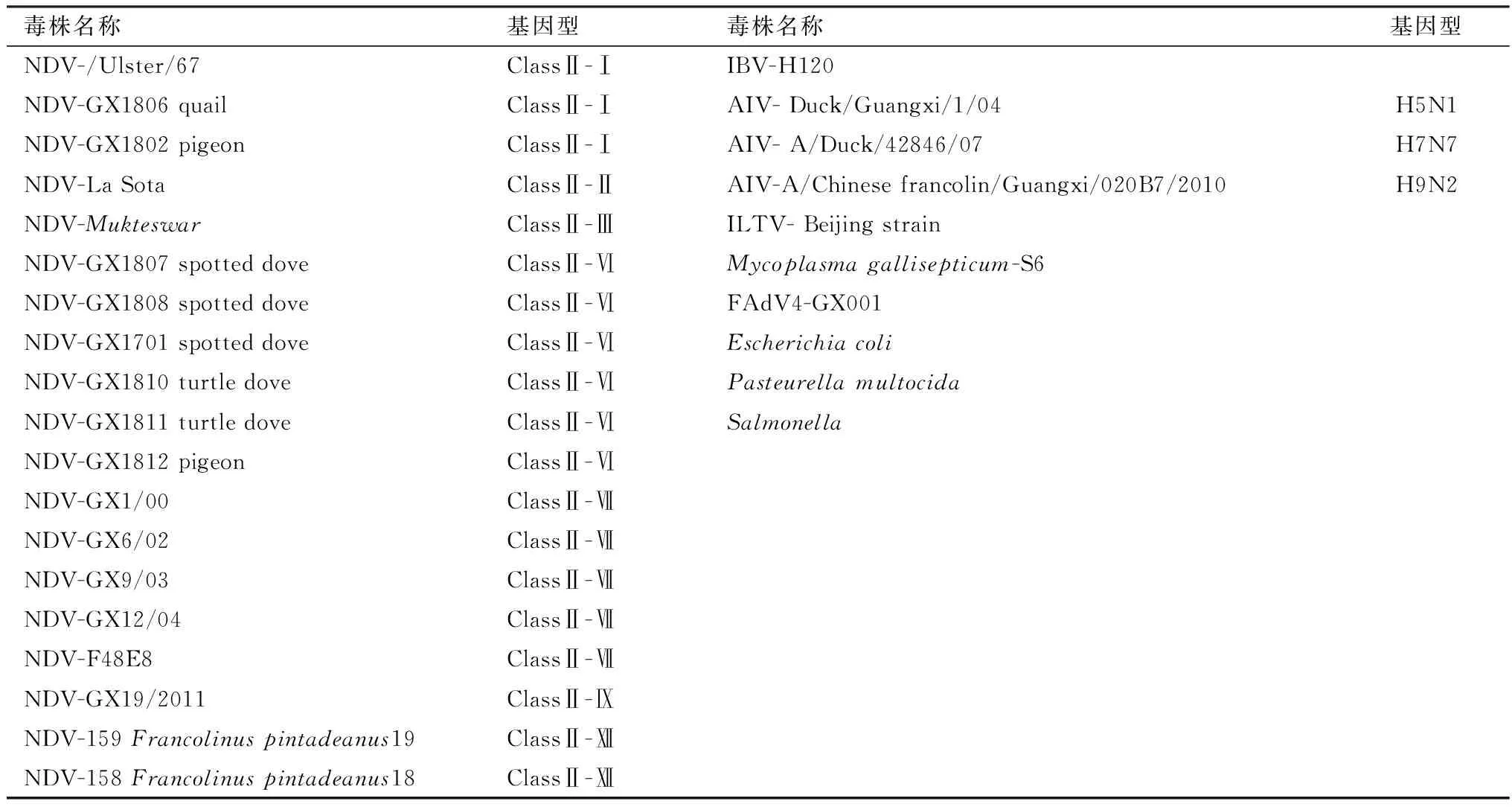
表1 毒株信息
1.2 主要试剂与仪器EasyPure®Viral DNA/RNA Kit,EasyPure®Quick Gel Extraction Kit,EasyScript®One-Step RT-PCR SuperMix购自北京全式金生物技术有限公司;RT-LAMP试剂盒WarmStart®LAMP Kit (DNA & RNA) 购自美国New England Biolabs(NEB)公司;体外转录试剂盒RiboMAXTMLarge Scale RNA Production Systems购自美国 Promega公司;超微量分光光度计NanoDrop 2000购自美国Thermo Fisher Scientific公司;LA-320c LAMP实时浊度仪购自北京蓝谱生物科技有限公司;多通道荧光成像仪ChemiDoc XRS+ Imager购自美国BIO-RAD公司。
1.3 引物设计使用MEGA X软件比对不同毒力ClassⅡ NDV的 F基因,选取F基因1~600 bp片段,使用LAMP引物在线设计网站http://primerexplorer.jp/e/v4_manual/index.html进行通用引物设计。使用探针在线设计网站http://bioinfo.ut.ee/primer3-0.4.0/设计探针,在探针左右两端加上茎环序列,形成分子信标。中等、强毒NDV分子信标的5′端标记FAM荧光基团,3′端标记Dabcyl淬灭基团;弱毒NDV分子信标的5′端标记CY5荧光基团,3′端标记BHQ3淬灭基团。
1.4 核酸提取及质粒标准品构建按照核酸提取试剂盒说明书提取NDV毒株及其他毒株的RNA/DNA。使用引物(F:5′-ACTCAATCTATCTGTCGGGCTCA-3′,R:5′-GGCATTCTGGTTGGCTTGTAT-3′)对NDV毒株La Sota和F48E8进行RT-PCR扩增,回收片段后与pMD18-T载体连接,构建质粒后经过SpeⅠ酶切、线性化之后体外转录为ssRNA,测量浓度后计算拷贝数,并保存于-80℃ 备用。
1.5 RT-LAMP方法建立将LAMP引物稀释并合并为引物混合物,各引物浓度:F3 5 μmol/L,B3 5 μmol/L,FIP 40 μmol/L,BIP 40 μmol/L,Floop 20 μmol/L,Bloop 20 μmol/L。RT-LAMP反应体系:2×RT-LAMP mix 12.5 μL,引物各1 μL,模板RNA 1~2 μL,用ddH2O补足25 μL。分别用浊度仪和水浴锅同时进行反应。由于商品化RT-LAMP试剂盒已将各种反应底物优化至最优,因此本试验仅进行反应温度的优化。分别将NDV La Sota和F48E8体外转录的ssRNA片段浓度调整为106copies/μL作为模板,进行单重和双重RT-LAMP反应。单重RT-LAMP反应的模板量为La Sota和F48E8 ssRNA各1 μL,分别加入不同反应管;双重RT-LAMP反应的模板量为La Sota和F48E8 ssRNA各1 μL,加入同一反应管。温度设置为60~70℃,每个反应升高1℃,反应时间为60 min,扩增结束后80℃、5 min终止反应,通过浊度仪观测反应起始时间和反应产物的生成效率。
1.6 分子信标的浓度优化在最佳反应温度下,在反应体系中添加分子信标,于0.001~1.000 μmol/L优化工作浓度,使用荧光成像仪观测,使反应后阳性结果荧光强度足够强,阴性结果荧光强度足够弱。
1.7 特异性试验和临床样品检测分别使用表1中的各毒株进行RT-LAMP反应,验证本方法的特异性。随机选取本实验室2017-2018年在广西活禽市场进行NDV流行病学调查采集的拭子样品,提取RNA通过RT-LAMP进行检测,结果与前期的F基因测序结果互相验证。
1.8 敏感性试验和干扰试验将La Sota和F48E8体外转录的ssRNA 10倍梯度稀释为1×107~1×101copies/μL,分别进行单重和双重RT-LAMP反应,单重RT-LAMP反应的模板量为La Sota或F48E8 ssRNA 1 μL,双重RT-LAMP反应的模板量为同浓度的La Sota和F48E8 ssRNA各1 μL。将不同浓度的La Sota和F48E8 ssRNA混合进行双重RT-LAMP反应,检测不同浓度的模板对反应体系效果的影响。浓度组合分别为La Sota 1×106copies/μL,F48E8 1×102copies/μL;La Sota 1×102copies/μL,F48E8 1×106copies/μL;La Sota 1×107copies/μL,F48E8 1×103copies/μL;La Sota 1×103copies/μL,F48E8 1×107copies/μL。以上每个组合的每种模板各1 μL。
2 结果
2.1 引物设计使用LAMP引物在线设计网站和探针在线设计网站,获得一套通用引物和分子信标。LAMP引物在单核苷酸多态性丰富的区域采用了简并碱基,分子信标位于F0蛋白裂解位点对应的核苷酸位点,根据该位点的碱基组合方式,针对强毒、弱毒NDV各设计了2条分子信标,相关信息见表2。

表2 LAMP引物及分子信标信息
2.1 RT-LAMP反应温度及分子信标浓度优化观测不同温度的反应起始时间,结果显示,在65℃时,浊度仪检测到单重和双重RT-LAMP反应对模板的扩增起始时间最早,扩增效率最高。通过添加不同工作浓度的分子信标,反应结果如图1显示,分子信标的工作浓度为0.2 μmol/L时,可获得最优的观测结果。反应后使用荧光成像仪在FAM通道下,强毒为绿色,弱毒无色;在CY5通道下,弱毒为红色,强毒无色。双重RT-LAMP则2个通道都显色,2个通道合并后为黄色,阴性对照则在2个通道下均为无色。

第1排.FAM通道;第2排.CY5通道;第3排.2个通道合并。1~8.阳性对照;9~16.阴性对照。分子信标浓度:1,9.0.8 μmol/L;2,10.0.6 μmol/L;3,11.0.4 μmol/L;4,12.0.2 μmol/L;5,13.0.1 μmol/L;6,14.0.05 μmol/L;7,15.0.025 μmol/L;8,16.0.01 μmol/L图1 不同浓度分子信标的荧光成像图
2.2 特异性试验和临床样品检测以表1中毒株的RNA/DNA为模板进行RT-LAMP反应,检测反应的特异性,结果如图2显示,在浊度仪下,NDV毒株均有扩增,其他病原无扩增;在荧光成像仪下,NDV毒株C/Ulster/67、GX1806quail、GX1802pi-geon和La Sota均只显示红色荧光,其余NDV毒株只显示绿色荧光,其他病原无荧光产生,证明本检测方法可特异性鉴别检测不同毒力NDV。随机选取20份本实验室2017-2018年在广西活禽市场对各种活禽进行NDV流行病学调查时采集的拭子样品[7-8]通过RT-LAMP检测,结果显示,RT-LAMP检测结果与通过对样品进行NDV分离鉴定和分离株F基因测序后推导的强弱毒株结果一致。混合感染不同基因型的样品均能同时显示出2种荧光(图3)。

A.浊度仪观测NDV毒株特异性试验(1.NDV-/Ulster/67;2.NDV-GX1806 quail;3.NDV-GX1802 pigeon;4.NDV-La Sota;5.NDV-Mukteswar;6.NDV-GX1807 spotted dove;7.NDV-GX1808 spotted dove;8.NDV-GX1701 spotted dove)。B.浊度仪观测NDV毒株特异性试验(1.NDV-GX1810 turtle dove;2.NDV-GX1811 turtle dove;3.NDV-GX1812 pigeon;4.NDV-GX1/00;5.NDV-GX6/02;6.NDV-GX9/03;7.NDV-GX12/04;8.NDV-F48E8)。C.浊度仪观测NDV毒株和其他常见禽类病原体特异性试验(1.NDV-GX19/2011;2.NDV-159 Francolinus pintadeanus19;3.NDV-158 Francolinus pintadeanus18;4.IBV-H120;5.AIV- Duck/Guangxi/1/04;6.AIV-A/Duck/42846/07;7.AIV-A/Chinese Francolin/Guangxi/020B7/2010;8.ILTV-Beijing strain)。D.浊度仪观测NDV毒株和其他常见禽类病原体特异性试验(1.Mycoplasma gallisepticum-S6;2.FAdV4-GX001;3.Escherichia coli;4.Pasteurella multocida;5.Salmonella;6.阴性对照)。E.荧光成像仪观测NDV毒株和其他常见禽类病原体特异性试验(1.NDV-/Ulster/67;2.NDV-GX1806 quail;3.NDV-GX1802 pigeon;4.NDV-La Sota;5.NDV-Mukteswar;6.NDV-GX1807 spotted dove;7.NDV-GX1808 spotted dove;8.NDV-GX1701 spotted dove;9.NDV-GX1810 turtle dove;10.NDV-GX1811 turtle dove;11.NDV-GX1812 pigeon;12.NDV-GX1/00;13.NDV-GX6/02;14.NDV-GX9/03;15.NDV-GX12/04;16.NDV-F48E8;17.NDV-GX19/2011;18.NDV-159 Francolinus pintadeanus19;19.NDV-158 Francolinus pintadeanus18;20.IBV-H120;21.AIV- Duck/Guangxi/1/04;22.AIV- A/Duck/42846/07;23.AIV- A/Chinese Francolin/Guangxi/020B7/2010;24.ILTV- Beijing strain;25.Mycoplasma gallisepticum-S6;26.FAdV4-GX001;27.Escherichia coli;28.Pasteurella multocida;29.Salmonella;30.阴性对照)图2 特异性试验

1~23.拭子样品;24.阴性对照图3 双重荧光RT-LAMP检测活禽拭子样品
2.3 敏感性试验和干扰试验La Sota和F48E8体外转录的ssRNA原始浓度分别为2.1×107copies/μL 和2.3×107copies/μL,将它们的浓度都调整为1×107copies/μL后,10倍梯度稀释至1×107~1×101copies/μL。单重RT-LAMP结果如图4显示,对La Sota和F48E8 ssRNA模板的最低检测量均为100 copies/μL,双重RT-LAMP结果显示,对2种模板同时检测的最低检测值也为100 copies/μL。根据反应起始时间可以发现,检测到最低检测浓度模板的时间于30 min内。干扰试验结果显示,对相差104倍的模板浓度,该方法仍能对不同的模板进行有效扩增,达到鉴别检测的目的(图5)。

A.浊度仪观测F48E8敏感性试验 (1.1×107 copies/μL;2. 1×106 copies/μL;3.1×105 copies/μL;4.1×104 copies/μL;5.1×103 copies/μL;6.1×102 copies/μL;7.1×101 copies/μL;8.阴性对照);B.浊度仪观测La Sota敏感性试验 ( 1.1×107 copies/μL;2.1×106 copies/μL;3.1×105 copies/μL;4.1×104 copies/μL;5.1×103 copies/μL;6.1×102 copies/μL;7.1×101 copies/μL;8.阴性对照);C.浊度仪观测2种模板混合敏感性试验 ( 1.1×107 copies/μL;2.1×106 copies/μL;3.1×105 copies/μL;4.1×104 copies/μL;5.1×103 copies/μL;6.1×102 copies/μL;7.1×101 copies/μL;8.阴性对照);D.荧光成像仪观测敏感性试验 (第1排.F48E8;第2排.La Sota;第3排.2种模板混合;1.1×107 copies/μL;2.1×106 copies/μL;3.1×105 copies/μL;4.1×104 copies/μL;5.1×103 copies/μL;6.1×102 copies/μL;7.1×101 copies/μL;8.阴性对照)图4 敏感性试验

1.La Sota 1×106 copies/μL;2.F48E8 1×102 copies/μL;3.La Sota 1×106 copies/μL 和F48E8 1×102 copies/μL 混合;4.阴性对照;5.La Sota 1×102 copies/μL;6.F48E8 1×106 copies/μL;7.La Sota 1×102 copies/μL 和F48E8 1×106 copies/μL 混合;9.La Sota 1×107 copies/μL;10.F48E8 1×103 copies/μL;11.La Sota 1×107 copies/μL 和F48E8 1×103 copies/μL 混合;12.阴性对照;13.La Sota 1×103 copies/μL;14.F48E8 1×107 copies/μL;15.La Sota 1×103 copies/μL和F48E8 1×107 copies/μL混合;16.阴性对照图5 干扰试验
3 讨论
LAMP技术发明以来,不断发展改进,从一开始通过观测反应产生的沉淀来判定结果,发展到加入SYBR Green Ⅰ或钙黄绿素、TE等染料观测结果[9-10],虽然提高了可视性,但SYBR Green Ⅰ往往需要反应后开盖加入,非常容易产生气溶胶污染,且SYBR Green Ⅰ、钙黄绿素、TE等都不能区分扩增产物、引物二聚体和非特异扩增。所以,范晴等[11]在前人研究基础上,通过在FIP上标记荧光基团,反应后通过电泳观测结果,从而消除引物二聚体或非特异扩增所产生的假阳性,且能达到1个反应体系同时鉴别检测2种病原的目的。但这也需要开盖并通过电泳完成,为了达到不开盖观察结果的目的,谢志勤等[12]在LAMP反应体系中引入TaqMan探针,LAMP反应过程中,TaqMan探针与扩增产物结合后再被水解,产生游离荧光基团,反应完成后可通过荧光成像仪观测结果。分子信标是由TYAGI等[11]发明的一种荧光标记的分子探针,具有较高的灵敏度和极强的特异性,分子信标可与实时定量PCR相结合检测目标基因,也可用于双链DNA和蛋白质的检测[14]。本研究使用分子信标与RT-LAMP技术相结合,反应前由于茎环结构,分子信标的荧光基团和淬灭基团靠近,荧光被淬灭,反应后,在80℃温度下分子信标被打开,退火至室温过程中,与目标片段结合,茎环结构打开,荧光基团和淬灭基团远离,发出荧光,通过荧光成像仪的对应通道观测荧光,且无需开盖,防止了气溶胶污染。
NDV的HN、M和P蛋白均可以影响NDV的毒力,但主要影响因素仍然是F0蛋白可否被宿主蛋白酶裂解为F1和F2蛋白,促进病毒囊膜和宿主细胞膜融合从而感染宿主细胞[15]。绝大多数的中等毒力、强毒力NDV的F蛋白裂解位点的氨基酸基序为112R/K-R-Q-K/R-R-F117,而弱毒力NDV的基序为112G/E-K/R-Q-G/E-R-L117。近年来分离到的鸽源NDV,虽然使用鸡作为致病指数测定的动物,显示为中等毒力或弱毒,但对鸽子仍然表现为强毒[16]。因此,OIE仍然将F0蛋白裂解位点的核苷酸序列作为判断NDV毒力的分子标志,在实际监测中也仍然符合绝大多数的NDV毒力特征。本研究基于这个分子标记设计分子信标,达到鉴别诊断不同毒力NDV的目的。
多年来不同实验室对NDV的监测发现,不同基因型和不同毒力的NDV在同一个个体中共存是非常普遍的现象[8,17-18],在之前的监测和诊断工作中,鉴别同一个个体是否感染不同毒力的NDV,需要经过RT-PCR扩增和测序等步骤,耗时长且人力、物力需求大,不利于大批量的流行病学调查和诊断。本方法可以快速鉴别不同毒力NDV,且在水浴锅内可完成全部反应,直接通过荧光成像仪观测结果,具有快速、高通量的特点,可以使大规模流行病学调查的效率大大提高。
综上所述,本研究建立的区分不同毒力NDV的可视化双重荧光RT-LAMP检测方法,可以在30 min 内实现在同一个反应管内同时扩增不同毒力的NDV,最低检测量达到100 copies/μL,并且在荧光成像仪下,可以通过不同的荧光色鉴别诊断不同毒力的NDV,为提高NDV的诊断和监测效率提供了新的技术手段,也为在不同试验条件下检测其他病原体提供了新的思路。
