不同浓度GSNO对盐胁迫下番茄幼苗生长的影响
2021-10-30孙艳芸朱普生崔金霞刘慧英
孙艳芸,朱普生,刁 明,崔金霞,徐 巍,刘慧英
(石河子大学农学院园艺系/特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆石河子 832000)
0 引 言
【研究意义】设施栽培复种指数、施肥量和集约化程度相对过高,设施内土壤出现次生盐渍化、养分失衡、土壤酸化等问题,其中盐胁迫是设施作物遭受的主要逆境之一且对作物的正常生长发育及产量的限制最为显著[1]。NaCl胁迫下植物无法保持正常的营养平衡和渗透调节,使得植物细胞内叶绿体和线粒体电子传递过程中泄漏的电子数增加[2],造成活性氧(ROS)大量积累及膜系统氧化损伤;引发光抑制及光合电子传递系统失活[3];植物体内的激素平衡遭到破坏以及积累的生物量减少[4];诱使蛋白质和核酸发生变性,从而导致细胞死亡[5]。缓解NaCl胁迫对设施作物生长发育和产量造成的不良影响,研究设施作物的盐适应性作用机理,对提高设施作物的抗盐性有重要意义。【前人研究进展】一氧化氮(NO)作为一种重要的信号分子存在于各个生物体内,在植物生长发育的过程中,以及参与盐、干旱和病原菌侵染等逆境胁迫的应答反应中有着重要作用[6-12]。有试验证实,外源NO参与了植物应答盐胁迫的反应[2]。外源NO可缓解小麦叶片的氧化损伤[13]、提高黄瓜幼苗的抗氧化能力[14]、减轻NaCl胁迫对番茄幼苗的伤害[15]等,增强植物的适应能力。NaCl胁迫下NO通过3种途径以缓解NaCl胁迫对植物的伤害:(1)降低植物细胞对Na+的吸收及增加K+的含量;(2)提高脯氨酸(Pro)的含量;(3)提高各种抗氧化酶的活性[16]。此外研究还发现,蛋白质巯基亚硝基化,即NO与蛋白质半胱氨酸巯基(-SH)生成巯亚硝基(-SNO),使蛋白构象和活性发生改变的一种参与氧化还原信号转导的调节机制,成为NO发挥其信号转导作用的一种新的重要途径[17]。而NO与谷胱甘肽(GSH)形成的S-亚硝基谷胱甘肽(S-Nitrosoglutathione,GSNO)是当前主要亚硝基供体[18]。GSNO是一种-亚硝基硫醇类化合物。其广泛存在于各种生物体中,是生物体天然存在的一氧化氮供体(储存体),可以在体内自发产生,也可运输,并在合适位置释放出一氧化氮,因此,也是重要的一氧化氮缓冲和储存体系[19]。內源GSNO对于生物体多种信号传导和生物体防御应答是通过参与GSH、NO、蛋白质类亚硝基硫醇(SNOs)水平的调节、介导翻译后蛋白质半胱氨酸残基的巯基亚硝基化和巯基谷胱甘肽化修饰来发挥作用的[20]。目前GSNO作为一种在有机体内运输和储存NO的工具,已经用于临床防止惊厥以及阻止血小板凝集。也可以作为医用NO制作原料。【本研究切入点】而GSNO在植物上的应用研究还比较少,尤其是参与植物抗逆调控(包括盐适应性)的相关研究较少,且大多研究是以硝普钠(SNP)作为NO供体。番茄(LycopersiconesculentumMill)是目前我国设施生产的主要栽培的作物品种之一,属于中度耐盐性作物,是研究作物耐盐性常用的模式植物。【拟解决的关键问题】以番茄为试材,采用营养液培养的方法,以GSNO作为外源NO供体研究其不同浓度水平对盐胁迫下番茄幼苗生长的影响,筛选出用于提高番茄耐盐性的适宜施用浓度,为GSNO在提高植物盐适应性的作用机制奠定基础。
1 材料与方法
1.1 材 料
1.1.1 番茄品种
试验在石河子大学农学院试验站进行。试验材料选用番茄品种中蔬4号。番茄种子经浸种催芽后播种于基质(草炭∶蛭石=2∶1(V/V))中。待番茄幼苗长至2叶1心,将精心选出的长势整齐一致的番茄幼苗移栽到带泡沫盖板的容量为12 L的水桶中,装入pH值为6.2的Hoagland营养液10 L。待番茄幼苗长至4叶1心时进行不同处理,其中氯化钠(NaCl,100 mmol/L)于处理时直接加入营养液中,GSNO(外源NO供体)于每日09:00喷施于番茄幼苗的各个叶片上。在试验进行期间,每间隔3 d对营养液的pH值进行1次调整并更换1次营养液。试验期间保证温室内全天通气。
1.1.2 GSNO制备
将等体积的200 mmol/L NaNO2(在0.5 mol/L HCl中)与等体积200 mmol/L GSH(在0.5 mol/L HCl中)混合,室温避光反应5 min,得到红色产物。加入1 mol/L NaOH调整pH=7.0左右。以PBS为阴性对照分光光度仪测定334 nm处吸光度,所得吸光度值与GSNO摩尔吸光系数0.767相比得到GSNO母液的浓度。将GSNO母液分别稀释为所需处理浓度(0.1、0.2、0.3、0.4、0.5、0.6 mmol/L)[22-23]。
1.2 方 法
1.2.1 试验设计
试验设置8个处理。
(1)CK:不喷GSNO不加NaCl和叶片喷施蒸馏水;
(2)NaCl:营养液添加0.1 mmol/L NaCl和叶面喷施双蒸水;
(3)NaCl+GSNO0.1,营养液添加0.1 mol/L NaCl和叶面喷施0.1 mmol/L GSNO;
(4)NaCl+GSNO0.2,营养液添加0.1 mol/L NaCl和叶面喷施0.2 mmol/L GSNO;
(5)NaCl+GSNO0.3,营养液添加0.1 mol/L NaCl和叶片喷施0.3 mmol/L GSNO;
(6)NaCl+GSNO0.4,营养液添加0.1 mol/L NaCl和叶片喷施0.4 mmol/L GSNO;
(7)NaCl+GSNO0.5,营养液添加0.1 mol/L NaCl和叶片喷施0.5 mmol/L GSNO;
(8)NaCl+GSNO0.6,营养液添加0.1 mol/L NaCl和叶片喷施0.6 mmol/L GSNO。
试验为随机区组设计,每个处理重复3次,每个重复5株。在不同处理后第3 d取样及测定。
1.2.2 测定指标
1.2.2.1 形态指标
株高:用软尺测定茎基部到生长点的距离(cm)。
茎粗:用游标卡尺测定茎基部的粗度(cm)。
干重(DW)、鲜重(FW)测定:参照李合生[23]测定。
1.2.2.2 生理指标
丙二醛(MDA)含量:采用硫代巴比妥酸法[24]测定;
电解质渗透率:采用PD-501便携式多功能测量仪测定;
根系活力:采用 TTC 法[25]测定;
叶绿素含量:参照Arnon[26]测定;
脯氨酸(Pro)含量:采用酸性茚三酮显色法[27]测定。
1.3 数据处理
使用 Microsoft Excel对试验数据进行处理;使用SPSS19.0对试验数据进行差异显著性检验(Duncan’s 法),显著性水平设定为 α=0.05;使用Origin2019b对试验数据进行图表制作。
2 结果与分析
2.1 不同浓度GSNO对盐胁迫下番茄幼苗生长指标的影响
研究表明,与对照处理(CK)相比,NaCl胁迫处理后,番茄幼苗的各项生长指标(株高、茎粗、地上部和地下部的鲜重和干重)均显著下降,其中株高下降了27.5%、茎粗下降了20.43%、地上部干、鲜重分别下降了37.67%和33.57%、地下部干、鲜重分别下降了37.50%和63.63%;与NaCl处理相比,盐胁迫下施加0.1 mM GSNO(NaCl+GSNO0.1处理)显著提高了番茄幼苗的茎粗、地上部和地下部干重,对株高、地上部和地下部鲜重无显著影响;盐胁迫下施加0.2 mM和0.3 mM GSNO(NaCl+GSNO0.2和NaCl+GSNO0.3处理)与NaCl胁迫处理相比仅显著提高了番茄幼苗的地下部鲜重,对其它各项生长指标均无显著影响;盐胁迫下施加0.4 mM、0.5 mM、0.6 mM GSNO(NaCl+GSNO0.4、NaCl+GSNO0.5和NaCl+GSNO0.6处理)较NaCl胁迫处理对番茄幼苗的生长指标无显著差异。表1

表1 不同浓度GSNO对盐胁迫下番茄幼苗生长指标变化Table 1 Effects of different concentrations of GSNO on growth indexes of tomato seedlings under salt stress
2.2 不同浓度GSNO对NaCl胁迫下番茄幼苗根系活力的影响
研究表明,与CK处理相比,NaCl胁迫下番茄幼苗的根系活力显著下降了36.25%;与NaCl胁迫处理相比,NaCl+GSNO0.1和NaCl+GSNO0.22个处理下番茄幼苗的根系活力分别显著提高了32.59%、25.96%,其中NaCl+GSNO0.1处理的根系活力显著高于NaCl+GSNO0.2处理的。NaCl+GSNO0.3、NaCl+GSNO0.4和NaCl+GSNO0.53个处理下番茄幼苗的根系活力与NaCl胁迫处理相比无显著差异,且3个浓度处理间的根系活力也无显著差异。而NaCl+GSNO0.6处理下的番茄幼苗根系活力与NaCl胁迫处理相比显著降低了18.48%。施用0.1 mmol/L的GSNO对NaCl胁迫下番茄幼苗根系活力的促进作用最好,其次为0.2 mmol/L的GSNO,而施用高浓度的GSNO(0.6 mmol/L)对NaCl胁迫下的番茄幼苗的根系活力具有抑制作用。表2
2.3 不同浓度GSNO对NaCl胁迫下番茄幼苗盐胁迫下叶绿素含量的影响
研究表明,与CK处理相比,NaCl胁迫下番茄幼苗叶片的叶绿素a(Chla)含量显著下降了26.20%,叶绿素b(Chlb)含量显著下降了22.34%,叶绿素总量显著下降了25.59%;与NaCl胁迫处理相比,NaCl+GSNO0.1、NaCl+GSNO0.2和NaCl+GSNO0.33个处理均显著提高了Chla含量和叶绿素总量,对Chlb含量无显著影响。3个处理中,NaCl+GSNO0.1处理的叶绿素总量显著高于NaCl+GSNO0.2和NaCl+GSNO0.32个处理的Chlb含量显著高于NaCl+GSNO0.3处理的Chla含量3个浓度处理间无显著性差异。NaCl+GSNO0.2和NaCl+GSNO0.32个处理的Chla、Chlb和叶绿素总量均无显著性差异;NaCl+GSNO0.4处理较NaCl胁迫处理显著提高了Chla含量,对Chlb和总叶绿素含量无显著影响;与NaCl胁迫处理相比,NaCl+GSNO0.5和NaCl+GSNO0.62个处理均显著降低了Chlb含量,但对Chla和叶绿素总量无显著影响,且2个处理间无显著性差异。表3
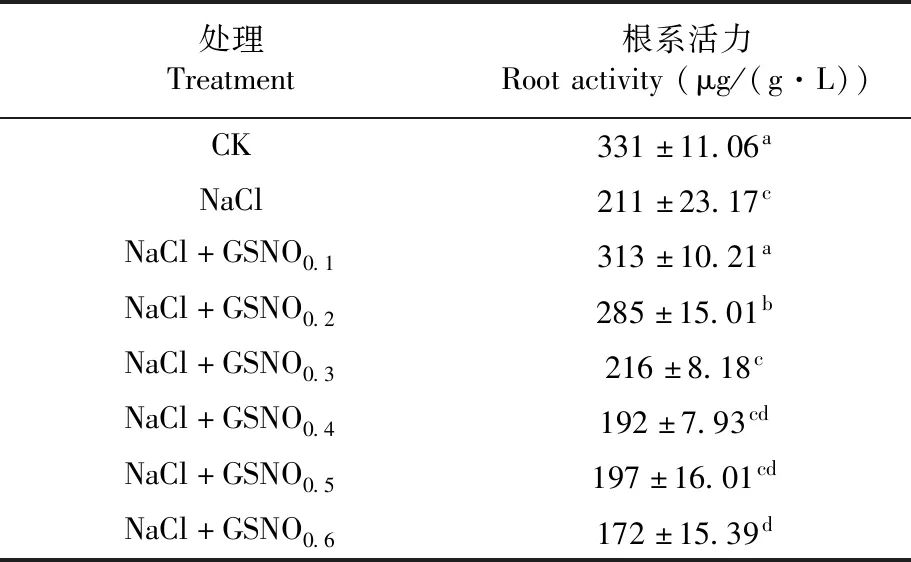
表2 不同浓度GSNO对盐胁迫下番茄幼苗根系活力变化Table 2 Effects of different concentrations of GSNO on root activity of tomato seedlings under salt stress
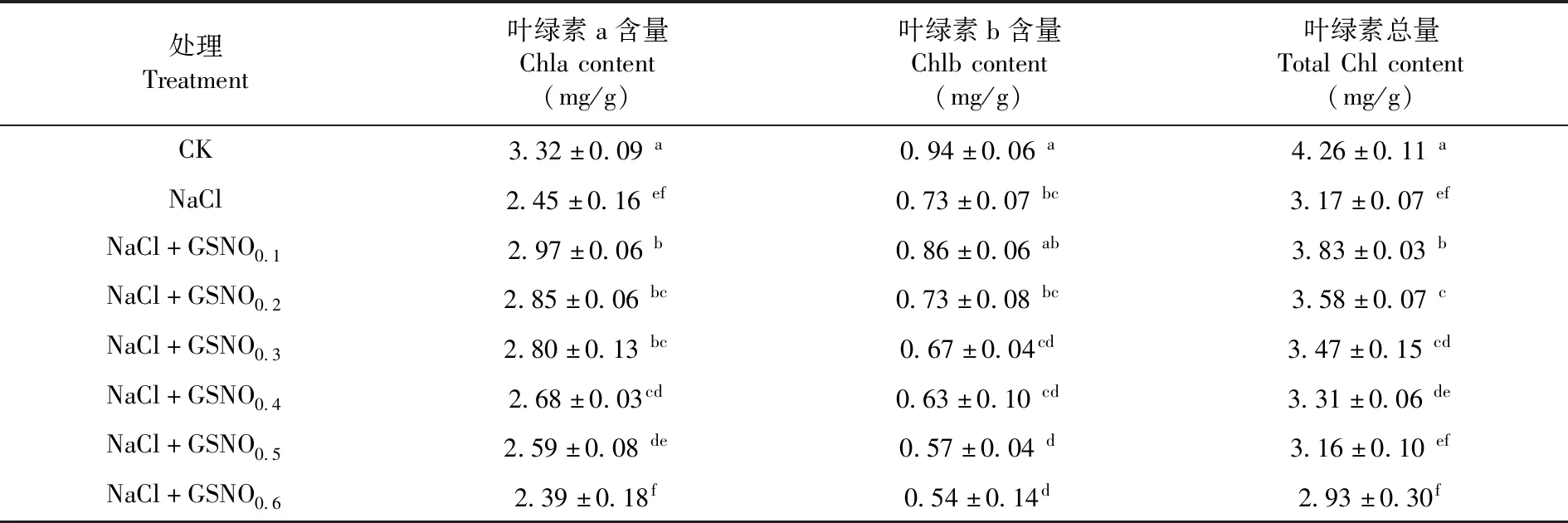
表3 不同浓度GSNO对番茄盐胁迫下幼苗叶片叶绿素含量变化Table 3 Effects of different concentrations of GSNO on chlorophyll content of tomato seedlings under salt stress after
2.4 不同浓度GSNO对NaCl胁迫下番茄幼苗电解质渗透导率(EL)和丙二醛(MDA)含量的影响
研究表明,与CK处理相比,盐胁迫使得番茄幼苗叶片的丙二醛(MDA)含量显著提高,与CK相比显著提高了43.17%,但对番茄幼苗叶片的电解质渗透率(EL)无显著影响;与盐处理下的番茄幼苗比较,NaCl+GSNO0.1和NaCl+GSNO0.22个处理下番茄幼苗叶片的丙二醛(MDA)含量均显著降低,但EL仍无显著变化。NaCl+GSNO0.3、NaCl+GSNO0.4、NaCl+GSNO0.5和NaCl+GSNO0.64个处理下番茄幼苗叶片的EL和MDA含量与NaCl处理相比均无显著影响。6个不同浓度的GSNO处理中,除NaCl+GSNO0.1的EL显著低于NaCl+GSNO0.4、NaCl+GSNO0.5和NaCl+GSNO0.63个处理外,其它处理间的EL和丙二醛(MDA)含量均无显著性差异。表4
2.5 不同浓度GSNO对胁迫下番茄幼苗盐胁迫下脯氨酸(Pro)含量的影响
研究表明,相较于CK处理,盐胁迫显著提高了番茄幼苗叶片的脯氨酸(Pro)含量,相较于与盐胁迫处理,NaCl+GSNO0.1、NaCl+GSNO0.2、NaCl+GSNO0.3、NaCl+GSNO0.4、NaCl+GSNO0.5,5个处理下番茄幼苗叶片的脯氨酸含量均显著增加,NaCl+GSNO0.6处理下的脯氨酸含量则没有显著性差异。6个不同浓度GSNO处理中,NaCl+GSNO0.1的脯氨酸含量显著高于NaCl+GSNO0.3、NaCl+GSNO0.4、NaCl+GSNO0.5和NaCl+GSNO0.64个处理。图1

表4 不同浓度GSNO对盐胁迫下番茄幼苗电解质渗透率和丙二醛含量变化Table 4 Effect of of different concentrations of GSNO on electrical conductivity and MDA content of tomato seedlings under salt stress
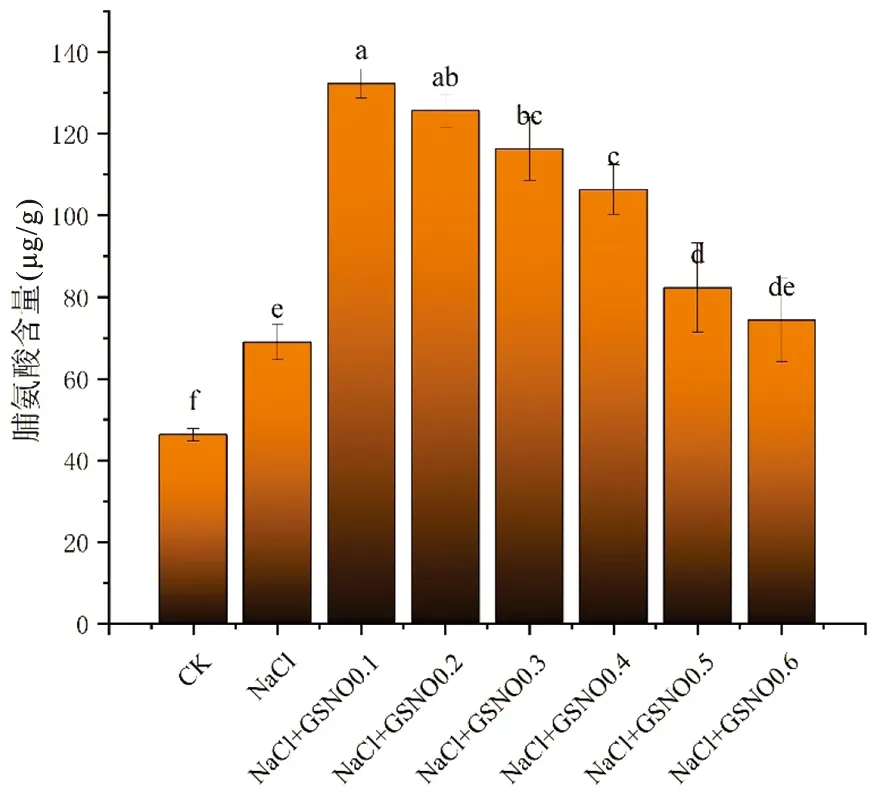
图1 不同浓度GSNO对胁迫下番茄幼苗盐胁迫下脯氨酸含量变化Fig.1 Effect of different concentrations of GSNO on proline content of tomato seedlings under Salt Stress
3 讨 论
植物生长发育对NaCl胁迫非常敏感,可以用生长形态学指标来评价植物的耐盐能力和盐胁迫程度[29-30]。NaCl胁迫影响植物的生长发育通过渗透胁迫,离子伤害等过程实现[30]。此外,根系是植物对盐胁迫信号最敏感的部分,会导致植物根系受损,阻碍了芽的生长。研究结果亦表明,胁迫显著抑制了番茄幼苗的生长和根系活力。研究表明,NO是一种对植物体具有双重性作用的信号转导分子[32],一方面NO可以通过改变细胞氧化还原状态而参与植物的生长发育和对环境适应的信号转导过程,另一方面高浓度NO作为活性氮具有强硝化胁迫作用从而抑制植物生长。NO的双重性作用主要根据具体浓度、施用部位及细胞的生理条件不同而展现出不同的作用[38-39]。内源GSNO作为动物细胞内一种运输和储存NO的工具,在生物体多种信号传导和防御应答上发挥重要作用。试验结果表明,与NaCl胁迫相比较,NaCl+GSNO0.1、NaCl+GSNO0.2和NaCl+GSNO0.33个处理均在不同程度上显著促进了番茄幼苗的生长,但其它3个较高浓度的GSNO处理下的番茄幼苗较NaCl胁迫的没有显著差异。外源施用适宜浓度的GSNO(0.1、0.2和0.3 mmol/L)能够有效促进NaCl胁迫下番茄幼苗生长发育,提高番茄幼苗的耐盐性。其中尤以施用0.1 mmol/L的GSNO对NaCl胁迫下番茄幼苗生长和根系活力的促进作用最好。但高浓度的GSNO(0.4、0.5和0.6 mmol/L)对NaCl胁迫下番茄幼苗生长没有缓解作用,也没有产生明显的抑制作用。
叶绿素含量是反映植物光合作用强度的重要生理指标。当植物处于NaCl胁迫下时,叶绿素不能正常形成,导致其含量下降,无法维持正常合成与分解之间的平衡,导致光合作用强度减弱和叶片生长。植物被阻塞,使植物缓慢生长,减少叶片类型,并增加对植物的伤害[31]。试验结果表明,NaCl胁迫下的番茄幼苗生长收到抑制的同时,伴随着Chla、Chlb和叶绿素总量的显著下降。而外源施用0.1、0.2和0.3 mmol/L GSNO均有效提高了NaCl胁迫下番茄幼苗叶片叶绿素总量及Chla,且以施用0.1 mmol/L GSNO的效果最好。但施用0.5和0.6 mmol/L GSNO的施用显著降低了Chlb含量。较低浓度的GSNO可通过提高盐胁迫下番茄幼苗的光合色素含量来促进番茄幼苗的光合作用和生长。而较高浓度GSNO(0.5和0.6 mmol/L)的施用通过降低捕光色素Chlb含量而影响番茄幼苗的光合作用和生长。
细胞膜对维持生物体细胞内微环境和正常的代谢有着不可或缺的一部分[32]。在正常的生长环境下,植株内ROS的产生和清除始终保持一种平衡,但逆境胁迫会打破这种平衡。逆境(包括盐胁迫)会导致植物体内的ROS过量产生和累积,这使得植物体内细胞的膜脂过氧化程度提高和膜系统的完整性被破坏,影响植物正常的生长和发育。膜脂过氧化和膜透性增大的程度与植物抗逆性的强弱有关[33],电解质渗透率的和MDA含量已经成为评价鉴定植物抗逆性强弱的有效指标。研究表明,NaCl胁迫处理导致膜脂过氧化程度提高和膜系统的完整性降低;而外源施用0.1和0.2 mmol/L GSNO 显著降低了NaCl胁迫下番茄幼苗叶片的MDA含量,即显著降低了膜脂过氧化程度。但0.3~0.6 mmol/L GSNO 的施用对NaCl胁迫下番茄幼苗叶片的电解质渗透率和MDA无显著影响,0.3~0.6 mmol/L GSNO对盐胁迫下番茄幼苗叶片细胞的完整性和膜脂过氧化程度无影响。外源施用较低浓度(0.1和0.2 mmol/L)的GSNO能够通过降低盐胁迫下番茄幼苗体内活性氧的产生和积累,保护细胞膜免于氧化胁迫,从而提高番茄幼苗的抗盐性。
脯氨酸(pro)作为植物蛋白质的重要组成部分之一,通常以游离状态广泛分布于植物体内。在逆境环境下,许多植物体内脯氨酸(Pro)含量大幅增加。积累的Pro不但可以作为植物细胞质内渗透调节物质,还可以稳定生物大分子结构,降低细胞酸性,解除氨毒并且作为能量库调节细胞氧化还原等[34]。植物体内的Pro含量在一定程度上反映了植物的抗逆性[35],往往抗盐性越强植物体内会积累更多的脯氨酸(Pro)。研究表明,在盐胁迫下外源施用0.1~0.5 mmol/L GSNO均显著增加番茄幼苗体内的Pro含量,但0.6 mmol/L GSNO对盐胁迫下番茄幼苗体内的Pro含量无显著影响。其中盐胁迫下施用0.1 mmol/L GSNO番茄幼苗体内Pro的含量显著高于施用0.3~0.6 mmol/L GSNO的处理。外源施用较低浓度的GSNO能够更好的提高番茄幼苗体内Pro的累积,提高番茄幼苗的抗盐性。
4 结 论
作为NO的供体的GSNO在低浓度(0.1~0.3 mmol/L)的施用可不同程度促进盐胁迫下番茄幼苗生长和提高番茄幼苗的盐适应性。高浓度(0.4~0.6 mmol/L)GSNO的施用对盐胁迫下番茄幼苗的生长和膜脂过氧化程度及膜的完整性无影响。但0.5和0.6 mmol/L GSNO的施用显著降低盐胁迫下番茄幼苗叶片的Chlb含量,0.6 mmol/L GSNO还显著降低了盐胁迫下番茄幼苗的根系活力。GSNO对盐胁迫下番茄幼苗的生长亦具有浓度效应,低浓度(0.1~0.3 mmol/L)GSNO可缓解盐胁迫对番茄幼苗生长的抑制作用,高浓度(0.5~0.6 mmol/L)的GSNO已造成对植物的伤害,施用的高浓度尚未达到抑制盐胁迫下番茄幼苗生长的浓度。NaCl胁迫显著降低了番茄幼苗的根系活力和光合色素含量、加剧了膜脂过氧化和膜完整性的破坏程度,抑制了番茄幼苗的生长。而外源施用0.1~0.3 mmol/L GSNO可通过不同程度的提高叶绿素含量、根系活力,降低膜脂过氧化和膜完整性的破坏程度,提高脯氨酸含量而有效缓解盐胁迫对番茄幼苗生长的抑制作用,提高番茄幼苗的抗逆性。其中尤以0.1 mmol/L GSNO施用效果最佳。高浓度(0.5~0.6 mmol/L)GSNO的施用虽对盐胁迫下番茄幼苗的已造成伤害,但尚未达到抑制盐胁迫下番茄幼苗生长的作用。
