大蒜提取物对小鼠肠道菌群调节作用研究
2021-10-29贾世栋宋百灵张春子毛旭文
贾世栋,杨 浩,宋百灵,张春子,毛旭文,4
(1新疆医科大学药学院,2新疆医科大学第六附属医院药学部,3埃乐欣药业有限公司,4天然药物活性组分与释药技术重点实验室,乌鲁木齐 830011)
大蒜(Allium sativumL.)为百合科葱属植物的根茎,其主要化学成分为蒜氨酸,含量占0.5%~2.0%。蒜氨酸与蒜酶在碾碎时接触,快速反应产生大蒜辣素[1]。大蒜具有多种药理活性,能够明显杀灭或抑制细菌、真菌、病毒,如:痢疾杆菌、伤寒杆菌、白色念珠菌、流感病毒、牛痘病毒等[2-3]。除此以外,大蒜还具有保护心血管系统[4]、调节血糖水平[5]、缓解疲劳[6]、抗肿瘤[7]等药理活性;虽然国内外对大蒜的研究日趋增多,但是关于大蒜对肠道菌群的益生作用还鲜有报道。新疆生产的大蒜优质个大,生物活性成份含量较高,为大蒜制剂提供了优良原料。本文采用菌落计数法探究健康小鼠灌胃蒜氨酸、大蒜辣素、大蒜粉前后肠道菌群变化,评价大蒜提取物的潜在益生元特性,现报到如下。
1 材料与方法
1.1 仪器MLS-3750型高压蒸汽灭菌器(韩国SANYO公司),AC-S型洁净工作台(苏州安泰空气技术有限公司),DNP-9082型电热恒温水浴锅(上海精宏实验设备有限公司),E200型厌氧培养箱(美国Gene Sciense公司)。
1.2 试药伊红美蓝琼脂培养基(青岛海博生物技术有限公司,批号:1012105),BBL琼脂培养基(青岛海博生物技术有限公司,批号:100315),LBS琼脂培养基(青岛海博生物技术有限公司,批号:100929),TSC琼脂培养基(青岛海博生物技术有限公司,批号:1009032),改良GAM琼脂培养基厂家(青岛海博生物技术有限公司,批号:1009032),叠氮钠-结晶紫-七叶苷琼脂培养基(北京陆桥技术有限责任公司,批号:1003251),蒜氨酸(新疆埃乐欣药业有限公司,批号:20090101,纯度84.88%),蒜酶(新疆埃乐欣药业有限公司,批号:201801003),冻干蒜粉(新疆埃乐欣药业有限公司,批号:Y201811001)。
1.3 动物选取SPF级C57BL/6J小鼠100只(购于北京维通利华实验动物技术有限公司,动物合格证号1140700321501,动物生产许可证号SCXK(京)2016-0006),雌雄对半,6~8周龄,体质量22~25 g。SPF级实验动物使用许可证号SYXK(新)2016-0002,光照12 h/d,黑暗12 h/d,温度(21±2)℃,湿度(40%~45%)。本实验经过新疆医科大学实验动物中心伦理委员会批准。
1.4 方法
1.4.1 动物分组及给药 SPF级C57BL/6J小鼠随机分成10组:空白对照组(灌胃蒸馏水,灌胃剂量0.1 mL/10g体质量),蒜氨酸低(0.0004 3 mg/g体质量)、中(0.008 6 mg/g体质量)、高(0.017 2 mg/g体质量)剂量组,大蒜辣素低(0.001 9 mg/g体质量)、中(0.003 9 mg/g体质量)、高(0.007 8 mg/g体质量)剂量组,大蒜粉低(0.110 8 mg/g体质量)、中(0.221 6 mg/g体质量)、高(0.443 2 mg/g体质量)剂量组,,每组10只。以不同浓度的蒜氨酸、大蒜辣素、大蒜粉溶液灌胃,灌胃剂量0.1 mL/10 g,1次/d,连续给予30 d。
1.4.2 靶标菌培养 收集各组小鼠给药前后新鲜粪便于灭菌收集EP管中,称取粪便,加生理盐水,粪便重量与生理盐水配比为0.1 g:2 mL,立即将EP管封口,涡旋混匀5 min。将粪便混悬液10倍系列稀释10 000倍,接种于培养基,37℃培养,培养基种类及其培养条件,见表1。

表1 细菌培养基种类及其培养条件
1.5 指标的测定
1.5.1 体质量的测定 实验期间每天同一时间测定小鼠体质量。
1.5.2 靶标菌菌落计数 将培养好的细菌经16sRNA测序鉴定后,计算每克粪便中细菌数量CFU/g=X/0.05×稀释倍数/标本质量(g)。式中X同一稀释度平均菌落数。结果用常用对数值Lg CFU/g表示。
1.5.3 K-B纸片扩散法体外抑菌实验 挑取少量上述5种菌培养基,用平板划线法在MRS固体培养基平板上划线分离纯化菌种。取直径为6 mm的灭菌滤纸片,放入不同浓度的大蒜提物溶液中浸泡12 h,取出后放至无菌平皿中风干备用。挑取培养基上分离纯化后的单个菌落溶于生理盐水中,制成0.5个麦氏单位的菌悬液。吸取100μL菌悬液/板,接种于MRS固体培养基。用无菌镊子取纸片紧贴于培养皿表面。每个平板等距离贴3片,每组3个平行样。将贴好纸片的培养皿置于37℃温箱孵育24 h。培养结束后,用游标卡尺测量抑菌环的直径,抑菌环的边缘以肉眼见不到细菌明显生长为限,根据抑菌环直径大小、《纸片法抗菌药物敏感试验标准(WS/T125-1999)》[8]判断细菌对药物的敏感性,试验标准:抑菌圈直径等于0 mm为不敏;小于10 mm为低敏;在10~14 mm之间为中敏;在15~20 mm之间为高敏;大于20 mm,为极敏。
1.6 统计学处理采用GraphPad统计学软件分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大蒜提取物对小鼠体质量影响与空白对照组比较,蒜氨酸低、中、高剂量组灌胃第2、3、4周后体质量降低,差异有统计学意义(P<0.05)。与空白对照组比较,大蒜辣素低、中、高剂量组灌胃第2、3、4周后体质量降低,差异有统计学意义(P<0.05)。与空白对照组比较,大蒜粉低、中、高剂量组灌胃第2、3、4周后体质量降低,差异有统计学意义(P<0.05),见表2~4。
表2 蒜氨酸干预后小鼠在28 d内的体质量的变化(±s,g)

表2 蒜氨酸干预后小鼠在28 d内的体质量的变化(±s,g)
注:与空白对照组比较,*P<0.05,**P<0.01。
时间/周1 2 3 4 总和空白对照组170.31±8.92 172.52±8.78 172.83±8.51 174.41±8.29 690.06±33.66蒜氨酸低剂量组171.89±5.26 168.18±8.22 164.64±12.26 161.32±12.48*666.02±36.06蒜氨酸中剂量组168.39±6.86 165.03±7.76 162.86±5.92*160.02±5.28**656.29±24.90*蒜氨酸高剂量组163.03±9.47 157.61±11.26*154.98±10.86**151.52±10.78**627.13±39.59**
表3 大蒜辣素干预后小鼠在28 d内的体质量的变化(±s,g)
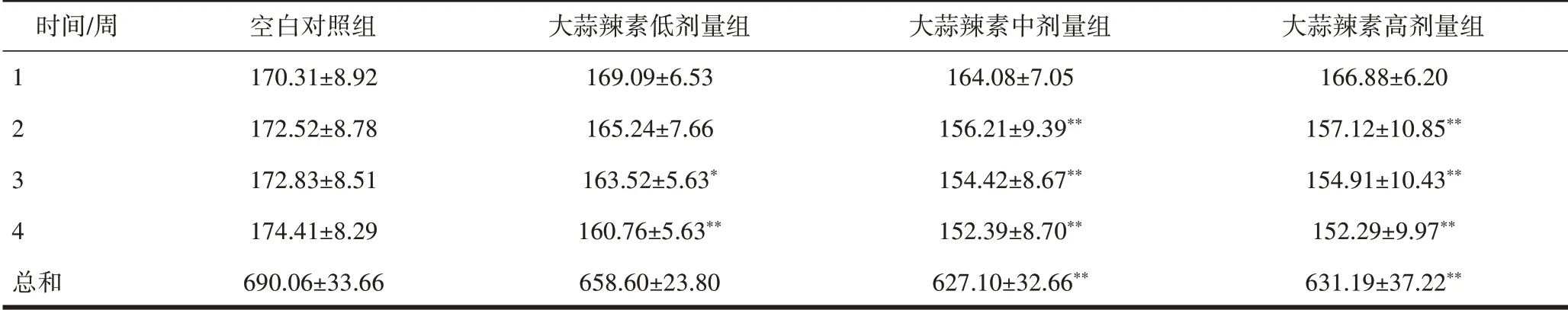
表3 大蒜辣素干预后小鼠在28 d内的体质量的变化(±s,g)
注:与空白对照组比较,*P<0.05,**P<0.01。
时间/周1 2 3 4 总和空白对照组170.31±8.92 172.52±8.78 172.83±8.51 174.41±8.29 690.06±33.66大蒜辣素低剂量组169.09±6.53 165.24±7.66 163.52±5.63*160.76±5.63**658.60±23.80大蒜辣素中剂量组164.08±7.05 156.21±9.39**154.42±8.67**152.39±8.70**627.10±32.66**大蒜辣素高剂量组166.88±6.20 157.12±10.85**154.91±10.43**152.29±9.97**631.19±37.22**
表4 大蒜粉干预后小鼠在28 d内体质量的变化(±s,g)

表4 大蒜粉干预后小鼠在28 d内体质量的变化(±s,g)
注:与空白对照组比较,*P<0.05,**P<0.01。
时间/周1 2 3 4 总和空白对照组170.31±8.92 172.52±8.78 172.83±8.51 174.41±8.29 690.06±33.66大蒜粉低剂量组169.51±9.33 163.77±13.36 159.74±12.30*155.65±11.18**648.66±45.83大蒜粉中剂量组165.27±9.97 158.76±13.30*150.82±14.37**144.03±16.14**618.87±51.69**大蒜粉高剂量组169.93±6.87 165.87±7.08 161.21±5.91**157.19±6.25**654.19±22.09
2.2 靶标菌菌落计数与空白对照组比较,蒜氨酸低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01)。灌胃30 d前后自身比较,蒜氨酸低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01)。与空白对照组比较,大蒜辣素低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01)。灌胃30 d前后自身比较,大蒜辣素低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01)。与空白对照组比较,大蒜粉低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01)。灌胃30 d前后自身比较,大蒜粉低、中、高剂量组乳杆菌、双歧杆菌数量明显增加,产气荚膜梭菌数量明显减少,差异有统计学意义(P<0.01),见表5~7。
表5 灌服蒜氨酸前后小鼠肠道5种菌落计数(Log CFU,±s)
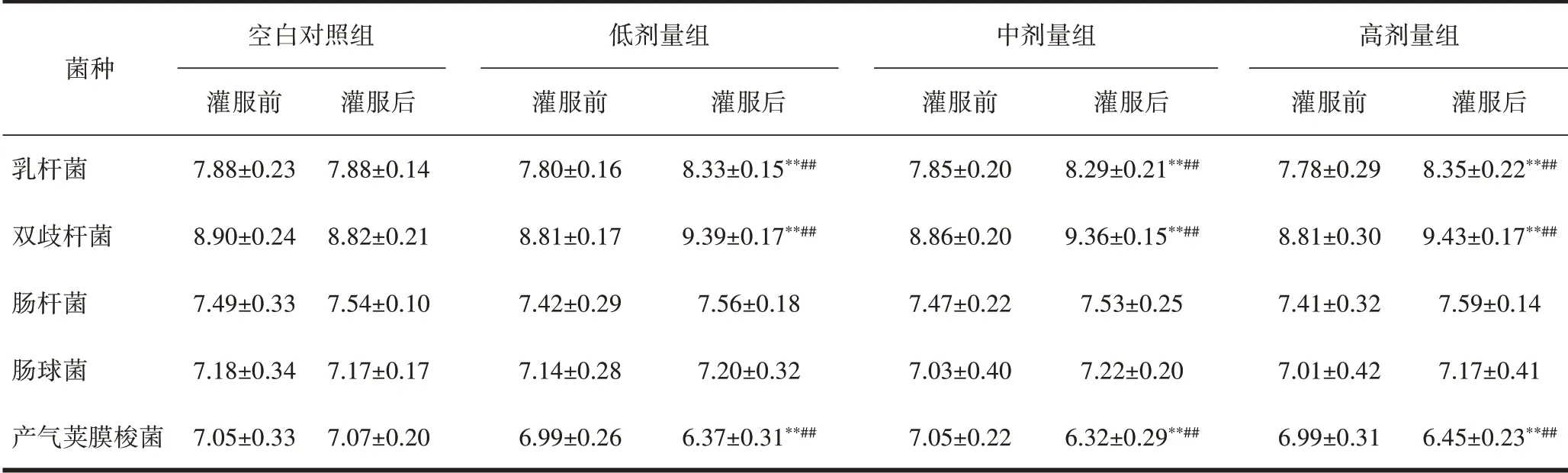
表5 灌服蒜氨酸前后小鼠肠道5种菌落计数(Log CFU,±s)
注:与给药后对照组相比,*P<0.05,**P<0.01;与本组给药前相比,#P<0.05,##P<0.01。
菌种乳杆菌双歧杆菌肠杆菌肠球菌产气荚膜梭菌空白对照组灌服前7.88±0.23 8.90±0.24 7.49±0.33 7.18±0.34 7.05±0.33灌服后7.88±0.14 8.82±0.21 7.54±0.10 7.17±0.17 7.07±0.20低剂量组灌服前7.80±0.16 8.81±0.17 7.42±0.29 7.14±0.28 6.99±0.26灌服后8.33±0.15**##9.39±0.17**##7.56±0.18 7.20±0.32 6.37±0.31**##中剂量组灌服前7.85±0.20 8.86±0.20 7.47±0.22 7.03±0.40 7.05±0.22灌服后8.29±0.21**##9.36±0.15**##7.53±0.25 7.22±0.20 6.32±0.29**##高剂量组灌服前7.78±0.29 8.81±0.30 7.41±0.32 7.01±0.42 6.99±0.31灌服后8.35±0.22**##9.43±0.17**##7.59±0.14 7.17±0.41 6.45±0.23**##
表6 灌服大蒜辣素前后小鼠肠道5种菌落计数(Log CFU,±s)

表6 灌服大蒜辣素前后小鼠肠道5种菌落计数(Log CFU,±s)
注:与给药后对照组相比,*P<0.05,**P<0.01;与本组给药前相比,#P<0.05,##P<0.01。
菌种乳杆菌双歧杆菌肠杆菌肠球菌产气荚膜梭菌空白对照组灌服前7.88±0.23 8.90±0.24 7.49±0.33 7.18±0.34 7.05±0.33灌服后7.95±0.10 8.99±0.10 7.61±0.20 7.10±0.48 7.15±0.19低剂量组灌服前7.83±0.20 8.84±0.23 7.46±0.33 7.06±0.36 7.04±0.32灌服后8.27±0.10**##9.33±0.12**##7.52±0.18 7.18±0.28 6.18±0.40**##中剂量组灌服前7.71±0.28 8.72±0.28 7.35±0.39 7.09±0.26 6.91±0.35灌服后8.27±0.17**##9.32±0.17**##7.51±0.12 7.18±0.25 6.37±0.35**##高剂量组灌服前7.78±0.14 8.80±0.10 7.38±0.33 7.08±0.32 7.02±0.19灌服后8.36±0.11**##9.42±0.09**##7.61±0.12 7.30±0.15 6.35±0.40**##
表7 灌服大蒜粉前后小鼠肠道5种菌落计数(Log CFU,±s)
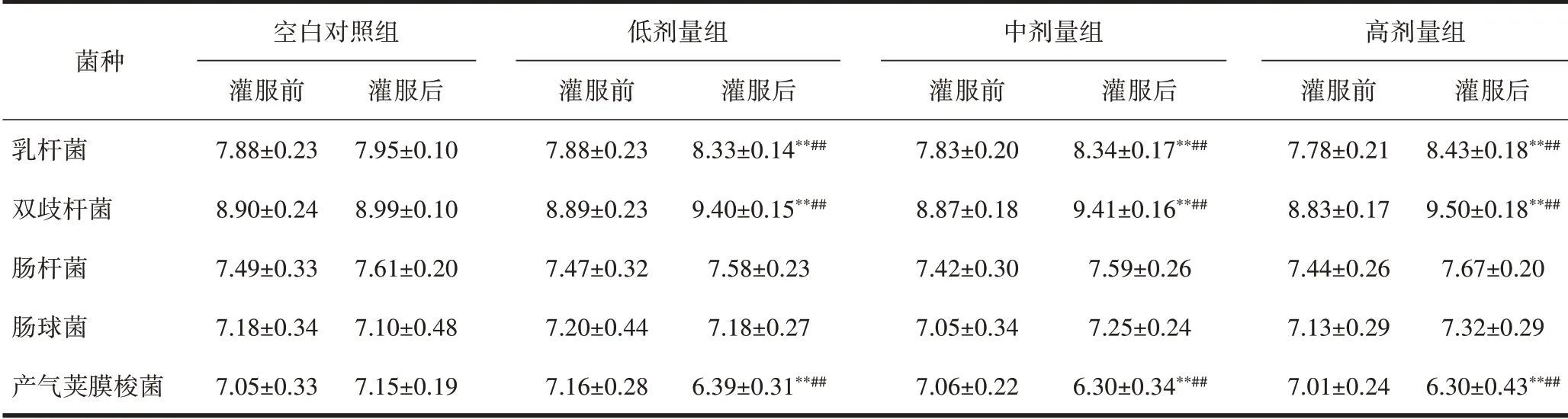
表7 灌服大蒜粉前后小鼠肠道5种菌落计数(Log CFU,±s)
注:与给药后对照组相比,*P<0.05,**P<0.01;与本组给药前相比,#P<0.05,##P<0.01。
菌种乳杆菌双歧杆菌肠杆菌肠球菌产气荚膜梭菌空白对照组灌服前7.88±0.23 8.90±0.24 7.49±0.33 7.18±0.34 7.05±0.33灌服后7.95±0.10 8.99±0.10 7.61±0.20 7.10±0.48 7.15±0.19低剂量组灌服前7.88±0.23 8.89±0.23 7.47±0.32 7.20±0.44 7.16±0.28灌服后8.33±0.14**##9.40±0.15**##7.58±0.23 7.18±0.27 6.39±0.31**##中剂量组灌服前7.83±0.20 8.87±0.18 7.42±0.30 7.05±0.34 7.06±0.22灌服后8.34±0.17**##9.41±0.16**##7.59±0.26 7.25±0.24 6.30±0.34**##高剂量组灌服前7.78±0.21 8.83±0.17 7.44±0.26 7.13±0.29 7.01±0.24灌服后8.43±0.18**##9.50±0.18**##7.67±0.20 7.32±0.29 6.30±0.43**##
2.3 大蒜提取物对5种菌的体外抑菌作用肠球菌对低、中、高剂量蒜氨酸均为低敏;产气荚膜梭菌对低、中、高剂量蒜氨酸均为低敏;乳杆菌、双歧杆菌、肠杆菌对低、中、高剂量蒜氨酸均不敏。乳杆菌对低、中、高剂量大蒜辣素分别为低敏、中敏、高敏;产气荚膜梭菌、肠杆菌对低剂量大蒜辣素为低敏,对中剂量、高剂量大蒜辣素均为中敏;肠球菌对低剂量大蒜辣素为中敏,对中剂量、高剂量大蒜辣素均为高敏;双歧杆菌对低、中、高剂量大蒜辣素为不敏。乳杆菌对低剂量、中剂量大蒜粉为中敏,对高剂量大蒜粉为高敏;肠杆菌对低剂量、中剂量大蒜粉均为低敏,对高剂量大蒜粉为中敏;肠球菌、产气荚膜梭菌大蒜粉低、中、高剂量均为低敏。双歧杆菌对低、中、高剂量大蒜粉为不敏,见表8~10。

表8 蒜氨酸抑菌圈直径/mm
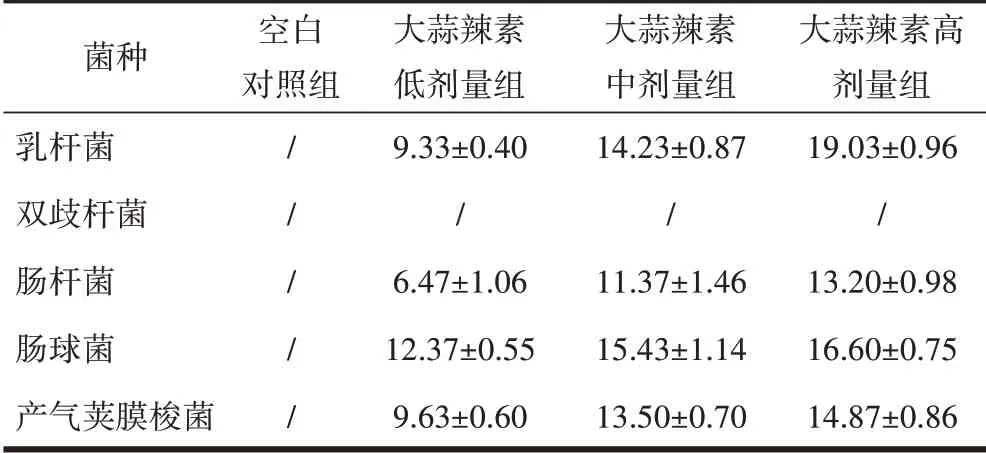
表9 大蒜辣素抑菌圈直径/mm
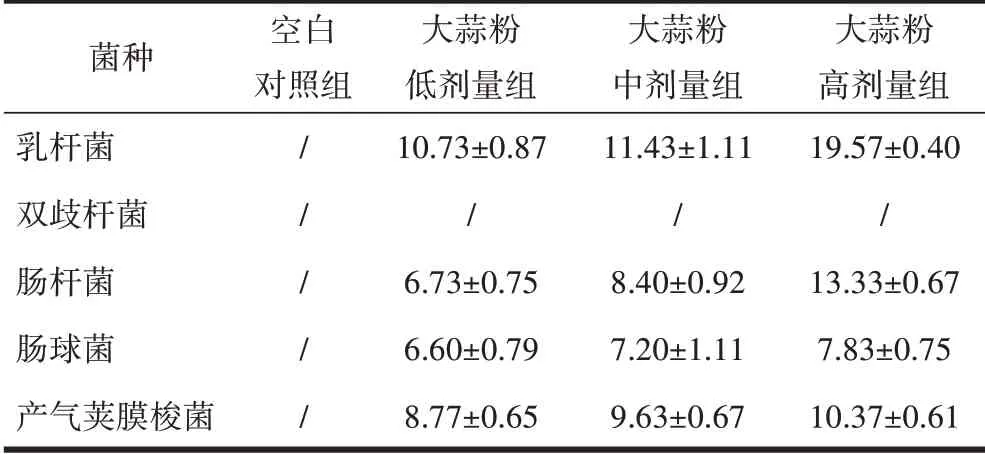
表10 大蒜粉抑菌圈直径/mm
3 讨论
人体肠道菌群中双歧杆菌、乳杆菌是有益菌的代表,通过降低肠道内环境的pH值、抑制有害菌增殖而发挥作用[5]。产气荚膜梭菌是致病菌,能分解肌肉和结缔组织中的糖,产生大量气体,导致组织严重气肿,继而影响血液供应,引起气性坏疽[6]。肠杆菌在相当长的一段时间内被认为是非致病菌,直到20世纪中叶才认识到一些特殊的肠杆菌对人和动物有致病性,常引起严重腹泻和败血症[7]。肠球菌是人类和动物肠道正常菌群的一部分,以往被认为是低毒性的微生物,很少引起致命的感染。近十多年来,肠球菌引起严重感染,并有较高病死率的报道不断增多[8]。产气荚膜梭菌、双歧杆菌、乳酸菌、肠球菌和肠杆菌是肠道菌群中较为重要的细菌种类。因此本实验选用这5种代表菌作为评价肠道菌群变化指标。
本实验给予小鼠蒜氨酸、大蒜辣素和大蒜粉30天,小鼠体重随灌胃时间延长而下降,初步推测大蒜及其提取物有减肥功效,后续将检测小鼠血糖、血脂等指标。灌胃后与对照组比较、或与灌胃前自身对照比较,发现肠道内乳杆菌、双歧杆菌数量明显升高,产气荚膜梭菌明显下降,肠球菌、肠杆菌数量无变化,说明大蒜提取物具有升高有益菌、抑制有害菌生长,能够优化肠道菌群结构,对肠道菌群具有有益的调节作用。通过比较低、中、高剂量蒜氨酸对肠道5种菌的调节作用,发现不同浓度的蒜氨酸对肠道菌群作用无明显差别,大蒜辣素和大蒜粉对肠道菌群的作用也同样无呈现出剂量依赖性。均选取高剂量组的蒜氨酸、大蒜辣素、大蒜粉比较对肠道菌群的益生作用强弱,发现三种受试物对肠道菌群的益生作用无明显差异。说明不同浓度的蒜氨酸、大蒜辣素、大蒜粉调节肠道菌群作用强弱无明显差别。
体内实验与体外抑菌实验结果比较,大蒜辣素、大蒜粉对肠杆菌、乳杆菌的体外抑菌作用与体内实验结果相反;蒜氨酸、大蒜辣素及大蒜粉对肠球菌的体外抑菌作用与体内实验结果相反。分析原因有可能是蒜氨酸、大蒜辣素及大蒜粉在体内生成代谢产物,造成体内体外实验结果差异。肠球菌、肠杆菌是条件致病菌,在健康小鼠体内数量稳定,只有在病理状况下,肠球菌、肠杆菌才会大量繁殖。体外实验将肠球菌、肠杆菌在培养皿上大量繁殖,相当于模拟了病理条件下肠球菌、肠杆菌的生长状况,体内实验与体外实验的条件不一致,导致实验结果不一致。说明了蒜氨酸、大蒜辣素及大蒜粉在病理条件下对肠球菌、肠杆菌有抑菌作用,在正常条件下,对肠球菌、肠杆菌无抑菌作用。大蒜辣素及大蒜粉对乳杆菌在体外有较强的抑菌作用,而在体内使乳杆菌数量增加,可能是大蒜辣素及大蒜粉在体内使致病菌产气荚膜梭菌数量降低,导致有益菌乳杆菌数量增加,有益菌双歧杆菌数量增加也会促进乳杆菌增殖。综合体内体外实验结果,蒜氨酸、大蒜辣素、大蒜粉对肠道菌群具有有益的调节作用。
