双参数MRI影像组学模型对前列腺超高b值DWI高信号病变的诊断价值
2021-10-28王聪刘娜包丝雨曹乐辛迪卑贵光
王聪,刘娜,包丝雨,曹乐,辛迪,卑贵光
(1.中国医科大学北部战区总医院放射诊断科,沈阳 110812;2.北京深睿博联科技有限责任公司研发中心,北京 100080)
前列腺癌是最常见的男性恶性肿瘤,我国前列腺癌发病率及病死率逐年升高[1-2]。T2加权(T2 weighted imaging,T2WI)磁共振成像(magnetic resonance imaging,MRI)与弥散加权成像(diffusion weighted imaging,DWI)技术广泛应用于前列腺癌术前诊断[3],超高b值DWI(b=3 000 s/mm2)的应用也越来越广泛,但仍有部分患者良恶性鉴别诊断准确率较低,目前,经直肠超声(transrectal ultrasonography,TRUS)引导下穿刺活检仍是临床诊断金标准。TRUS受患者基础状态、医疗条件等多种因素限制,执行率较低,而且TRUS存在发生术后并发症的风险。因此,提高前列腺癌影像诊断准确率、减少术前不必要活检是目前急需解决的问题。近年来从医学图像中提取大量定量成像特征的影像组学[4]受到了广泛的关注,丰富的影像组学特征与机器学习方法相结合可以使诊断前列腺癌更加客观。与临床评估相比影像组学更有助于良恶性前列腺病变的鉴别[5-6]。本研究对前列腺超高b值DWI呈高信号病灶的双参数MRI图像进行影像组学特征分析,并与第二版前列腺影像报告和数据系统(the second edition of prostate imaging reporting and data system,PI-RADS v2)评 分系统进行比较,探讨MRI影像组学模型对前列腺病变良恶性的诊断价值。
1 材料与方法
1.1 临床资料
回顾性分析我院2016年1月至2019年8月期间就诊的前列腺病变患者的临床资料。纳入标准:(1)年龄>50岁,前列腺特异抗原(prostate specific antigen,PSA)升高且有排尿困难等临床症状;(2)超高b值DWI检查呈高信号且PI-RADS v2≥3分的前列腺病变;(3)MRI检查4周内进行TRUS引导下穿刺活检,获得病理结果。排除标准:(1)MRI检查前已行前列腺活检、放化疗及内分泌治疗等;(2)MRI图像质量不佳或病灶广泛转移累及较多其他组织。共81例患者纳入研究,年龄53~87岁,平均年龄71.7岁,总PSA为4.04~270.00 ng/mL,中位数为37.62 ng/mL。恶性47例,其中腺癌45例,鳞状细胞癌1例,移行细胞癌1例;Gleason评分≥(3+4)/(4+3)29例。良性34例,其中,前列腺良性增生(benign prostate hyperplasia,BPH)32例,前列腺炎2例。
1.2 检查方法
采用美国GE MR750 3.0T 扫描仪,盆腔线圈,患者仰卧位,范围覆盖整个盆腔进行检查,轴位T2WI压脂扫描参数为:激励2次,TR 6 524.0 ms,TE 91.0 ms,FOV 22 cm×22 cm,矩阵352×352,层厚5.0 mm,层间距0.5 mm。轴位DWI复制T2WI压脂扫描定位线,激 励2次,TR 2 000.0 ms,TE 60.2 ms,矩阵96×96,层厚5.0 mm,层间距0.5 mm,b=1 000 s/mm2、3 000 s/mm2的FOV 分别为28 cm×28 cm、30 cm×30 cm。
1.3 前列腺病灶PI-RADS v2评分
由2名具有10年以上腹部影像诊断学经验的医生共同协商对前列腺病灶进行PI-RADS v2评分,以病理结果为金标准,计算不同PI-RADS v2评分病变的阳性预测值(positive predictive value,PPV),并用受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)、灵敏度、特异度评价PI-RADS v2评分系统鉴别前列腺良恶性病变的效能。
1.4 穿刺活检
采用“12+1”穿刺活检法[7],取13条病理组织,活组织病理标本浸泡于中性甲醛中固定2 h,然后进行取材、脱水、透明、浸蜡、包埋、切片、染色等程序后由1名具有10年以上工作经验的病理科专家观察组织切片。
1.5 前列腺靶病灶分割及影像组学特征提取
将所有患者的横轴面T2WI压脂和DWI扫描(b=1 000 s/mm2、b=3 000 s/mm2)图像导 入Dr.Wise多模态科研平台(版本号1.6),利用平台自动勾画功能对DWI(b=3 000 s/mm2)序列上的病灶进行逐层勾画,由1名具有10年以上腹部影像诊断学经验的医生对勾画病灶的准确性进行评价,以DWI(b=3 000 s/mm2)勾画的病灶为标准对T2WI压脂及DWI(b=1 000 s/mm2)病灶进行逐层半自动勾画,1周后由同一名医生及另外1名同级别医生分别对病灶进行二次勾画,并对3次结果进行组内及组间一致性检验;所有患者的病灶勾画完成后采用B样条插值采样技术进行重采样,形成三维体素,然后通过软件自动提取出病灶7类影像组学特征,包括一阶特性、形状特征、纹理特征、亮度特征、灰阶运行长度矩阵、灰度判断矩阵、相邻的灰度级[8]。
1.6 特征筛选及建立影像组学特征预测模型
将提取的特征剔除缺失率>10%部分,然后进行特征间线性相关检查,剔除自相关性高(P≥0.9)的特征参数,再使用L1正则方法进行特征选择,采用随机森林(random forest,RF)方法构建诊断模型,按照7 ∶3的比例经计算机随机选取出训练组及验证组,并以5折交叉验证方法对诊断模型进行检验,利用MedCalc软件绘制出ROC 曲线及其检验模型的灵敏度和特异度。
2 结果
2.1 前列腺病灶PI-RADS v2评分
患者PI-RADS v2评分结果见表1。鉴别前列腺良恶性病变的ROC的AUC为0.653,95%CI为0.539~0.755,诊断灵敏度、特异度分别为0.717、0.486。

表1 81例患者PI-RADS v2评分结果Tab.1 PI-RADS v2 scores in 81 cases
2.2 病灶标注及特征降维结果
前列腺癌及前列腺良性增生典型病例图像见图1、图2。图A与图B对比可见自动勾画得到感兴趣区的准确性很高。组间一致性检验(intraclass correlation coefficient,ICC)结果为0.87~0.96。

图1 外周带及中央带右侧前列腺癌患者(79岁)图像Fig.1 Image of a 79-year-old patient with prostate cancer in the right peripheral and central zones

图2 外周带及中央带前部BPH患者(65岁)图像Fig.2 Image of a 65-year-old patient with benign prostatic hyperplasia in the anterior parts of the peripheral and central zones
81例患者靶病灶提取得到103个特征,103个特征剔除缺失率>10%的部分,然后进行特征间线性相关检查,剔除自相关性高(P≥0.9)的71个特征参数,再使用L1正则方法(系数=0.1)进行特征筛选,最后T2WI压脂和DWI b=3 000 s/mm2分别得到9个原始数据特征,DWI b=1 000 s/mm2得到10个特征,其中3个研究序列共有的特征参数2个(伸长率及球形度)。
2.3 影像组学模型对前列腺病变良恶性鉴别结果
经过特征清洗及筛选得到特征参数,采用RF法建模、并用5折交叉验证方法得到训练集及验证集在各个序列指标,T2WI压脂及各b值DWI序列在验证集的影像组学特征预测结果见表2,ROC曲线见图3。

表2 T2WI压脂及各b值DWI序列在验证集的影像组学特征预测结果Tab.2 Prediction results of radiomics characteristics of T2-weighted fat-pressing imaging and b-value DWI sequences in the verification set
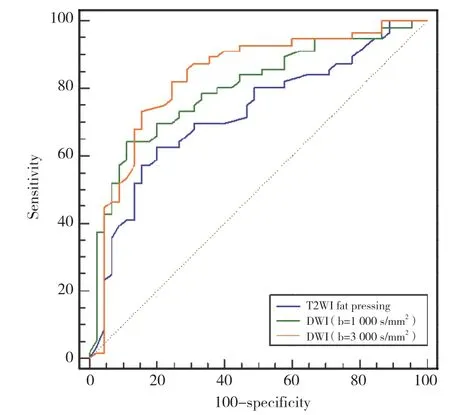
图3 验证集各序列ROC曲线Fig.3 Receiver operating characteristic curves of each sequence in the verification set
2.4 PI-RADS v2评分与影像组学模型诊断效能比较
利用MedCalc 19.2.0软件进行DeLong检验计算得出DWI b=1 000 s/mm2及DWI b=3 000 s/mm2的组学模型诊断效能结果显示,AUC分别为0.800、0.833,明显高于PI-RADS v2评分(均P< 0.05);T2WI压脂组学模型诊断效能的AUC为0.723,与PI-RADS v2比较无统计学差异(P> 0.05)。
3 讨论
T2WI压脂及 DWI是前列腺癌诊断中的重要序列,T2WI压脂能够清晰显示前列腺及其周围组织的解剖关系,可以较好显示病灶的大小及其侵袭范围,DWI公认为是鉴别前列腺病变良恶性的重要诊断序列,随着b值升高,前列腺癌病灶信号强度变化不明显,非癌组织信号明显减低,甚至接近背景噪声[9],超高b值对水分子扩散敏感度高,能降低组织微循环灌注的影响,对比度更高[10],本研究中81个超高b值高信号结节经病理证实有34个良性病变,PI-RADS v2评分系统特异度不高、仅为0.486。可能的原因包括:(1)前列腺良性病变超高b值显示为高信号可能是因为间质型结节、纤维腺瘤型结节和腺肌型结节等以基质型增生为主的前列腺良性增生含有较多胶原和基质细胞(纤维母细胞和平滑肌细胞),腺体及液体成分少,大量纤维组织使细胞外间隙减小、排列紧密,与前列腺癌的基本组织结构相似[11-12]。(2)根据T2WI压脂及DWI信号变化对前列腺病变进行PI-RADS v2评分无客观定量的诊断标准,在良恶性病变不够典型、信号差异不明显时PIRADS v2评分受影像诊断医生主观判断和工作经验等因素影响较大。因此,需要找到一种更加客观准确的影像诊断方法来提高诊断效能,减少术前不必要的活检。
影像组学是从医学图像中提取丰富的定量成像特征并与机器学习相结合的方法[4],使MRI解释更加客观,T2WI压脂和DWI序列是影像组学研究最常见的序列。本研究采用自动勾画DWI(b=3 000 s/mm2)序列病灶的感兴趣区,并以其范围为参考标准,进行DWI(b=1 000 s/mm2)及T2WI压脂序列的感兴趣区标注,这种标注方法减少了人工标注感兴趣区的主观因素影响,能够更客观提取病灶的组学特征。
研究[13-14]证明感兴趣的三维区域能更完整地描述病变,原则上能得到更可靠且不易受到采样误差影响的结果。本研究在逐层标注完成后采用B样条插值采样技术进行重采样形成三维体素,比二维体素提取出更多的影像组学特征,可完整、准确描述病变。
CHEN等[15]研究证明基于T2WI及DWI的表观弥散系数图的影像组学模型鉴别前列腺病变良恶性的验证模型诊断效能优于PI-RADS v2评分,陈丽华等[16]的研究证明影像组学模型能够很好鉴别前列腺PI-RADS v2 4分病变的良恶性,其效能超过临床模型及诺谟图模型。本研究建立了基于放射学的机器学习模型,用于前列腺PI-RADS v2 3~5分病变良恶性鉴别诊断评估。通过提取大量定量影像特征和有效特征选择,建立了基于RF的T2WI压脂和多b值DWI影像组学模型,T2WI压脂和DWI b=3 000 s/mm2分别得到9个原始数据特征,DWI b=1 000 s/mm2得到10个特征:(1)3个研究序列共有的特征参数有2个(伸长率、球形度),伸长率为肿瘤形状中最大长度和第二大长度的比值,取值为1时说明肿瘤为圆形,取值为0时说明肿瘤形状为线形;球形度是肿瘤区域相对于球体形状圆度的量度,取值范围:0<球形度≤1。取值越接近1表示肿瘤形状越接近球体。(2)T2WI压脂模型权重系数最大的特征为差异熵,为像素邻域强度值差异的随机性/变异性的度量,取值越大,说明图像中相邻区域亮度变化越明显。(3)DWI b=1 000 s/mm2、b=3 000 s/mm2模型权重系数最大的特征分别为熵、最大。熵为指定图像值中的不确定性/随机性,值越大说明图像越紊乱;最大为感兴趣区内的最大灰度强度。建模后验证RF模型中DWI b=1 000 s/mm2及b=3 000 s/mm2鉴别诊断前列腺病变良恶性的AUC分别为0.800、0.833,灵敏度分别为0.732、0.821,特异度分别为0.733、0.756。其灵敏度、特异度及AUC均明显超过PI-RADS v2评分(均P< 0.05),具有较高的诊断效能,实现了正确的诊断评估。与PI-RADS v2评分系统比较,T2WI压脂组学模型诊断效能优势不明显(P> 0.05),考虑与T2WI压脂序列良恶性病灶信号重叠区较多,半自动修改病灶感兴趣区时部分病灶边界勾画不够准确有关。
总之,MRI影像组学模型能够客观准确鉴别前列腺超高b值DWI高信号病变的良恶性,其诊断效能明显高于PI-RADS v2评分系统,减少了不必要活检给患者带来的痛苦。本研究的局限性:(1)所有病理结果都是经TRUS活检证实,缺乏根治性前列腺切除标本的进一步验证。(2)因前列腺癌患者年龄较大、TRUS活检受限导致采样困难;本研究样本量较小,可能导致研究结果偏倚。今后进一步的研究应包括更大的研究人群,积极推广标准化多中心研究[17-18]及其他外部验证队列来测试重复性,以此促进研究成果的推广使用。
