右美托咪啶减轻急性肺损伤的机制研究
2021-10-28何凤娟范国华
李 洁,何凤娟,范国华
(1.武汉大学人民医院胸外科,湖北 武汉 430061;2.武汉大学人民医院乳甲外科,湖北 武汉 430061)
急性肺损伤(acute lung injury,ALI)以弥漫性肺泡损伤、肺通透性增加和富含蛋白质的肺水肿为特征[1]。感染、缺血再灌注损伤和外伤已经被证实是导致ALI最常见的原因。在脓毒症诱导的ALI中,紊乱的炎症导致肺泡上皮细胞和内皮细胞损伤甚至死亡,最终可诱发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)甚至死亡[2-4]。铁死亡是近年来新发现的一种细胞死亡形式,是一种铁依赖的以脂质过氧化为主要特征的细胞程序性死亡。转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是一系列抗氧化基因的转录因子,具有抑制细胞铁死亡的作用[5]。既往研究显示,脓毒血症可导致肺上皮细胞和内皮细胞的铁死亡,加重ALI[6]。因此,以激活肺组织Nrf2并降低铁死亡水平为目标进行干预是预防和治疗ALI的重要策略。
右美托咪啶(dexmedetomidine,Dex)是一种高效的α2-肾上腺素受体激动剂,具有镇静和镇痛双重作用。既往研究显示,Dex还具有多种器官保护作用[7]。研究显示,Dex可通过激活中枢α2-肾上腺素受体减轻脓毒症相关的炎症和认知功能障碍[8]。同时,Dex还可通过线粒体自噬减轻七氟醚诱导的神经毒性[9]。此外,Dex预处理可通过激活Nrf2减轻心肌缺血再灌注引起的急性肾损伤和内质网应激[10]。Dex也被报道可通过多种机制发挥抗ALI的作用,包括抑制炎症小体激活、维持线粒体动态平衡、抑制上皮细胞凋亡等[11-12]。但Dex是否可以通过激活Nrf2减轻肺组织铁死亡目前尚未见文献报道。本研究拟通过腹腔注射脂多糖(lipopolysaccharides,LPS)的方式构建小鼠ALI模型,同时观察Dex干预对小鼠ALI的影响,检测Dex干预后ALI小鼠肺组织铁死亡标志物及Nrf2蛋白的水平,以探讨Dex对小鼠ALI的潜在作用机制。
1 材料与方法
1.1 实验试剂
脂多糖(批号:HY-D1056-100201)、Dex(批号:HY-17034A-15387,纯度:98.54%)均购自Medchem Express公司;苏木素—伊红(HE)染色试剂盒购自上海歌凡生物科技有限公司);一抗:GAPDH(批号:ab8245)、胱甘肽过氧化物酶(GPX4,批号:ab125066)、环氧合酶(COX2,批号:ab179800)、Nrf2(批号:ab62352)、羊抗兔IgG(批号:ab124055)均购自美国Abcam公司。
1.2 实验动物及模型建立
SPF级雄性C57BL/6小鼠32只,6~8周,体质量225~270 g,由湖北省预防医学科学院动物中心提供。将小鼠随机分为空白对照组(Sham组)、右美托咪啶组(Dex组)、脂多糖组(LPS组)和药物干预组(LPS+Dex组)。LPS组和LPS+Dex组小鼠腹腔注射10 mg/kg LPS构建小鼠ALI模型[13];Dex组及LPS+Dex组小鼠腹腔注射Dex(40 μg/kg);Sham组和LPS组注射等剂量生理盐水[6]。12 h后,采用颈椎脱臼法处死小鼠,迅速分离小鼠左肺与右肺,并将其分别置于10%中性福尔马林溶液和-80 ℃冻存。
1.3 HE染色
左肺样本在10%中性福尔马林溶液中固定7 d后,用石蜡包埋并切片。将肺组织石蜡切片于60 ℃下烤片后,于二甲苯和梯度酒精中脱蜡并水化。苏木素染细胞核,伊红染细胞质,脱水封片后在光学显微镜下观察各组肺组织的形态。小鼠肺损伤程度依据肺水肿、炎症细胞浸润、出血、肺不张和透明膜的形成等5项指标分别进行评分:0分,肺血管、肺泡、间质及支气管均正常;1分,病变范围小于整个视野面积;2分,病变范围为整个视野面积的25%~50%;3分,病变范围为整个视野面积的50%~75%;4分,病变范围大于整个视野面积的75%。
1.4 qRT-PCR检测相关促炎基因的表达
使用RNeasyMini Kit试剂盒提取小鼠右肺组织中总RNA,通过紫外分光光度法检测总RNA样本浓度和纯度,并通过反转录合成cDNA。将各样本的cDNA分别配制好实时定量PCR体系,并于实时定量PCR仪进行扩增。以GAPDH为内参基因对各样本目的基因进行校正。各基因qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.5 Western blot检测相关蛋白的表达
提取各组小鼠右肺组织总蛋白,随后将其于80~120 V电压下进行SDS-PAGE电泳。100 min后,将凝胶中的蛋白进行转膜1.5 h,随后分别用抗GPX4(1∶500)、COX2(1∶200)、Nrf2(1∶500)及GAPDH(1∶1 000)的一抗在4 ℃下孵育过夜。次日,用二抗(羊抗兔)稀释液(1∶5 000)于室温避光孵育50 min。孵育结束后,使用Odyssey扫膜仪对各蛋白条带进行扫描并定量,以GAPDH作为内参蛋白对各样本目的蛋白进行校正。
1.6 统计学方法

2 结果
2.1 各组小鼠肺组织HE染色结果对比
与Sham组相比,LPS组小鼠肺组织出现了明显的病理学损伤,表现为肺水肿,肺泡腔炎症细胞和红细胞浸润,其肺损伤评分明显升高(4.21±0.43vs.1.09±0.54,P<0.05);与LPS组相比,LPS+Dex组小鼠肺损伤明显减轻且肺损伤评分明显降低(2.11±0.36vs.4.21±0.43,P<0.05),见图1。

*:与Sham组比较,P<0.05;#:与LPS组比较,P<0.05
2.2 各组小鼠肺组织促炎性细胞因子mRNA表达比较
与Sham组相比,LPS组小鼠肺组织中促炎性细胞因子,包括IL-1β、TNF-α、IL-6和MCP-1 mRNA表达水平明显升高(P<0.05);与LPS组相比,LPS+Dex组小鼠肺组织中IL-1β、TNF-α、IL-6 和MCP-1 mRNA表达水平明显降低(P<0.05),见表2,表明Dex可减轻ALI小鼠肺组织炎症反应。

表2 各组小鼠肺组织促炎性细胞因子mRNA表达比较
2.3 各组小鼠肺组织铁死亡水平比较
Western blot结果显示,与Sham组相比,LPS组小鼠肺组织中GPX4的蛋白表达水平明显降低(P<0.05),而COX2的蛋白表达水平明显升高(P<0.05);与LPS组相比,LPS+Dex组小鼠肺组织中GPX4蛋白表达水平明显升高(P<0.05),而COX2蛋白表达水平明显降低(P<0.05),见图2,表明Dex可抑制ALI小鼠肺组织铁死亡。

*:与Sham组比较,P<0.05;#:与LPS组比较,P<0.05
2.4 各组小鼠肺组织Nrf2蛋白的表达
Western blot结果显示,与Sham组相比,LPS组小鼠肺组织中Nrf2的蛋白表达水平明显降低(P<0.05);与LPS组相比,LPS+Dex组小鼠肺组织中Nrf2的蛋白表达水平明显升高(P<0.05),见图3。
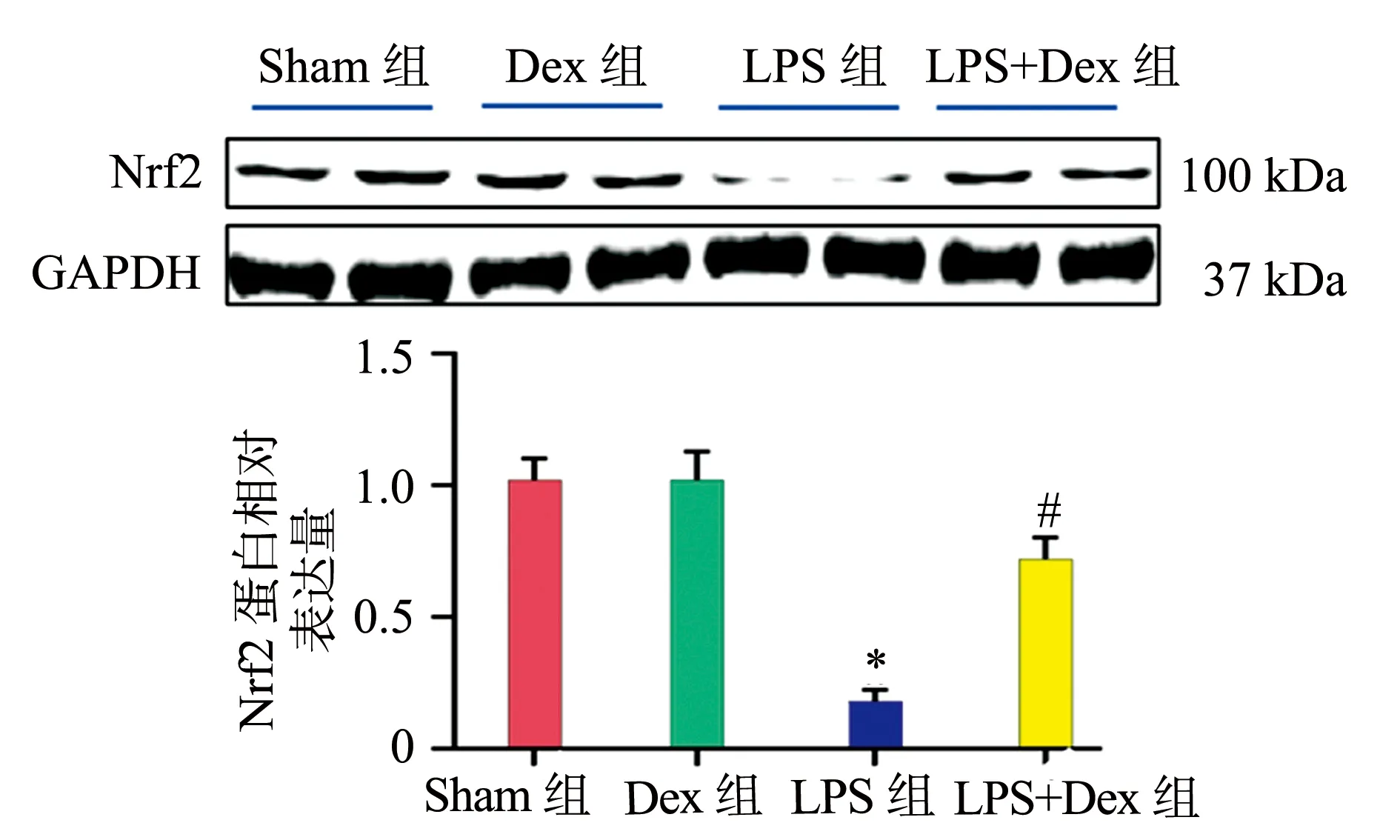
*:与Sham组比较,P<0.05;#:与LPS组比较,P<0.05
3 讨论
肺是哺乳动物与外界环境直接接触的最大上皮表面,是气体交换的主要器官。同时,肺也是机体重要的免疫器官,肺组织中存在一定量的免疫细胞,一旦受到外界刺激可诱导免疫反应[14-15]。由于与外界环境的直接接触,肺也更容易受到外界病原体和毒害物质的攻击,易发生ALI甚至ARDS。ALI是机体对严重肺部微生物感染的反应,是免疫识别病原体引起的促炎免疫反应的结果。ALI可引起局部或全身不可逆的损伤,造成富含蛋白质的液体静力性肺水肿、难治性低氧血症、呼吸困难,甚至死亡[16]。本研究结果显示,LPS(10 mg/kg)注射12 h可诱发明显的小鼠肺损伤和炎症反应;同时,LPS组小鼠肺组织中铁死亡水平较Sham组小鼠明显升高,表明LPS可诱发小鼠肺组织的铁死亡。而40 μg/kg Dex可明显减轻小鼠肺损伤和炎症反应,同时降低小鼠肺组织铁死亡水平;且Dex可明显上调小鼠肺组织中Nrf2的蛋白表达,因此,我们推测Dex发挥肺保护作用及抑制铁死亡的作用可能与Nrf2的激活有关。
Nrf2是一种细胞抗氧化反应的关键调节因子,可调控抗氧化和亲电应激的基因表达。许多疾病的发生与细胞氧化还原稳态的失衡有关,说明抗氧化防御系统在防止与活性氧自由基(reactive oxide species,ROS)积累相关的疾病中发挥重要作用[5]。近年来,越来越多的研究证实,脂质过氧化产物是诱发实体器官损伤的重要驱动因素[17-18]。铁死亡是一种铁依赖的脂质过氧化驱动的新型细胞死亡方式[19]。Nrf2已经被证实可通过多种机制抑制铁死亡,包括调控铁代谢基因、中间代谢基因及谷胱甘肽合成相关基因。研究表明,Nrf2激活可通过抑制肺上皮细胞铁死亡减轻LPS及缺血再灌注诱导的小鼠ALI[5]。GPX4可在谷胱甘肽的辅助下通过催化作用去除细胞内脂质过氧化,减轻细胞铁死亡。GPX4的抑制或敲除可使细胞氧化还原稳态失衡,发生铁死亡。COX2是炎症反应重要的诱导酶,同时也是铁死亡重要且敏感的标志蛋白之一[5-6]。本研究发现,LPS刺激可明显抑制小鼠肺组织中Nrf2和谷胱甘肽过氧化物酶GPX4表达,同时促进肺组织中COX2的表达。
Dex是一种脂溶性α2-肾上腺素受体激动剂,1999年首次作为镇静镇痛药物应用于临床[7]。由于Dex对呼吸系统和循环系统的抑制作用较弱,其目前主要被用于重症监护病房患者的镇静镇痛,以及围术期的麻醉辅助。研究发现,Dex可改善限制性肺疾病和肥胖患者的肺氧合功能[20]。Dex也可以通过抑制NLRP3炎症小体的激活来缓解LPS诱导的ALI[21]。此外,Dex还可通过HIF-1α/HO-1信号通路维持线粒体动态平衡以改善ALI[6]。不同于上述研究,本研究首次发现Dex预处理可明显上调Nrf2和GPX4的表达,同时抑制COX2的表达,表明Dex可能通过激活Nrf2减轻LPS诱导的肺组织铁死亡,最终发挥肺保护作用。
综上所述,本研究首次揭示了Dex减轻脓毒症肺损伤的新机制——通过激活Nrf2抑制肺组织铁死亡,这可为今后临床ALI的预防和治疗提供一定的参考。
