COPD急性加重期患者血清白细胞介素6、降钙素原、超敏C反应蛋白水平与甲状腺功能的相关性研究
2021-10-28曹丽娇袁开芬
曹丽娇 袁开芬
昆明医科大学第二附属医院呼吸内科三病区 650101
COPD是一种以持续呼吸道症状和气流受限为特征的常见的、可以预防和治疗的异质性疾病,其居全球死亡原因的第4位,随着发展中国家吸烟率的升高和高收入国家老龄化加剧,预计COPD的发病率在未来40年仍会继续上升,到2060年可能每年有超过540万人死于COPD[1],共患慢性病可增加COPD的致残率和病死率。慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)是COPD的急性恶化,也是死亡的重要原因。近年来,越来越多的研究者开始关注AECOPD对内分泌系统的影响[2],AECOPD的发病与炎症细胞因子和免疫相关分子介导的肺部和循环系统中的炎症反应及免疫调节有关[3],炎症细胞因子也可作用于下丘脑-垂体-靶腺轴,引起甲状腺激素异常[4],同时甲状腺激素可通过影响吞噬作用、趋化作用、氧化应激或细胞因子的产生来调节免疫系统并影响炎症过程[5]。IL-6、超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CRP)和降钙素原(procalcitonin,PCT)是临床上常用来反映免疫炎症损伤和感染严重程度的指标[6],这些炎性指标与甲状腺功能之间的关联可能在AECOPD的发生、进展和管理中发挥重要作用,但具体的机制目前尚未无明确定论,甲状腺激素的病理作用在很大程度上尚待探索,故本研究围绕AECOPD患者血清IL-6、PCT、hs-CRP水平与甲状腺功能的相关性进行探讨。
1 资料与方法
1.1 病例选择 回顾性研究。选取2017年5月至2020年5月在昆明医科大学第二附属医院呼吸与危重症医学科三病区住院治疗,且符合2017年慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)诊断标准的AECOPD患者157例,按甲状腺功能状态分为甲状腺功能正常组和甲状腺功能异常组。AECOPD合并甲状腺功能正常者114例,男97例、女17例,年龄(69.21±8.63)岁,年龄范围为39~88岁;AECOPD合并甲状腺功能异常者43例,男36例、女7例,年龄(71.30±9.50)岁,年龄范围为47~89岁。本研究经所有患者知情同意并签署知情同意书。纳入标准:符合中国AECOPD诊治专家组制订的《慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)》,即COPD患者出现急性加重的呼吸系统症状(临床典型表现以咳嗽加剧、痰量增多和/或痰液呈脓性、呼吸困难加重为主)超出日常变异,以致不得不更改药物治疗[7]。排除标准:排除既往已诊断甲状腺疾病并经药物/I131/甲状腺手术治疗,排除支气管哮喘、肺癌、肺栓塞、高血压、冠状动脉粥样硬化性心脏病、糖尿病、血液系统疾病、慢性肝炎、恶性肿瘤和脏器功能衰竭、免疫系统疾病和使用免疫抑制剂患者及近3个月服用过对甲状腺功能有影响的药物者。
1.2 方法
1.2.1 数据收集 收集患者入院资料,包括一般资料:性别、年龄、体质量、身高、吸烟史、糖皮质激素应用史,计算体质量指数(body mass index,BMI)=体质量/身高2(kg/m2)。实验室资料包括甲状腺功能:血清三碘甲状腺原氨酸(triiodothyronine,TT3)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、四碘甲状腺原氨酸(tetraiodothyronine,TT4),游离四碘甲状腺原氨酸(free tetraiodothyronine,FT4)和促甲状腺激素(thyroid-stimulating hormone,TSH);血常规:白细胞(white blood cells,WBC);急性感染三项:IL-6、PCT、hs-CRP;N末端B型利钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP);凝血:纤维蛋白原(fibrinogen,Fib)、D-二聚体(D dimer,D-D);生化:前白蛋白(precursor albumin,PAB)、白 蛋 白(albumin,ALB)、尿酸(uric acid,UA)、肌酐(creatinine,Cr)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C);肺功能:[FVC、第1秒用力呼气容积(forced expiratory volume in the first second,FEV1)、最大呼气流量(peak expiratory flow,PEF)、FEV1/FVC、FEV1%pred];血气分析:PaO2、PaCO2;超声心动图:肺动脉压力、射血分数、右室流出道、右房内径、右室内径、左房内径、左室内径。
1.2.2 检测仪器 应用日本希森美康公司生产的血液分析仪及配套试剂测定血细胞;应用美国BECKMAN公司生产的AU400分析仪检测生化全套;应用美国雅培公司生产的全自动免疫发光仪i2000SR测血清甲状腺功能;应用瑞士HAMILYON公司生产的全自动荧光免疫分析仪及配套试剂,通过免疫化学发光定量法测定IL-6、PCT;应用中国普门公司生产的PA900特定蛋白分析仪测hs-CRP;应用德国罗氏公司生产的COBAS E601全自动酶联免疫分析NT-proBNP;应用法国STAGO公司生产的全自动凝血分析仪及配套试剂通过免疫比浊法测定凝血功能;应用德国罗氏公司生产的COBAS E123全自动血气分析仪测动脉血气分析;应用德国耶格公司生产的MasterScreen肺功能检测仪器检查肺功能;应用荷兰飞利浦公司生产的CX50经胸超声心动图检查仪测超声心动图。
1.3 统计学分析 采用SPSS 25.0软件进行分析。符合正态分布的计量资料采用表示,2组间比较采用独立样本t检验;不服从正态分布的计量资料采用M(QR)表示,组间比较采用两独立样本秩和检验;计数资料采用例(%)表示,组间比较采用χ2检验;等级资料采用频数(%)/例(%)表示,采用两独立样本秩和检验进行组间比较;相关性采用Spearman相关分析,危险因素分析采用Logstic回归。P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺功能状态比例 AECOPD患者中有114例(114/157,72.6%)甲状腺功能在正常范围,43例(43/157,27.4%)甲状腺功能在异常范围。甲状腺功能异常中包括26例(26/157,16.6%)非甲状腺疾病综合征(nonthyroid illness syndrome,NTIS),8例(8/157,5.1%)甲状腺功能减退,3例(3/157,1.9%)亚临床甲状腺功能减退,6例(6/157,3.8%)亚临床甲状腺功能亢进。在NTIS中,低T3正常T4亚型17例(17/26,65.4%);低T3低T4亚型6例(6/26,23.1%);高T4亚型3例(3/26,11.5%)。
2.2 一般资料比较 2组间性别、年龄比较,差异均无统计学意义(P值均>0.05),具有可比性。2组间糖皮质激素应用史比较,差异有统计学意义(χ2=4.949,P<0.05)。2组间BMI、吸烟史比较,差异均无统计学意义(P值均>0.05)。见表1。

表1 2组患者一般资料比较
2.3 实验室资料比较
2.3.1 检验指标比较 AECOPD合并甲状腺功能异 常 组WBC、IL-6、PCT、hs-CRP、D-D、NT-proBNP高于AECOPD合并甲状腺功能正常组,差异均有统计学意义(P值均<0.05);而AECOPD合并甲状腺功能异常组PAB、ALB、PaO2低于AECOPD合并甲状腺功能正常组,差异均有统计学意义(P值均<0.05)。2组间UA、Cr、TC、TG、HDL-C、LDL-C、Fib、PaCO2比较,差异均无统计学意义(P值均>0.05)。见表2。
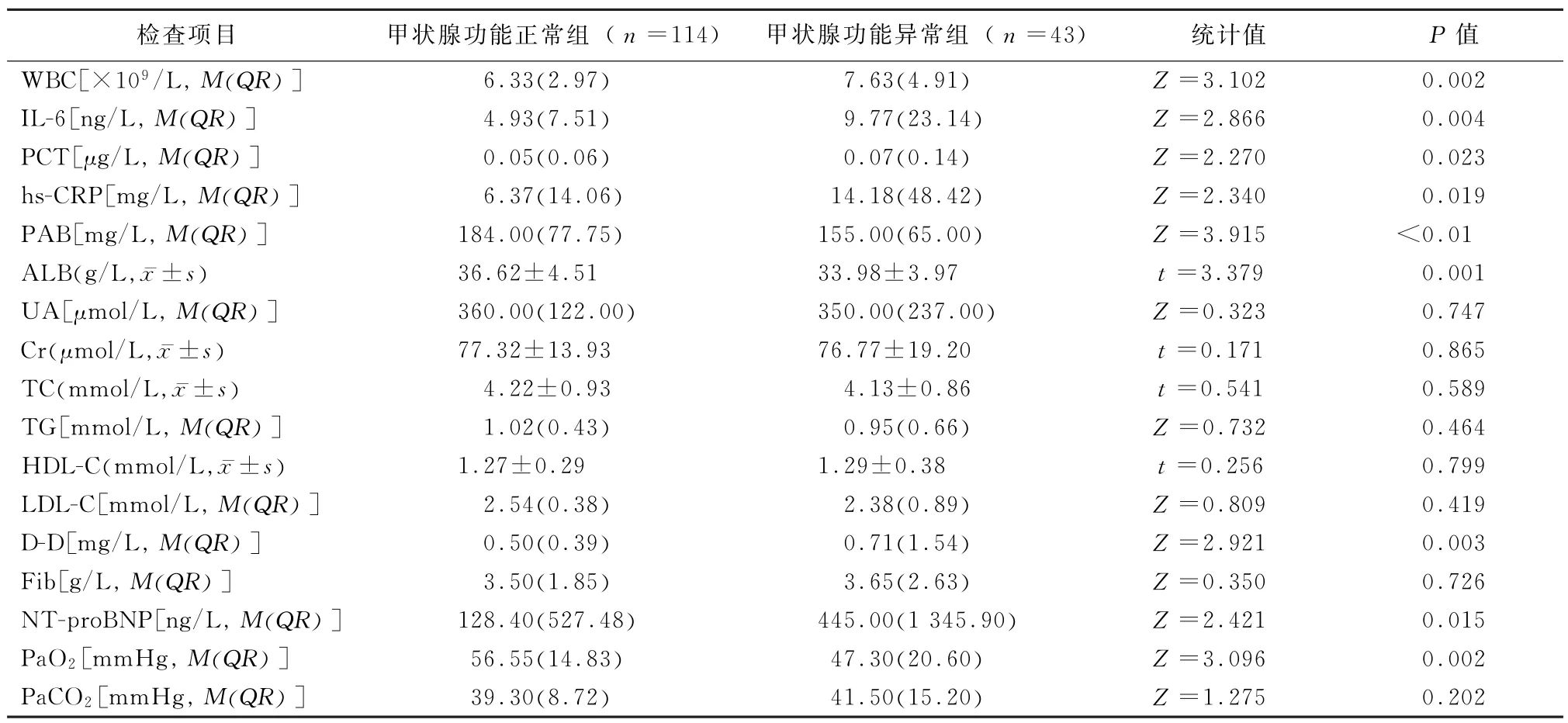
表2 2组患者感染指标、生化、凝血功能、血气分析等检验指标比较
2.3.2 检查结果比较 AECOPD合并甲状腺功能异常组肺功能FVC、FEV1、PEF均低于AECOPD合并甲状腺功能正常组,差异均有统计学意义(P值均<0.05)。AECOPD合并甲状腺功能异常组肺动脉压力高于AECOPD合并甲状腺功能正常组,差异有统计学意义(Z=2.056,P<0.05)。而2组间射血分数、右室流出道、右室内径、右房内径、左室内径、左房内径比较,差异均无统计学意义(P值均>0.05)。见表3。
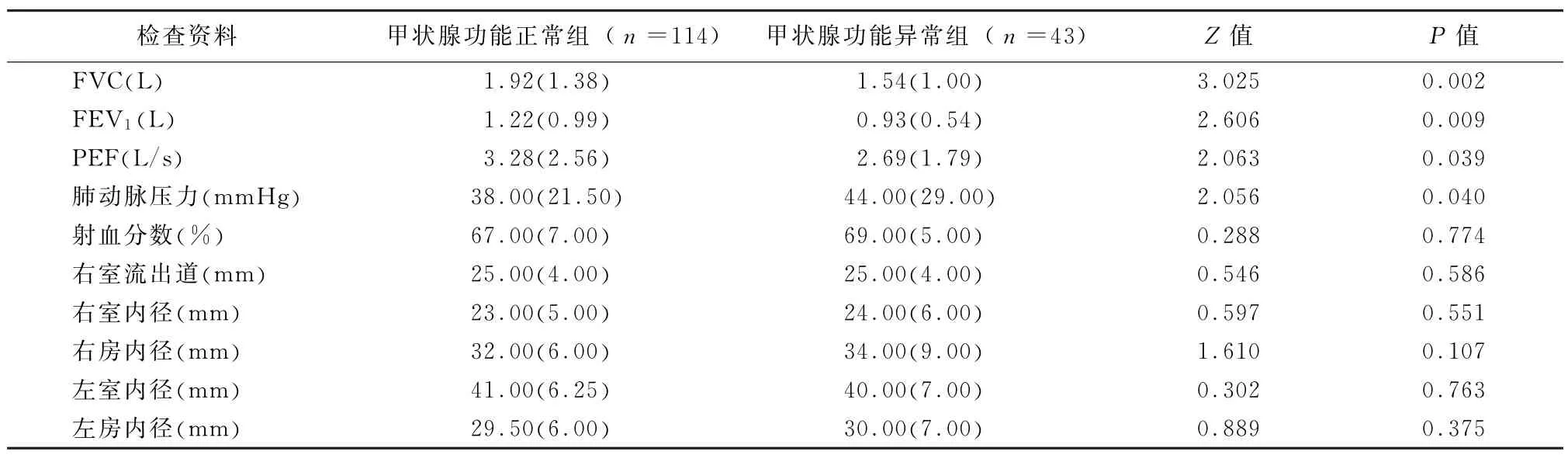
表3 2组患者肺功能、心脏彩超等检查资料比较[M(QR)]
2.3.3 2组患者气流受限严重程度的肺功能分级分析 根据FEV1%pred进行分级,分为轻度(FEV1%pred≥80%);中度(50%~79%);重度(30%~49%);极重度(<30%)。肺功能分级资料为等级资料,采用两独立样本秩和检验比较,结果显示:在AECOPD合并甲状腺功能正常组和AECOPD合并甲状腺功能异常组之间气流受限的严重程度比较差异有统计学意义(Z=2.173,P<0.05),在轻度、中度肺功能分级中,2组占比为甲状腺功能正常组>甲状腺功能异常组;在重度、极重度肺功能分级中,2组占比为甲状腺功能异常组>甲状腺功能正常组。见表4。

表4 2组患者FEV1%pred比较[例(%)]
2.4 IL-6、PCT、hs-CRP与甲状腺功能指标的相关性分析 IL-6、PCT、hs-CRP与TT3均呈负相关(r=-0.331、-0.380、-0.349,P值均<0.05);与FT3均呈负相关(r=-0.392、-0.383、-0.429,P值均<0.05);而与TSH、TT4、FT4均无相关性(P值均>0.05)。见表5。
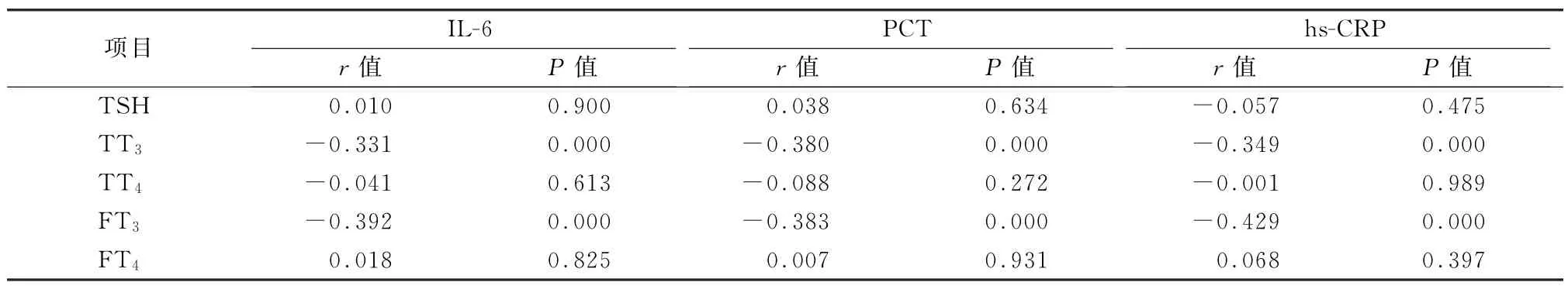
表5 IL-6、PCT、hs-CRP与甲状腺功能指标的相关性分析
2.5 影响AECOPD甲状腺功能的多因素Logstic回归分析 将全部变量纳入Logstic回归分析,采用逐步回归法筛选自变量,甲状腺功能分组作为因变量,纳入二元Logstic回归模型进行逐步回归分析后,结果提示IL-6、ALB、PaO2是引起AECOPD患者甲状腺功能异常的影响因素(P值均<0.05)。见表6。
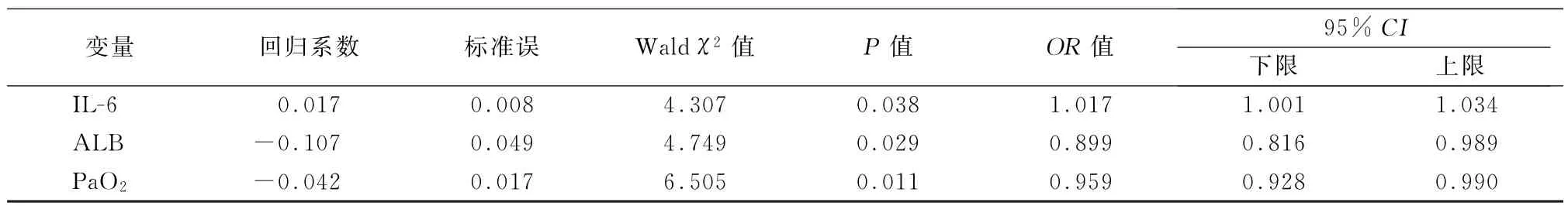
表6 影响AECOPD患者甲状腺功能的多因素Logstic回归分析
3 讨论
目前研究表明COPD不仅是一种慢性、进行性的气道和肺部的炎性疾病,同时还是累及全身的慢性系统性炎症综合征[8]。COPD的发病机制复杂,免疫系统调节紊乱可能是其原因之一[9]。由于机体处于长期的慢性炎症反应、氧化及抗氧化失衡等状态,COPD也会产生相应的肺外效应,包括心血管疾病、骨骼肌功能障碍、代谢性疾病及甲状腺功能障碍等[10]。NTIS是指非甲状腺疾病所致的血清中T3降低的综合征,主要表现为TT3、FT3水平降低,TT4、FT4水平降低、正常或升高,TSH正常。NTIS是COPD患者甲状腺功能损害中最常见的类型,既往研究显示COPD稳定期合并NTIS约20.0%,而AECOPD可高达70.0%[11]。本研究显示,AECOPD合并甲状腺功能异常者约27.4%(43/157),NTIS占16.6%(26/157),表明甲状腺激素代谢紊乱在COPD患者,特别是AECOPD中是很常见的,但临床工作中一直未受到足够重视。
AECOPD可通过全身性炎症反应、低氧及高碳酸血症、糖皮质激素的给药等干扰甲状腺激素的平衡。多数研究表明,肺泡巨噬细胞和中性粒细胞不断产生IL-1b、肿瘤坏死因子α、IL-8、IL-6、PCT和hs-CRP使COPD患者慢性全身性炎症持续存在[12],炎症介质释放可造成血管内皮损伤,激活全身凝血系统,使得D-D升高,并与疾病进展和频繁发作相关[13],本研究中AECOPD合并甲状腺功能异常组炎症指标WBC、IL-6、PCT、hs-CRP、D-D均高于甲状腺功能正常组,本研究结论与大多数文献相符。甲状腺激素是机体代谢活动的关键因素,其可调节细胞的能量与物质代谢、蛋白质的生物合成,参与机体的代谢和氧耗[14]。甲状腺激素过多会引起骨骼肌蛋白大量分解,出现消瘦和肌无力,不足时则会使蛋白质合成减少,AECOPD患者常处于营养失衡状态,进食不足、体质量减轻,脂肪组织的大量分解和脂肪酸的氧化使机体脂肪储备能力下降,且蛋白质代谢主要是以骨骼肌消耗为主,总体蛋白质合成减少和分解速度增加[15],本研究甲状腺功能异常组的PAB、ALB降低,结论与多数研究相符。此外,甲状腺激素可作用于呼吸道的受体或通过改变代谢率而影响呼吸驱动[11],本研究中甲状腺功能异常组FVC、FEV1、PEF均低于甲状腺功能正常组,重度、极重度分布在甲状腺异常组比例大于甲状腺功能正常组,表明AECOPD合并甲状腺功能异常患者多为重度、极重度气流受限,且甲状腺功能异常组AECOPD患者肺功能分级重度、极重度分布的比例大于甲状腺功能正常组,提示肺功能较差的AECOPD患者更易发生甲状腺功能异常,或AECOPD合并甲状腺功能异常者气流受限程度更容易发展为重度至极重度。COPD患者随着疾病进展可继发肺动脉高压、肺源性心脏病、心力衰竭,伴发心功能不全并水肿时给予利尿剂治疗后碘随尿排出,伴发肾功能损伤时肾血流量减少,碘在肾小管中重吸收减少,体内碘进一步减少,机体缺碘从而导致TT3、TT4减少[16],COPD患者右心负荷增加,与缺氧协同可使有效射血分数降低,外周组织灌注减少,可妨碍甲状腺激素的合成和释放[17],并可增加患者的病死率。本研究中甲状腺功能异常组NT-proBNP、肺动脉压力等高于正常组,证实这一结论,并提示甲状腺功能异常可能在一定程度上参与病程进展。AECOPD患者长期处于慢性缺氧状态,本研究甲状腺功能异常组PaO2低于甲状腺功能正常组,证实低氧血症可引起甲状腺功能损害,另有研究表明高碳酸血症也会对甲状腺功能产生影响,但本研究中2组PaCO2差异无统计学意义,考虑为在AECOPD患者中缺氧对甲状腺激素的代谢影响比高碳酸血症更大。
AECOPD具有异质性,感染是其主要诱因,当机体感染后,白细胞可随之释放IL及肿瘤坏死因子,细胞因子和炎症介质中的促炎介质相互趋化、促发,参与炎症反应[1]。而IL-6是人体重要的促炎因子,产生过多则会诱发血管内皮细胞及微循环的一系列炎症改变[18]。PCT是由甲状腺C细胞产生的前肽糖蛋白,从肺和肠的神经内分泌细胞分泌,能有效地评价细菌感染严重程度,并且可以鉴别局部细菌感染和全身性细菌感染[19]。CRP是急性炎症期由肝脏合成的一种球蛋白[20],CRP能与肺炎双球菌C多糖起反应,在机体发生化脓性感染时,白细胞水平升高,CRP水平也会明显升高,其升高的幅度与感染的程度呈正相关[21]。hs-CRP是采用超敏感方法检测到的CRP,两者是同一物质。本研究中IL-6、PCT、hs-CRP与TT3、FT3均呈负相关,与Sebina等[22]研究IL-6可影响血清甲状腺激素水平,其与TT3和TT3/TT4相关一致,提示IL-6、PCT、hs-CRP与甲状腺激素之间存在相互影响。炎症期间,IL-6可独立或与其他细胞因子相互作用对许多内分泌系统产生调节,除对血管内皮细胞及炎症细胞具有直接激活和毒性作用外,更主要的是诱导急性时相蛋白PCT、hs-CRP的合成[23],而IL-6、PCT、hs-CRP分泌异常可抑制脱碘酶的活性[24],降低肝肾组织脱碘酶-1和骨骼肌脱碘酶-2的活性,使T4转化为T3的量减少,通过增加肝和骨骼肌中脱碘酶-3的活性,使T4转化为r T3、T2增多,而T3减少[25],最终使甲状腺功能异常。AECOPD患者中由于长期营养不良引起的低蛋白血症可使机体甲状腺结合球蛋白合成不足,进而对血清甲状腺激素水平产生影响[26]。缺氧使T4的内环脱碘酶被激活,而5'-脱碘酶活性下降,外周组织TT4向TT3转化的速率减慢,导致TT3生成减少,TT4总量不变或轻度降低,最终使甲状腺功能异常[27]。总之,炎症指标可影响甲状腺功能,IL-6、ALB、PaO2是引起AECOPD患者甲状腺功能异常的危险因素。
AECOPD患者甲状腺功能异常并不少见,临床医师应引起足够重视。Marchiori等[28]研究表明,甲状腺功能减退患者使用甲状腺素治疗后促炎细胞因子显著减少,抗炎细胞因子明显增加。陈绍稀等[29]的meta分析表明,适量补充甲状腺激素可明显改善心力衰竭患者的心功能指标。且国内较多研究均表明,使用小剂量甲状腺素替代治疗可以逆转COPD患者因甲状腺激素不足带来的大多数负面影响。对于甲状腺功能亢进患者的肺功能在治疗甲状腺功能亢进后也能有所改善。
综上所述,可认为甲状腺激素水平在COPD的发生、发展中具有一定作用,维持甲状腺功能正常对于COPD的改善有益且可降低其急性发作频率,且通过监测甲状腺功能有助于评估患者机体状态,并改善其预后。
利益冲突所有作者均声明不存在利益冲突
