共刺激受体:肿瘤免疫疗法的潜在靶点
2021-10-28张伟明孙坚萍综述赵艳审校
张伟明 孙坚萍 综述 赵艳 审校
恶性肿瘤是疾病相关死亡的主要原因之一,且发病率不断上升,严重威胁人类健康[1]。T细胞功能的正常发挥依赖其表面共刺激和共抑制受体的共同作用,共抑制受体防止免疫细胞过度活化造成的机体损伤,但肿瘤能“劫持”此机制来进行免疫逃逸。共刺激受体能促进T细胞的活化、增殖及效应性细胞因子的分泌[2-3]。免疫检查点抑制剂(Immune check point inhibitor,ICI)如Nivolumab和Tremelimumab现已成为治疗晚期肿瘤的主要方式之一,但单用时只对约20%的肿瘤患者有治疗效果,而几种ICI联用时治疗效果会显著提升[4]。体外试验中,共刺激受体激动性抗体能增强免疫细胞的效应功能,抑制肿瘤的生长,因此可作为肿瘤免疫疗法的靶点,单用或联合ICI进一步提高抗肿瘤疗效。现对几种共刺激受体在肿瘤免疫疗法中的作用综述如下。
1 糖皮质激素类诱导的TNFR相关蛋白(Glucocorticoid-induced TNFR-related protein,GITR)
GITR在活化的CD4+和CD8+T细胞及调节性T细胞(T regulatory cells,Treg)上高表达,自然杀伤(Nature killer,NK)细胞、B细胞、巨噬细胞也表达GITR。GITR配体GITRL主要表达于抗原提呈细胞(Antigen presenting cells,APCs)。GITR与GITRL结合后能促进T细胞的活化、增殖及细胞毒性并能抑制Treg的功能[5]。
在肿瘤微环境(Tumor microenvironment,TME)中,GITR在肿瘤浸润淋巴细胞(Tumor infiltrating lymphocytes,TILs)中的Treg上高表达。肿瘤细胞表达GITR或GITRL,肿瘤细胞上的GITR可与TILs上的GITR竞争性结合GITRL,抑制抗肿瘤免疫,肿瘤细胞上的GITRL与NK细胞上的GITR结合后能抑制NK细胞的细胞毒性[6-7]。在乳腺癌中,肿瘤细胞上表达的GITR与患者的不良预后相关[7]。
GITR激动性抗体有DTA-1和TRX518等。体外试验中,DTA-1能促进CD4+和CD8+T细胞的增殖及细胞因子的分泌,具有抗肿瘤活性[8]。TRX518能通过增强CD8+T细胞的细胞毒性并抑制Treg的活性来发挥抗肿瘤作用。临床试验中,单用TRX518治疗晚期肿瘤时,抗肿瘤效果有限。在纳入的43例患者中,29例疾病进展(Progression disease,PD),4例疾病稳定(Stable disease,SD)。TRX518和抗程序性细胞死亡受体1(Anti-programmed cell death receptor 1,PD1)联用时,最先纳入的3例患者中可见1例完全缓解(Complete response,CR),1例部分缓解(Partial response,PR),1例SD[9]。
2 CD137
CD137表达于活化的T细胞和NK细胞,Treg、树突细胞(Dendritic cells,DCs)、单核细胞也表达CD137,其配体CD137L主要表达于活化的APCs。刺激CD137主要诱导CD8+T细胞增殖和效应细胞因子的产生,促进NK细胞和DCs的增殖、成熟及细胞因子的产生[10]。
CD137表达于多种肿瘤细胞和肿瘤反应性T细胞及Treg表面[11]。在白血病和淋巴瘤中,肿瘤细胞上的CD137能促进肿瘤细胞的生长和生存并抑制T细胞的活化,CD137和CD137L高表达是预后的不利因素[12]。在实体瘤中,肿瘤细胞上的CD137可能与APCs表面的CD137L竞争性结合,抑制T细胞的活化,或与APCs上的CD137L结合后通过APCs促进抗肿瘤免疫反应。另外,在肿瘤患者的血清中,可溶性CD137也可能通过抑制CD137L介导的T细胞的活化促进肿瘤的免疫逃逸[12-13]。
CD137激动性抗体如Urelumab和Utomilumab,主要通过促进TME中CD8+T细胞增殖及细胞因子的分泌并诱导TME中Treg的清除发挥抗肿瘤作用[10]。Urelumab单用时具有一定的抗肿瘤活性,但肝脏毒性较强,将其剂量降低到安全范围时,抗肿瘤活性显著降低,但Urelumab联合Anti-PD1治疗转移性黑色素瘤时有较好的抗肿瘤活性和安全性。Utomilumab无剂量限制性毒性,但单用时抗肿瘤活性有限,联合Pembrolizumab治疗晚期实体瘤时,抗肿瘤效果提升,纳入的23例患者中6例患者实现CR或PR[14]。
3 OX40
OX40表达于活化的CD4+和CD8+T细胞、Treg、NK细胞及中性粒细胞,其配体OX40L表达于活化的APCs。OX40与OX40L结合后能促进T细胞和NK细胞的活化、增殖和细胞毒性,也能抑制Treg的功能[15]。
在急性髓系白血病(Acute myeloid leukemia,AML)和急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)中,肿瘤细胞上的OX40表达增加,并能促进肿瘤细胞的增殖[16-17]。实体瘤中,OX40表达于多种肿瘤细胞和TILs表面。在TILs中,OX40主要表达于Treg上。在肝细胞癌和非小细胞肺癌中,TILs上OX40的高表达和不良预后相关[18-19],但在结直肠癌和复发性卵巢癌中,高水平的OX40+TILs和OX40+肿瘤细胞与更好的预后相关[20-21]。
体外试验中,OX40激动性抗体能通过增强T细胞及NK细胞的效应功能,抑制Treg的功能或清除Treg发挥抗肿瘤作用。OX40相关抗体有Vonlerolizumab、9B12、PF-8600、MEDI0562。在接受PF-8600治疗的48例实体瘤患者中,有4%的肿瘤患者实现了PR,有52%的肿瘤患者实现了SD,在用MEDI0562治疗的55例晚期实体瘤患者时,有3.6%的肿瘤患者实现了PR,有44%肿瘤患者实现了SD,并且在应用时安全性较好,不良反应多为Ⅰ/Ⅱ级[22]。
4 CD27
CD27表达于T细胞及活化的B细胞和NK细胞。CD27配体CD70短暂表达于活化的T细胞、B细胞、NK细胞和DCs。CD27与CD70结合后能促进T细胞的增殖、存活和细胞因子的产生。CD70传导的反向信号能促进B细胞活化和免疫球蛋白的合成及NK细胞的增殖和效应功能[23]。
在AML中,肿瘤细胞上的CD27与CD70结合后能促进肿瘤细胞增殖[24]。在前B细胞前体细胞急性淋巴白血病和AML中,肿瘤细胞表达CD27是预后的不利因素[25]。在实体瘤中,CD27主要表达于TILs上,且CD27高表达和更好的预后相关,可能是TILs上高表达的CD27能增强效应T细胞和NK细胞的细胞毒性[26]。肿瘤细胞几乎不表达CD27,但表达CD70,肿瘤细胞表面的CD70与TILs表面的CD27结合后可能通过促进T细胞的凋亡、增强Treg的抑制性及向肿瘤组织中募集抑制性免疫细胞来促进肿瘤免疫逃逸[27-29]。
CD27相关抗体能通过促进TME中CD27+T细胞的活化及细胞因子的分泌和清除CD27+Treg细胞或抑制其功能发挥抗肿瘤作用[30]。CD27激动性抗体Varlilumab在治疗25例晚期实体瘤时,1例肾细胞癌患者实现了PR,肿瘤体积缩减了78%,8例实现SD,安全性较好,不良反应多为Ⅰ/Ⅱ级[31]。Varlilumab 联合Nivolumab 治疗49例晚期结直肠癌和卵巢癌患者时,有10%的肿瘤患者实现了PR,有39%的肿瘤患者实现了SD[23]。
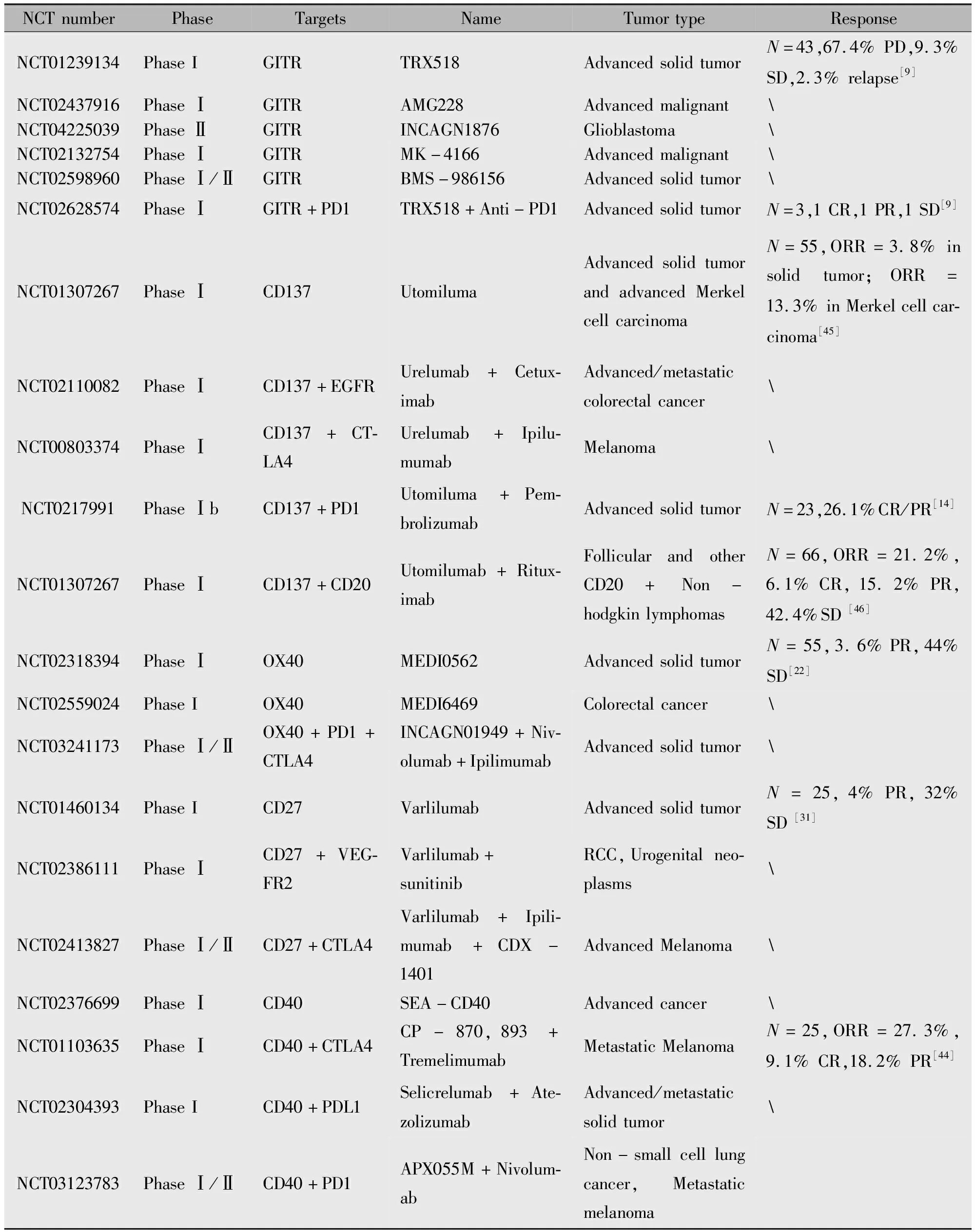
表1 共刺激受体抗体相关临床试验
5 嗜乳脂蛋白3A(Butyrophilin 3A,BTN3A)
BTN3A表达于T细胞、B细胞、NK细胞、单核细胞、DCs,BTN3A有BTN3A1、BTN3A2、BTN3A3三种亚型。BT3NA1能促进CD4+T细胞的活化、增殖以及单核细胞和DCs趋化因子和促炎细胞因子的产生,还对激活Vγ9Vδ2 T细胞起重要作用。NK细胞表面的BTN3A2能抑制NK细胞分泌细胞因子[32]。
多种肿瘤表达BTN3A,但不同肿瘤可能表达不同的BTN3A亚型。在结直肠癌、卵巢癌和乳腺癌中肿瘤细胞高表达BTN3A1[33-34]。在卵巢癌模型中,肿瘤细胞上的BTN3A1通过将N糖基化的CD45和免疫突触隔离来抑制αβT细胞的效应功能,并且卵巢癌细胞上高水平的BTN3A1与肿瘤患者更短的生存期相关[34]。在胰腺导管腺癌、胃癌和AML中,肿瘤细胞主要表达BTN3A2。BTN3A2可作为诱骗受体与磷酸抗原结合,但无B30.2结构域,因此结合后无法激活Vγ9Vδ2 T细胞,促进肿瘤免疫逃避。在一些肿瘤患者的血浆中发现的可溶性BTN3A1也能抑制Vγ9Vδ2 T细胞的活化[35-37]。
体外试验中,BTN3A相关抗体可以通过恢复αβT细胞的效应功能并促进γδT细胞的细胞毒性来杀伤肿瘤细胞[34]。抗BTN3A单抗20.1 mAb能增强Vγ9Vδ2 T细胞对胰腺癌细胞和AML原始细胞的杀伤[35,37],抗体ICT01的临床试验正在开展中(NCT04243499)。
6 CD40
CD40组成性表达于APCs,还表达于内皮细胞。其配体CD40L短暂表达于活化的CD4+T细胞,一些CD8+T细胞、γδT细胞也表达CD40L。CD40与CD40L结合后能促进DCs分泌促炎细胞因子和抗原交叉呈递并上调其共刺激分子的表达,也能促进B细胞的抗原提呈和抗体类别转换,并通过对T细胞依赖的体液免疫和DC的调节间接促进T细胞的效应功能[38]。
多种肿瘤细胞表达CD40,并且肿瘤细胞上表达的CD40与肿瘤的转移和患者的不良预后相关。肿瘤表面的CD40可能经以下途径促进肿瘤进展:(1)直接促进肿瘤细胞的生长;(2)降低活化T细胞上CD40L的表达,抑制T细胞反应,与CD40L结合后促进TGF-β的分泌和Th17细胞的分化;(3)促进IL6的分泌;(4)与内皮细胞表面的CD40L结合后上调VEGF表达,促进肿瘤组织中血管形成[39-41]。
CD40激动性抗体能促进DCs上共刺激分子的表达和促炎细胞因子的分泌,间接促进CD8+T细胞的效应功能,也能使CD40+巨噬细胞表型从促肿瘤的M2转向抑制肿瘤的M1[42]。CD40激动性抗体Selicrelumab在治疗晚期实体瘤时,有27%的黑色素瘤患者实现PR,但非黑色素瘤患者无反应[43]。其他CD40激动性单抗如CDX-1140、APX005M和SEA-CD40,在单用时抗肿瘤效果有限。Selicrelumab联合Tremelimumab在治疗22例转移性黑色素瘤时,客观缓解率(Objective response rate,ORR)为27.3%,9.1%实现CR,18.2%实现PR[44]。
7 小结与展望
共刺激受体在生理情况下能促进T细胞的活化增殖和效应功能,在肿瘤中,参与肿瘤进展及抗肿瘤免疫。体外试验和临床试验中,针对这些共刺激受体的抗体具有一定的抗肿瘤作用,并且在同其他ICI联用时能发挥协同作用,进一步提高抗肿瘤效果。因此将上述潜在靶点联合已有靶点,探索出治疗效果最佳的治疗组合将进一步改善肿瘤患者的预后。在应用这些抗体时应考虑抗体联用的时序及方式可能会对治疗效果产生的影响,并评估肿瘤患者TME的免疫表型,以预测单抗的治疗效果。
