基于PI-RADS v2.1双参数MRI联合前列腺特异性抗原密度对显著性前列腺癌的诊断效能
2021-10-27王焰峰魏超刚张跃跃杨硕檀双秀潘鹏赵文露沈钧康
王焰峰,魏超刚,张跃跃,杨硕,檀双秀,潘鹏,赵文露,沈钧康
2019年美国放射学会联合欧洲泌尿生殖放射学会发布的2.1版前列腺影像报告和数据系统(Prostate Imaging Reporting And Data System version 2.1,PI-RADS v2.1),适当的修订了部分评分标准,同时强调了双参数磁共振成像(biparametric MRI,bp-MRI)诊断前列腺癌(prostate cancer,PCa)的潜在价值[1-3]。bp-MRI相对于多参数磁共振成像(multiparametric MRI,mp-MRI)的优势已有相关文献报道[1,4,5],包括:①避免对比剂相关不良反应的发生;②缩短MRI检查时间;③降低检查成本等。但bp-MRI诊断PCa的准确性有待进一步评估,此外PI-RADS v2.1主要是基于图像特征的评估,临床医师准确诊断PCa仍需要综合考虑其它因素。
针对这一问题,有研究者基于PI-RADS v2.0,根据患者年龄、前列腺特异性抗原(prostate specific antigen,PSA)、游离前列腺特异性抗原(free prostate specific antigen,fPSA)、前列腺特异性抗原密度(prostate specific antigen density,PSAD)、前列腺体积(prostate volume,PV)等临床指标联合mp-MRIPI-RADS评分评估PCa的诊断效能[6,7],证明了临床指标联合mp-MRIPI-RADS评分能够提高对PCa,尤其是临床显著性前列腺癌(clinically significant prostate cancer,csPCa)的诊断效能,且结果有统计学意义。因此,本研究旨在评估基于PI-RADS v2.1的bp-MRI联合临床常用指标对csPCa的诊断效能。
材料与方法
研究对象:回顾性分析2018年3月-2020年4月本院515例患者病历资料。纳入标准:①PSA升高(>4 ng/mL)或者直肠指检结果疑似前列腺癌且需穿刺活检患者,患者PSA至bp-MRI检查的时间间隔为2(1~4)d;②所有入选患者获得病理诊断前3个月内接受了前列腺bp-MRI检查。排除标准:①既往行前列腺穿刺活检或药物、手术治疗的患者;②髋关节植入手术、运动伪影或者直肠大量积气等因素致磁共振图像质量下降;③PSA>100 ng/mL、fPSA>50 ng/mL,无确切数值的患者;④病理结果为其它来源肿瘤(尿路上皮癌)或Gleason评分未定;⑤临床资料及影像资料不完整。
检查方法:采用荷兰Philips 3.0T Ingenia MR扫描仪,32通道体部相控阵线圈作为接收线圈。扫描序列包括横断面、矢状面T2WI及横断面DWI(包括重建ADC图),扫描参数符合PI-RADS v2.1推荐标准(表1)。DWI(b=0、100、1000、2000 s/mm2)扫描完成后扫描仪自动选取b=100和1000 s/mm2的DWI图像后处理重建生成表观扩散系数(apparent diffusion coefficient,ADC)图。
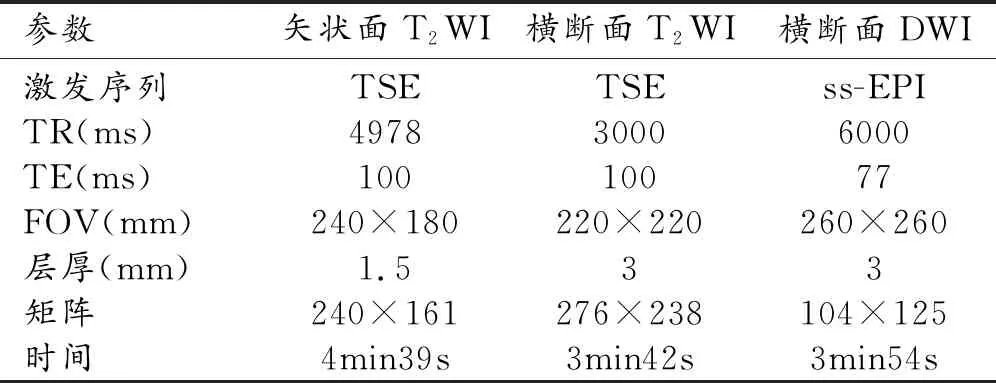
表1 前列腺MRI具体扫描序列及参数
穿刺及病理:纳入患者均经直肠超声(transrectal ultrasonography,TRUS)引导下前列腺“10+X”针系统穿刺活检[8],该方法将前列腺分为基底部、体部、尖部,以中线为界各部为左右2区,其中基底部和体部的左右2区再分为内、外侧区共10区,每区穿刺一针,穿刺医师对可疑结节加穿X针(一般2~3针),由泌尿亚专业病理医师按照2014版国际泌尿病理协会Gleason分级系统为标准记录病理结果[9]。本研究将良性病变及低危PCa(Gleason≤3+3)定义为非csPCa,Gleason≥3+4定义为csPCa。
图像分析:接受PI-RADSv2.1评分系统培训的两名影像诊断医师对纳入对象的MRI图像在病理结果未知的情况下按照PI-RADS v2.1评分标准对bp-MRI图像评分并记录,评分结果不一致者经两名医师达成一致意见后作出最终评分。评分方案:DWI为前列腺外周带评分序列,3分病灶由T2WI代替动态增强 MRI决定最终评分[10],移行带按照PI-RADS v2.1标准进行评分[3](表2)。
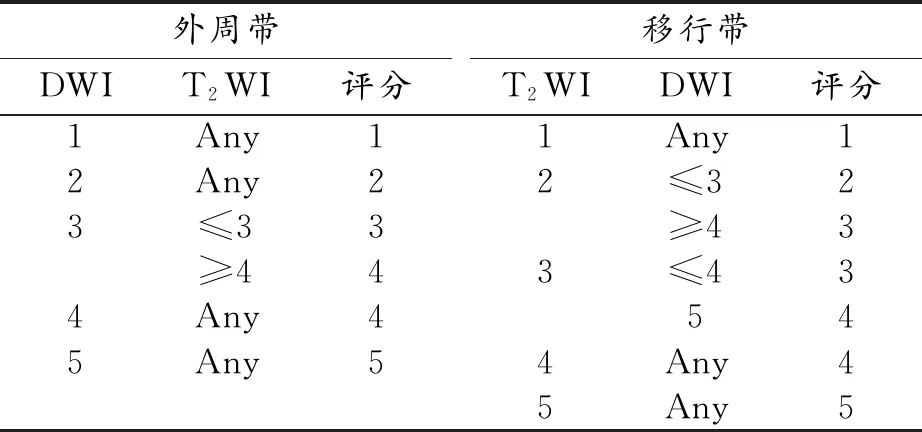
表2 改良的双参数MRI评分方案
数据搜集:搜集患者年龄、PSA、fPSA、PV和PSAD。按照PI-RADSv2.1指南,前列腺最大前后径及最大上下径在矢状面T2WI上测量,最大左右径在横断面T2WI上测量[3]。据椭圆体积公式,PV(mL)=最大前后径×最大上下径×最大左右径×0.52,PSAD(μg/L·mL)=PSA/PV[3]。据Nordström等[11]将PSAD分为7组:<0.10、0.10~0.15、0.16~0.20、0.21~0.25、0.26~0.30、0.31~0.40、>0.40μg/L·mL。
结 果
1.患者一般资料及组间比较结果
515例患者年龄47~93岁,平均70±8岁。非csPCa组399例,良性病变361例,低危癌(Gleason≤3+3分)38例;csPCa组116例,Gleason 3+4分31例,Gleason 4+3分31例,Gleason 4+4分27例,Gleason 4+5分9例,Gleason 5+4分12例,Gleason 5+5分5例。患者年龄、PSA、fPSA、PV、PSAD、PSAD亚组及PI-RADS v2.1评分在非csPCa组与csP-Ca组间差异均有统计学意义(P<0.05,表3)。
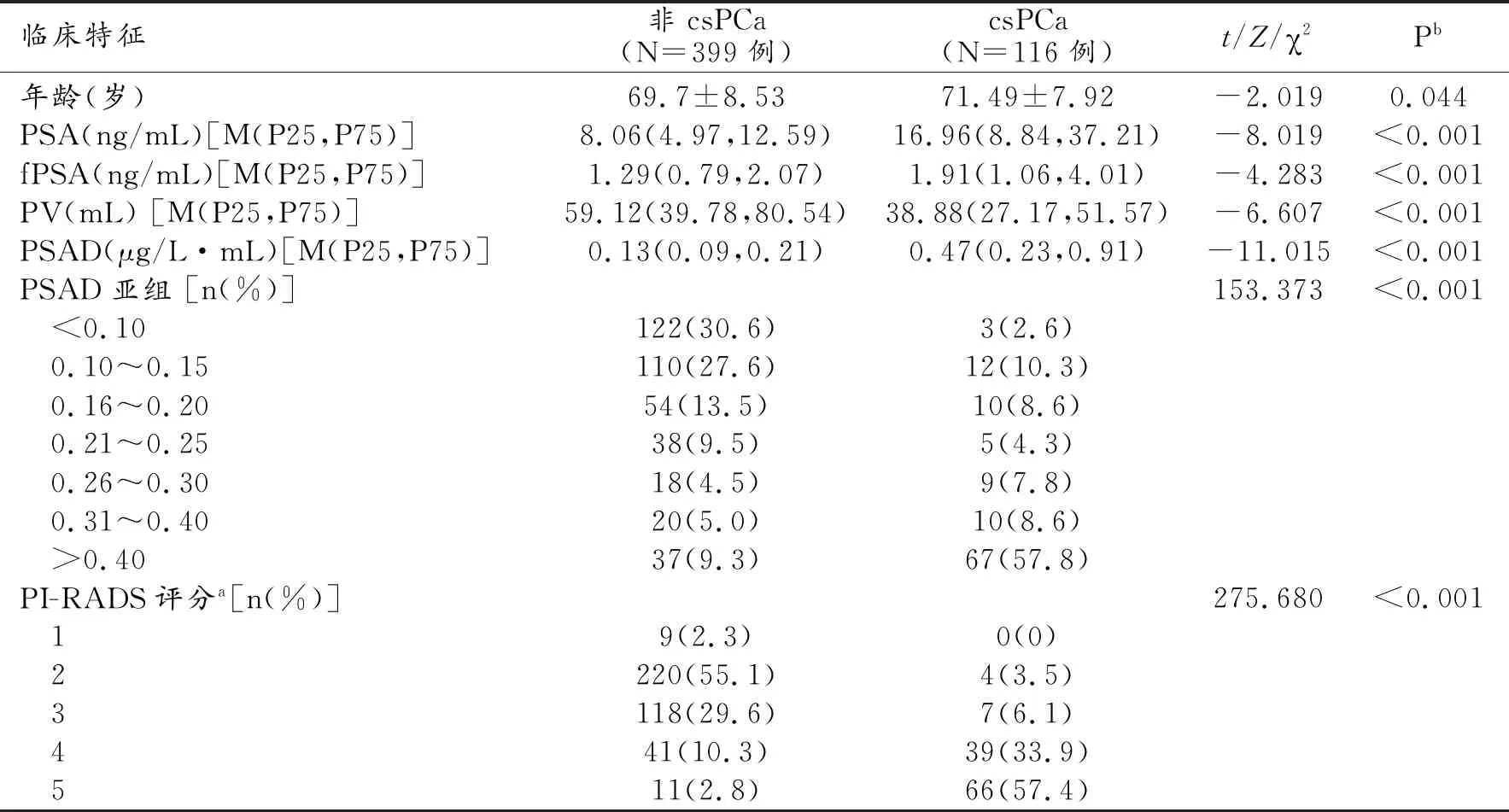
表3 患者的临床特征
2.单因素及多因素logistic回归分析
单因素logistic回归分析患者年龄、PSA、fPSA、PV、PSAD和PI-RADs v2.1评分作为csPCa的诊断因素,结果均具有统计学意义(OR=1.026,1.056,1.165、0.977、27.452、8.372,均P<0.05),多因素logistic回归分析显示PSAD(OR=5.545;95%CI=2.364,13.007)和PI-RADS v2.1评分(OR=7.015;95%CI =4.776,10.302)为csPCa独立预测因素(P<0.05)。
3.PI-RADS v2.1评分、PSAD单独及联合诊断效能评价
诊断阈值分别设置为PI-RADS v2.1评分≥3、≥4、≥5,PSAD≥0.10、≥0.15、≥0.20、≥0.25、≥0.30、≥0.40μg/L·mL,相应阈值下诊断csPCa的敏感度(Se)、特异度(Sp)、阳性预测值(PPV)、阴性预测值(NPV)及约登指数结果如表4。
如上文中所述,在专利授权确权程序中,权利人有机会对权利要求进行修改,而在专利民事侵权程序中权利人不能修改权利要求,因此,只能依靠限缩解释权利要求来体现其实质技术贡献。
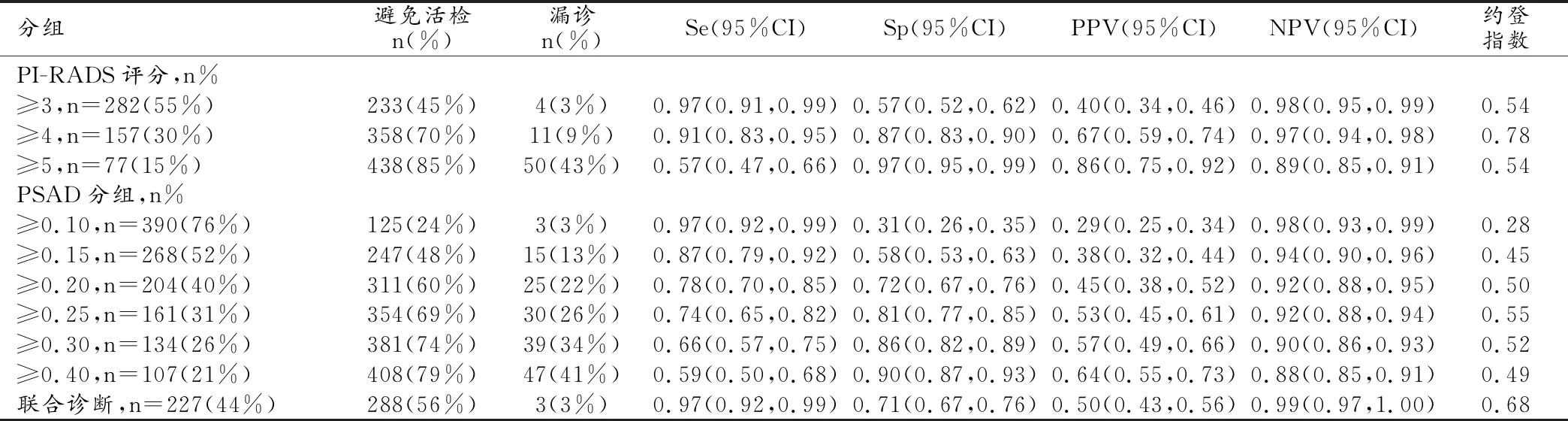
表4 PI-RADS v2.1评分和PSAD在不同阈值下诊断csPCa的灵敏度、特异度、预测值和约登指数
根据约登指数确定PI-RADS v2.1评分的最佳诊断阈值≥4,诊断csPCa的Se、Sp、PPV、NPV分别为91%、87%、67%、97%;PSAD的最佳诊断阈值≥0.25μg/L·mL,诊断csPCa的Se、Sp、PPV、NPV分别为74%、81%、53%、92%;两者联合诊断csPCa的Se、Sp、PPV、NPV分别为97%、71%、50%、99%。
PI-RADS v2.1评分、PSAD单独与联合诊断csPCa的ROC曲线(图1)及分析结果如下(表5),曲线下面积(AUC)分别为0.887、0.777、0.939,联合诊断csPCa的准确性高于PI-RADS v2.1评分和PSAD单独诊断,差异具有统计学意义(Z=2.259、5.573,P<0.05)。典型病例如图2、3。
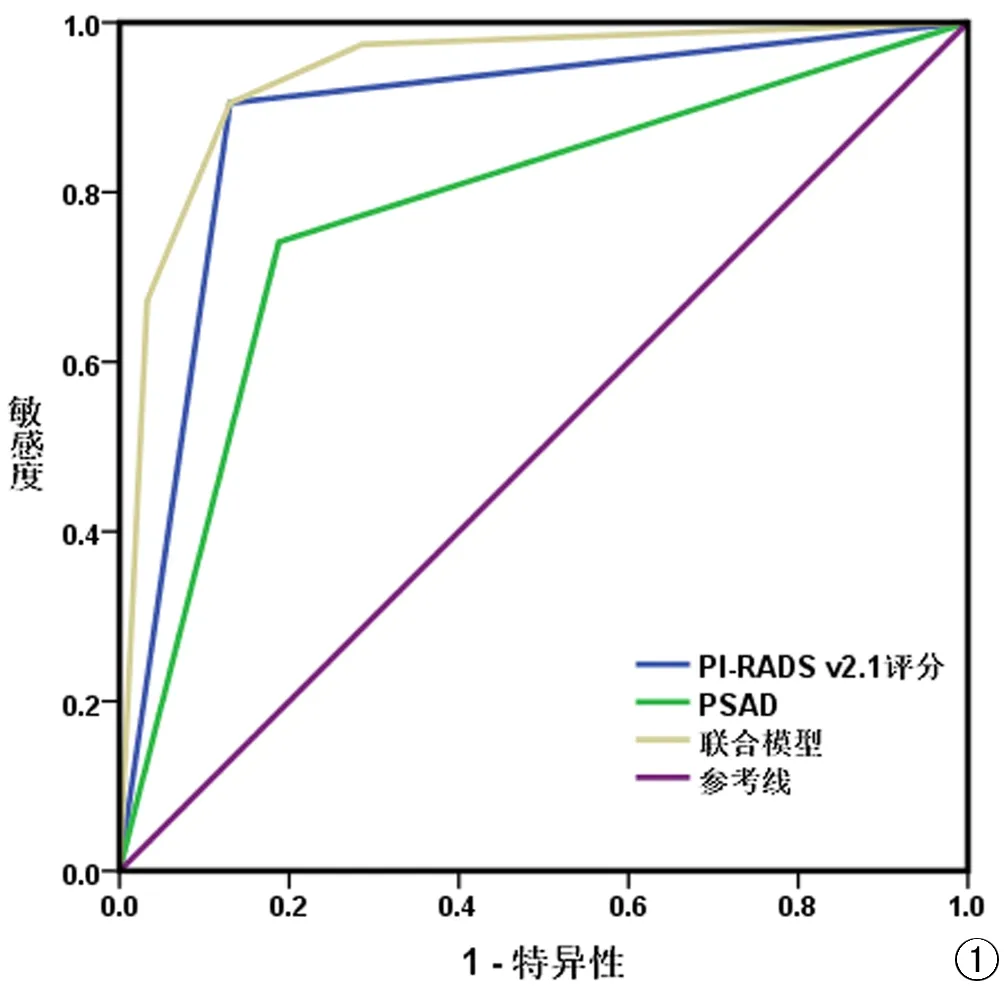
图1 bp-MRI PI-RADS v2.1评分、PSAD单独诊断与联合诊断csPCa的ROC曲线。注:PI-RADS v2.1 前列腺影像报告与数据系统2.1版;PSAD 前列腺特异性抗原密度;联合模型 PI-RADS v2.1评分+PSAD
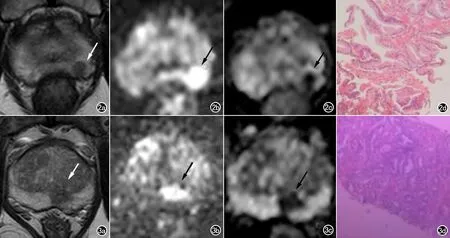
图2、3 前列腺影像报告与数据系统评分4分患者病灶磁共振图像。 图2 患者73岁,PSAD为0.21μg/L·mL,病灶位于前列腺左侧外周带,长径约为8cm,PI-RADS v2.1评分4分。a)轴面T2WI边缘模糊的不均匀低信号灶,T2WI评分为4分(箭);b、c)轴面高b值DWI,ADC:局灶性DWI高、ADC低信号灶,DWI/ADC评分为4分(箭);d)病理结果:良性前列腺组织,局部不典型小腺泡。 图3 患者71岁,PSAD为0.29μg/L·mL,病灶位于外周带体部中线旁左侧,长径约为11cm,PI-RADS v2.1评分4分。a)轴面T2WI:边缘模糊的斑片状不均匀低信号灶,T2WI评分为4分(箭);b、c)轴面高b值DWI,ADC:局灶性DWI高,ADC低信号灶,DWI/ADC评分为4分(箭);d)病理结果:前列腺癌(Gleason评分=3+4)。
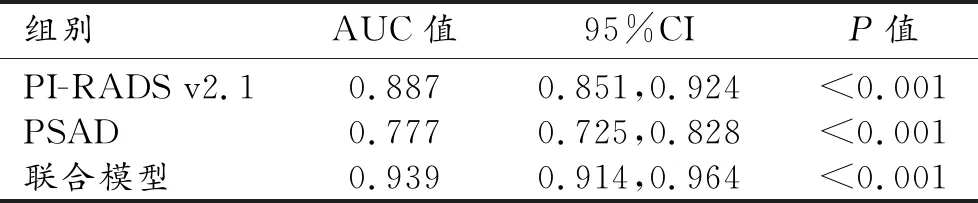
表5 csPCa的ROC曲线分析结果
讨 论
1.bp-MRI诊断csPCa的优势
PI-RADS v2.1 mp-MRI csPCa有研究表明T2WI与DWI组成的bp-MRI诊断csPCa的准确性与标准的mp-MRI相似,两者对csPCa的诊断准确性差异无统计学意义[12-14]。将mp-MRI作为诊断前列腺疾病的常规扫描方案可能给患者和医院带来更大的经济压力和资源负担[15,16]。因此使用bp-MRI诊断csPCa更简单、便捷,同时与mp-MRI相比保持了较高的诊断准确性[5,14]。本研究bp-MRIPI-RADS v2.1评分≥4时诊断csPCa的效能最佳,其Se、Sp、PPV、NPV分别为91%、87%、67%、97%。Boesen等[17]同样基于bp-MRI,当PI-RADS v2.0评分≥4时csPCa的诊断效能最大,其Se、Sp、PPV、NPV分别为84%、72%、62%、90%,与之相比本研究各项诊断指标更好,原因可能是因为PI-RADS v2.1评分标准细化了一些评分解释,表现出较好的读者间一致性[18],提高了csPCa的诊断准确性。
2.临床指标PSAD诊断csPCa的价值
虽然年龄、PSA、fPSA、PV、PSAD作为独立因素诊断csPCa均有统计学意义(OR>1,P<0.05),但是单因素与多因素诊断csPCa均以PSAD的诊断效能最优,与基于PI-RADS v2.0的相关研究结果基本一致[19-21]。其原因可能是PSAD即前列腺组织单位体积内的PSA水平,剔除了前列腺体积增大对PSA浓度的影响,更加真实的反映腺体破坏情况,与其他临床指标相比提高了对csPCa的诊断效能[22]。Vezyraki等[23]运用ROC曲线分析PSA、fPSA对csPCa的诊断效能,其AUC值分别为0.619、0.597,两者较PSAD诊断csPCa的准确性(AUC=0.790)[6]均低。年龄虽然是前列腺癌的独立危险因素,但是相关研究中仅将年龄作为一个附加因素增加某种诊断模型的诊断效能[6]。这说明年龄、PSA、fPSA评估csPCa的诊断效能相对有限,因此通过这些指标进行盲目的活检可能会导致对非PCa的过度诊疗或者对csPCa的漏诊。
本研究在PI-RADS v2.1版本指导下评估bp-MRI PI-RADS v2.1评分联合PSAD诊断csPCa的价值,发现其联合应用(AUC=0.939)比PI-RADS v2.1评分(AUC=0.887)、PSAD(AUC=0.777)单独诊断csPCa的诊断效能更高,差异具有统计学意义。基于PI-RADS v2.0版本,国内外已有研究探讨bp-MRI联合PSAD诊断csPCa的诊断效能[7,20,21],Boesen等[17]研究了bp-MRI联合PSAD在不同诊断阈值条件下检测csPCa的敏感性、特异性和预测值,其推荐诊断阈值是PI-RADS v2.0评分≥4、PSAD≥0.15 μg/L·mL,Se、Sp、PPV、NPV分别为94.0%、59.0%、56.0%、95.0%,可避免41%的患者活检,6%的患者漏诊。而本组数据基于PI-RADS v2.1,当PI-RADS v2.1评分≥4、PSAD≥0.25 μg/L·mL时,联合诊断csPCa Se、Sp、PPV、NPV分别为97%、71%、50%、99%,可避免56%(288/515)的患者活检,3%(3/116)的患者漏诊,在有效避免非csPCa过度穿刺的同时提高了csPCa的检出率。本研究bp-MRI联合PSAD检测csPCa的诊断阈值与Boesen等[17]研究结果稍有不同,分析其原因。第一,本研究遵循的是最新的指导原则(PI-RADS v2.1)。第二,前列腺体积最大前后径及最大上下径在矢状面T2WI上测量,最大左右径在横断面T2WI上测量,这可能导致前列腺体积测量较PI-RADS v2.0指南下测量的值稍不同,其诊断阈值也随之改变。
本研究存在一些不足。首先本研究为单中心回顾性研究,在资料搜集过程中存在一定的选择偏倚,同时所得到的联合诊断效能没有进行外部验证。今后,可通过多中心前瞻性研究进一步验证本研究结果。其次,TRUS系统穿刺确诊PCa仍然存在假阴性结果,本研究以此作为csPCa诊断的金标准会有一定的信息偏倚,今后用MRI-TRUS融合靶向穿刺或前列腺根治术后病理会更为准确。
综上所述,基于PI-RADS v2.1的bp-MRI联合PSAD对csPCa的诊断有一定价值,当PI-RADS v2.1评分≥4、PSAD≥0.25 μg/L·mL时bp-MRI联合PSAD诊断csPCa的效能明显优于两者单独应用,通过对疑似csPCa患者个体风险的评估可协助临床医师对患者进行更准确诊断并制定下一步诊疗计划。