大鼠溃疡性结肠炎模型的建立*
2021-10-26马秀兰王秀萍王佳林王艺臻朱西杰
马秀兰,王秀萍,王佳林,王艺臻,朱西杰,2
1 宁夏医科大学中医学院 宁夏银川 750004
2 宁夏医科大学附属回医中医院 宁夏银川 750004
溃疡性结肠炎(UC)为结肠癌前病变和临床难治病,是一种主要累及直肠、结肠黏膜和黏膜下层的慢性非特异性炎症[1],属于炎症性肠病(IBD)范畴,临床主要表现为腹痛、腹泻、黏液脓血便[2]。UC的病因及发病机制尚未明确,而溃疡性结肠炎动物模型是研究溃疡性结肠炎发生机制和评价相关药物效果的必不可少的工具,故对UC模型制备方法的研究具有重要的意义。近些年,随着研究的深入,关于UC模型的制备,有药物法、免疫法、中药法等,但TNBS诱导的UC模型是公认的,有着造模成功率高,造模周期短的优点[3]。本课题组在前期研究中,积累了一定经验。因此,TNBS可作为溃疡性结肠炎模型的制备诱导剂。本研究对TNBS的造模方法进一步探讨,验证了其造模时间短、阳性率高、操作简便。
TNBS模型能够很好地模拟溃疡性结肠炎的慢性复发过程,症状和组织学改变与人类UC相似,其模型呈慢性炎症变化,病程长,稳定性好[17]。研究发现,实验的最佳造模剂量为100~150mg/kg[18],一次性直肠给药即可,发生的炎症可维持7~8周,急慢性期分界约在3周,可明确的控制。TNBS引起IL-12介导的Th1细胞免疫性反应,且TNF-α、IFN-γ含量增高[19]。该模型制备过程中,简单易行、重复性好、造模时间短,并且经济实用,适合于对防治药物的筛选和研究,符合本实验后期的研究[20]。
材料与方法
1 实验材料
1.1 实验动物 SPF级Sprague-Dawley(SD)大鼠120只,雄性,体质量150~220g,由宁夏医科大学实验动物中心提供,饲养于宁夏医科大学实验动物中心屏障,许可证号SCXK(宁)2020-0001。
1.2 实验试剂 ①10%水合氯醛;②2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene sulfonicacid,TNBS);③无水乙醇;④4%多聚甲醛,购买自上海尚宝生物科技有限公司;⑥尿粪便隐血定性检测试剂盒(购买自信帆生物技术有限公司)等。
2 实验方法
2.1 试剂配置 50%乙醇:用蒸馏水稀释无水乙醇至50%,4℃保存;TNBS-50%乙醇混合溶液:将5%TNBS溶液与50%乙醇溶液等按2:1体积混合,4℃保存待用。
2.2 模型制备 采用TNBS灌肠法制备溃疡性结肠炎大鼠模型,大鼠造模前禁食不禁水36h。随机留取8只动物作为空白对照组,其余大鼠10%水合氯醛(0.4mL/100g)腹腔注射麻醉后,使用硅胶管蘸取30%甘油润滑,轻插入肛门约8cm,150mg/kg(0.45mL/100g)注入 5%TNBS+50% 乙醇[21](2: 1体积)混合液,然后捏紧肛门提尾倒放3min后,放回笼中,采用头低脚高位30~60°,充分保暖,自然苏醒,常规饲养[22-23]。
结 果
1 疾病活动指数(DAI)评分
造模后观察大鼠每日腹泻、血便及体重情况,记录大鼠的一般情况[24]。日常观察:精神萎靡,懒于活动,大鼠饮食饮水量明显减少,体重明显下降,消瘦,出现身体蜷缩,毛发竖立,行动迟缓(见图1);大便稀溏,肛周污秽(见图2);大便次数明显增多,软便或稀便(见图3);大便末端有黏液或脓点,便血(见图4)等表现。DAI评分:造模3d后,综合大鼠体重下降百分率(体重不变为 0;1~ 5为 1分;6~ 10为 2分;11~15为3分;大于15为4分),粪便性状(正常为0;半稀便为1分;稀便为3分)和便血(隐血阴性为0分;隐血阳性为1分;肉眼血便3分)进行评分。DAI[25]=(体重下降分数+粪便性状分数+隐血分数)/3,体重下降5%计分为1分。DAI综合评分介于0~4分,0分代表正常,4分代表炎症最大活动度。

图1
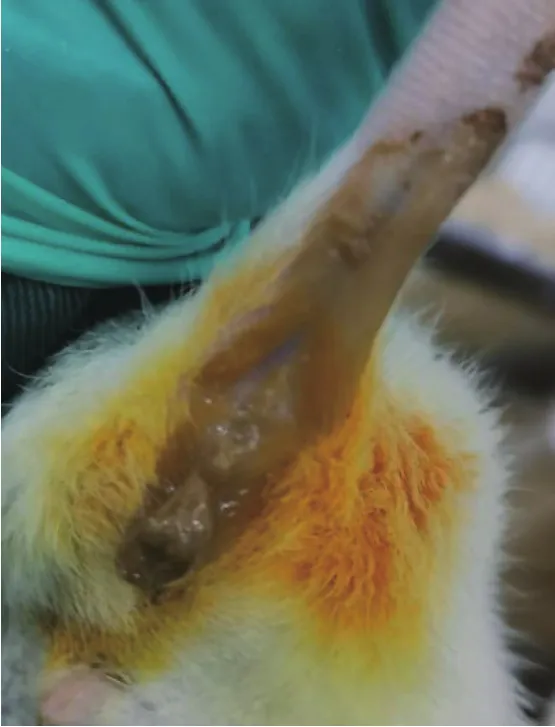
图2

图3
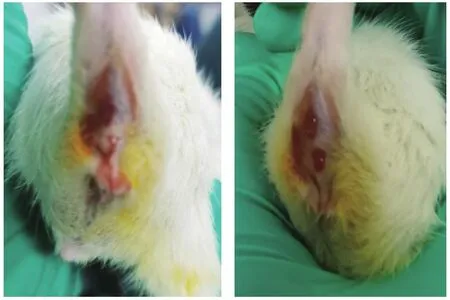
图4
造模3d后,杀检验证造模成功后,随机抽取10只模型大鼠,进行DAI的计算,造模效果显著,为后续试验的开展奠定基础。见表1。
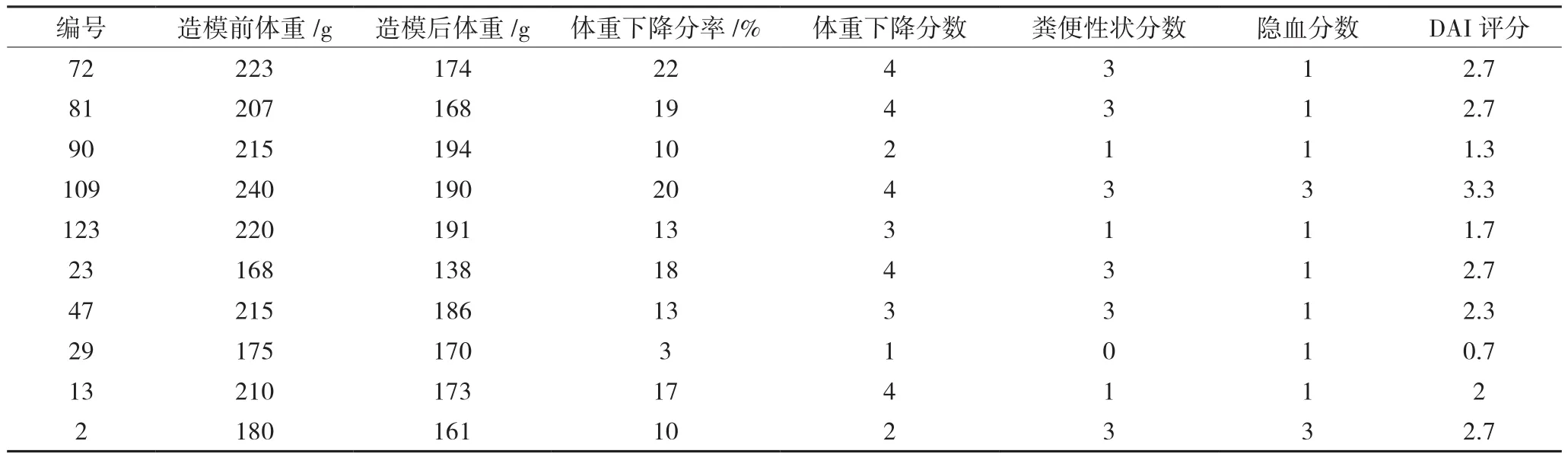
表1 造模后随机大鼠DAI分数分析
2 黏膜组织学评分
观察结肠黏膜组织的病理学变化,并对炎症损伤进行大体形态评分。取距肛门8cm的结肠组织(见图5),沿纵轴切开,冷生理盐水洗净,称重计算结肠指数;平铺固定,观察大体形态,用1mm2的网格纸测量出溃疡面积,计算溃疡指数。评分标准[25]:黏膜无损伤,0分;局部充血水肿但没有糜烂,溃疡形成,1分;有线性溃疡形成但没有明显炎症,2分;有溃疡,且仅有一处出现炎症,3分;沿结肠长轴两个或以上部位有溃疡形成和炎症,但溃疡﹤1cm,4分;有多处溃疡和严症,且溃疡和炎症沿结肠纵轴超过1cm,5分。
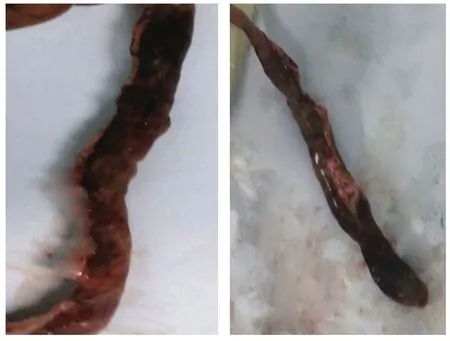
图5 结肠黏膜肉眼可见溃疡、血痂
3 组织形态学观察
取病变最明显结肠段长度约1cm,4%多聚甲醛溶液固定,梯度酒精脱水,石蜡包埋,切片,HE染色。肉眼可见病变结肠水肿,肠壁增厚,肠道黏膜有大小不定的溃疡面。镜下可见结肠黏膜糜烂、溃疡、隐窝脓肿、杯状细胞消失,固有层中性粒细胞、淋巴细胞浸润,坏死灶周边上皮充血,间质层有嗜中性、嗜酸性粒细胞和炎细胞浸润,黏膜下层结缔组织增生,有大量炎细胞浸润,以中性粒细胞为主[26-27]。见图6。
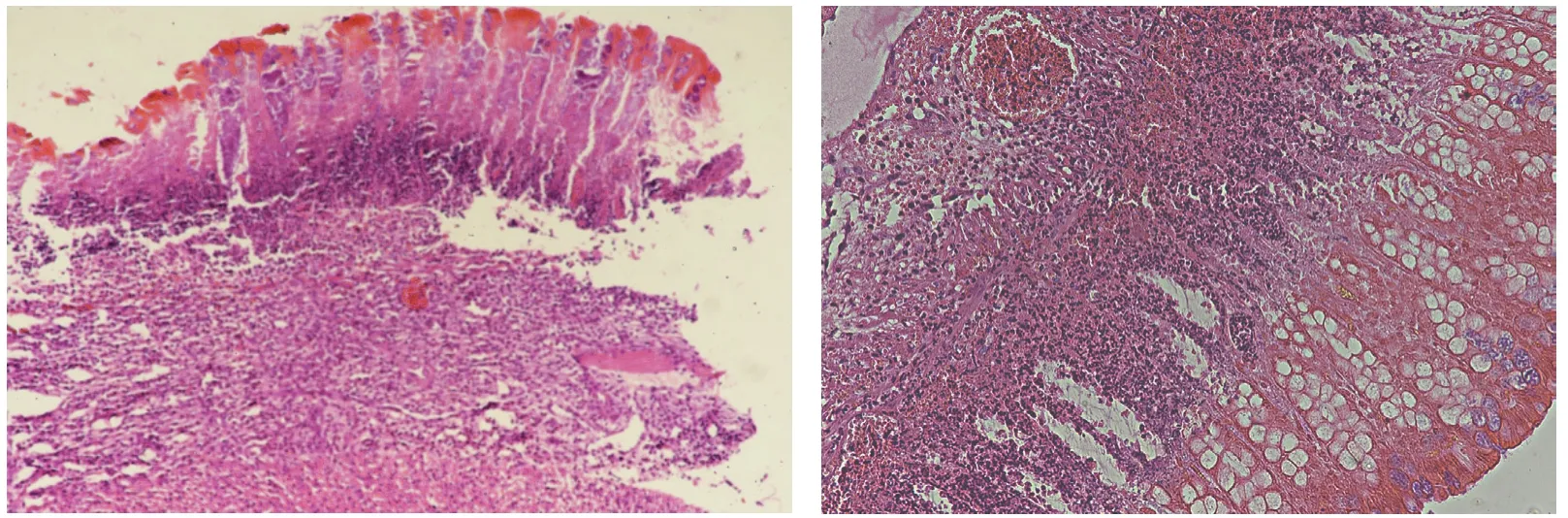
图6 结肠切片
4 邻联甲苯胺法检测大便潜血
血红蛋白具有过氧化物酶样作用,以催化H2O2作为电子受体使色原邻联甲苯胺氧化呈邻偶氮苯甲而显蓝色,其颜色深浅与血红蛋白含量成正比,又称粪便隐血实验。用竹签挑取少量粪便,放入24孔板中。然后依次滴加O-tolidine solution2~3滴。混勻后再加入2~3滴配置好的氧化剂,混勻后,立即观察颜色变化。2min内有蓝色出现,提示粪便含有血红蛋白(Hb)或粪便隐血实验阳性。阴性:2min内不显色;阳性(+):10s后浅蓝色渐变为蓝色;阳性(2+):加入试剂后初显浅蓝色,逐渐呈明显蓝褐色;阳性(3+):加入试剂后立即呈现蓝褐色;阳性(4+):加入试剂后立即呈现蓝黑褐色。见图7。

图7 (左边为10s显色,右边为2min显色)
讨 论
迄今,已经提出了多种溃疡性结肠炎动物模型的制备方法,但广泛使用的是TNBS诱导的UC模型。该造模方法使用TNBS和50%乙醇混合液,利用50%乙醇损坏肠道黏膜屏障,使蛋白裸露,TNBS直接作用于肠黏膜,导致炎症的发生[28]。本实验发现,3d左右大鼠均有UC症状出现,或精神萎靡,或稀便,或黏液血便,或体重明显下降,或均可见;病检可见:结肠黏膜糜烂、溃疡、隐窝脓肿,大量炎细胞浸润等。该造模方法具有时间短、动物耐受性好的优点,且该法采用灌肠,药物直接作用于肠道,造模成功率高,易操作,易于推广[29]。在模型制备过程中,可通过粪便形态和大鼠体重的监测,明确肠道炎症的轻重和病情的变化。通过对近年来国内外关于溃疡性结肠炎模型动物的选择(如年龄、体重)、造模方法进行归纳总结及比较,自身采用TNBS法,成功制备溃疡性结肠炎模型,旨在为溃疡性结肠炎发病机制研究及新药开发提供有益参考。
1 溃疡性结肠炎模型制备
1.1 三硝基苯磺酸(TNBS)模型 TNBS是一种有机酸半抗原,和乙醇配比成混合物,利用乙醇损害屏障功能,使得TNBS向肠壁渗透,使得裸露的蛋白与TNBS结合形成自身抗原,造成机体以Th反应为主的免疫反应,形成以肠壁溃疡、增厚、狭窄、肉芽肿为特征的节段分布的透壁性炎症,结肠上皮黏膜出现慢性期淋巴细胞或巨噬细胞浸润[4]。
1.2 恶唑酮(OXZ)模型[5-6]恶唑酮多采取直肠给药,可引起严重的结肠炎。恶唑酮制备的小鼠结肠炎病变位于远端结肠,主要作用于黏膜和黏膜下层,主要表现为:大便次数增多、稀便、便上有黏液或脓点,肛周有粪便粘连等,或可见黏液血便,腹腔内可见大量腹水,结直肠水肿扩张、肠壁颜色变暗,变薄,形成伪膜,肠道黏膜充血水肿、糜烂和浅溃疡形成;黏膜下水肿、杯状细胞和腺体减少,固有层有弥漫性中性粒细胞、淋巴细胞浸润,黏膜下淋巴细胞增生[7]。
1.3 葡聚糖硫酸钠(DSS)模型[8]DSS是一种水溶性硫酸多糖体,可损伤肠上皮,致使固有层和黏膜下层直接与肠道细菌和抗原接触,从而引发炎症;DSS可直破坏肠道屏障完整性,改变结肠黏液层菌群变化,致使肠内细菌损伤上皮细胞,使结肠紧密连接蛋白和紧密连接相关蛋白occludin、Zo-1表达下降、结肠黏膜屏障紧密性降低和肠道菌群失调,从而导致急性结肠炎的发生[9]。模型表现为:体重减轻,直肠出血、血性腹泻、溃疡、粒细胞浸润、上皮细胞丧失和嗜中性粒细胞浸润[10]。优点:DSS采用直接饮用的方式,故剂量及时间易控,可制备急、慢性结肠炎便于研究;缺点:建模周期长,费用高、耗时长,模型动物致死率高。其UC模型制备操作简单,但DSS液浓度的把控是模型成功与否的关键,研究中多用的是体积为3%或者4%的DSS液,最适浓度还待研究[11-12]。
1.4 2,4-二硝基氯苯和醋酸复合法[13]DNCB是一个半抗原,与组织蛋白结合可激发T淋巴细胞依赖的免疫反应,诱发大鼠发生变态反应,该混合溶液灌肠破坏结肠黏膜屏障,产生炎症,建立大鼠UC模型[14]。该方法优点如下:病理学变化符合UC特征,可根据模型鼠的表现,按照时间分为溃疡期:8周内均可见结肠黏膜充血水肿,明显的溃疡形成及全层性炎症细胞浸润和隐窝脓肿形成;溃疡愈合期:6周后黏膜充血水肿减轻,中性粒细胞浸润消失,以淋巴细胞为主[15]。此方法UC模型可维持16周以上,克服了单纯DNCB法病程短、自愈性强的弱点,为观察药物疗效提供了有利的条件。此方法易复制,操作简单,模型动物的存活率较高,但易自愈[16]。
2 麻醉药物的影响
水合氯醛是无色透明的白色结晶,味微苦,有特殊臭味,易潮解,在空气中徐徐挥发,易溶于水、醇、氯仿和乙醚。不耐高热,宜密封避光保存于阴凉处。本品对呼吸有一定抑制作用,大剂量则抑制延髓的呼吸中枢和血管运动中枢,出现呼吸抑制,血压下降。故本品的保存和使用都需要特别注意。①临用前现配制,不可久存,防止分解,剩余的药液应弃用。②静脉注射时,绝不可将药液漏出血管之外的周围组织;配用浓度:用生理盐水配制时不超过10%,醇溶液不超过5%。浓度过高时,会发生溶血作用。③水合氯醛的剂量控制不佳,或注射部位过深,损伤肠道,均可能引起肠梗阻的发生;水合氯醛麻醉后,动物容易腹胀而死,考虑为浓度过高引起,给药原则是一次性给齐,切记多次给药,否则腹胀发生率明显增高。④本品深麻醉剂量和致死剂量接近,故实验前,应至少禁食24h,保证动物体重处于一个稳定水平,根据造模当天的体重精确计算麻醉剂量。⑤水合氯醛能降低新陈代谢,抑制体温中枢,故在深麻醉时,可显著降低体温,因此麻醉时及麻醉后都要注意保暖,给予动物毛巾盖被或置于厚而柔软的毛巾上,进行操作,尤其冬天。
3 实验改进
3.1 麻醉药物使用 实验过程中广泛使用的麻醉药物水合氯醛[30],存在药物的浓度和剂量较难控制,对动物的刺激性大,动物死亡率高的缺点,为避免此缺点,实验操作过程中,严格掌握药物剂量,按照禁食后造模当天大鼠体重进行计算,现配现用,腹腔注射时,与助手相互配合,采取倒置姿势,防止针尖伤及腹腔脏器,严格按照腹腔注射方法开展。
3.2 灌肠操作 TNBS灌肠传统器材为硅胶管,灌肠过程中,灌肠液容易溢出,且灌液后拔出时,易带出液体,影响造模效果及模型的稳定性;操作过程中,选用较硬的塑料管,用石蜡油润滑,便于插入肠道,灌液后,提尾倒置3min,并采取头低脚高位,使药液充分留在肠道内,使得模型稳定性高。
3.3 动物和造模药物选择 大鼠寿命约2.5~3年,正常饲养大鼠,6~8周龄,体重达180~220g,10周龄后体重达400g趋于稳定,选用体质量180~220g的SD大鼠,该时期肠道对TNBS的敏感性较强,灌肠后,3d即可出现典型的溃疡性结肠炎症状,节省造模时间,对于TNBS的灌肠浓度也进行改进,予以5%TNBS+50%乙醇(2:1体积混合)混合液灌肠1次即可,造模效率高,症状典型,造模时间短[31]。
3.4 造模时间 小鼠禁食24h后仍可能有粪便堆积于结肠处,将禁食时间延长至36h,则结肠处粪便排空比较完全,造模时,大鼠粪便明显较少,药液流出减少。
动物模型的成功制备,是后续实验开展的基础。TNBS制备的溃疡性结肠炎模型,能客观的反映人体临床UC病症,但同时存在许多的不足,如模型表现单一,模型自愈能力较强等。如何解决模型的维持问题,是动物实验及后续实验开展的重中之重,也是广大学者的研究热点。根据自己的实验操作,进行简要介绍,以期对同类研究有借鉴作用。
