川芎嗪对人骨关节炎软骨细胞的影响及作用机制研究
2021-10-26王会含王永堂苗建华李凤新
王会含,王永堂,苗建华,李凤新
(郑州大学附属郑州中心医院,河南 郑州 450007)
骨关节炎(osteoarthritis,OA)多发于老年人,临床主要病理表现为关节软骨退变和关节边缘骨质增生[1-2]。随着人们预期寿命的延长,OA的发病率逐年上升,而其发病机制目前尚未明确。研究发现,软骨细胞凋亡在OA的发生过程中起重要作用,阻止或减缓软骨细胞凋亡是防治OA的关键[3-4]。近年来,临床多采用以活血和补肝益肾为主的中药防治OA,川芎是常用药物之一[5-6]。川芎嗪是从川芎中分离的一种生物碱,朱海泉等[7]研究表明其能够有效预防OA。为了探索川芎嗪对OA软骨细胞凋亡的影响及其作用机制,我们开展了相关的实验研究,现总结报告如下。
1 材料与仪器
1.1 实验材料膝关节软骨组织来自在郑州大学附属郑州中心医院接受膝关节置换的患者。试验方案经医院医学伦理委员会审查通过。
1.2 实验试剂Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)购自武汉益普生物科技有限公司,Ⅱ型胶原酶、多聚甲醛溶液、二甲亚砜(美国Sigma公司),DMEM培养基(美国HyClone公司),10%的胎牛血清、苯基甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF)购自北京孚博生物科技有限公司,甲苯胺蓝(北京索莱宝科技有限公司),鼠抗人Ⅱ型胶原蛋白一抗(美国Santa Cruz公司),生物素标记的山羊抗兔免疫球蛋白(immunoglobulin,Ig)G二抗(美国Biotium公司),肿瘤坏死因子(tumor necrosis factor,TNF)-α(福州迈新生物技术开发有限公司),川芎嗪(纯度≥98%,成都德思特生物技术有限公司),异硫氰酸荧光素标记的膜联蛋白V(annexin V-fluorescein isothiocyanate,Annexin V-FIIC)/碘化丙啶(propidium iodide,PI)双染色试剂盒、Promega逆转录试剂盒(江苏凯基生物技术股份有限公司),MTT分析试剂盒(美国Thermo公司),SYBR Premix Ex Taq Ⅱ染料法荧光定量试剂盒(日本Takara公司),扩增引物由生工生物工程(上海)股份有限公司合成,放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液(北京百奥莱博科技有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量分析试剂盒(上海碧云天生物科技有限公司),兔抗人硫氧还蛋白(thioredoxin,Trx)-2、凋亡信号调节激酶(apoptosis signal regulating kinase,ASK)-1、半胱氨酸天冬氨酸蛋白酶(cysteine aspartic acid specific protease,Caspase)-3、β-肌动蛋白(β-actin)一抗及辣根过氧化物酶标记的山羊抗兔IgG二抗、电化学发光(electrogenerated chemiluminescence,ECL)试剂盒(美国Abcam公司)。
1.3 实验仪器TD-4M台式低速离心机(山东博科生物产业有限公司),恒温培养箱(上海喆图科学仪器有限公司),AE31 EF-INV型荧光显微镜(上海光学仪器厂),DG5031酶联免疫监测仪(南京华东电子集团医疗装备有限责任公司),Amnis流式细胞分析仪(美国BD公司),ABI7900实时荧光定量PCR仪(美国ABI公司),E-Gel Imager凝胶成像仪(美国Invitrogen公司)。
2 方 法
2.1 软骨细胞分离和培养方法将一定量的软骨组织,使用HBSS冲洗干净,剪碎后移入直径10 cm的培养皿中,加入10 mL含0.2%Ⅱ型胶原酶的DMEM培养基,于CO2浓度5%、温度37 ℃的恒温培养箱中。消化4~6 h后,将含有软骨组织块的液体移入15 mL离心管,以1200 r·min-1(离心半径8 cm)离心5 min。弃上清,加入含10%胎牛血清的DMEM培养基。混匀后,接种于25 cm2贴壁式细胞培养瓶,将培养瓶置于CO2浓度5%、温度37 ℃的恒温培养箱中培养,每48 h更换1次培养基,待约90%细胞贴壁时进行传代。按照1∶2的比例进行传代,每隔3 d传代1次。于显微镜下观察原代细胞及第3代细胞形态。
2.2 软骨细胞鉴定方法取生长良好的第3代软骨细胞,接种于预先放置爬片的6孔板上,每孔加入2 mL含10%胎牛血清的DMEM培养基。待约70%细胞贴壁时,取出细胞爬片,用PBS洗涤3次,加入 1 mL 浓度为40 g·L-1的多聚甲醛溶液,置于4 ℃冰箱过夜固定。取出爬片,分别进行甲苯胺蓝染色和免疫组化染色,免疫组化染色一抗为鼠抗人Ⅱ型胶原蛋白抗体,使用比例为1∶100,二抗为生物素标记的山羊抗兔IgG,使用比例为1∶1000。染色后分别于显微镜下观察并拍照。
2.3 OA软骨细胞模型建立与川芎嗪干预方法取生长良好的第3代软骨细胞,采用细胞计数法测定细胞浓度,调整细胞浓度为1×106个·mL-1。将软骨细胞分别接种至4块6孔板中,每块板接种5个复孔,每个复孔接种1 mL。每孔加入1 mL浓度为100 ng·mL-1的TNF-α,于CO2浓度5%、温度 37 ℃的恒温培养箱中培养24 h以建立OA软骨细胞模型[8]。培养结束后,将4块6孔板随机分为对照组和川芎嗪低、中、高浓度组。用吸管小心弃去培养基,对照组加入1 mL正常的DMEM培养基,川芎嗪低、中、高浓度组分别加入1 mL含川芎嗪浓度为25 μg·mL-1、50 μg·mL-1、100 μg·mL-1的DMEM培养基,于CO2浓度5%、温度37 ℃的恒温培养箱中继续培养24 h。
2.4 软骨细胞凋亡率测定方法按照2.3的方法进行OA软骨细胞模型建立与川芎嗪干预,取干预后的软骨细胞悬液,采用细胞计数法测定细胞浓度,调整细胞密度为1×106个·mL-1。取100 μL细胞悬液加入流式管中,再加入5 μL Annexin V-FIIC溶液、5 μL PI溶液及0.5 mL上样缓冲液,混匀后避光放置15 min,采用流式细胞仪测定软骨细胞凋亡率。
2.5 软骨细胞活力测定方法按照2.3的方法进行OA软骨细胞模型建立与川芎嗪干预,干预结束后,在每孔中加入浓度为5 mg·mL-1的MTT溶液20 μL,继续培养4 h,用吸管小心弃去培养基,每孔加150 μL二甲亚砜,振荡至结晶物完全溶解。采用DG5031酶联免疫监测仪测定各孔吸光度,测定波长490 nm。
2.6 软骨细胞凋亡相关基因mRNA表达分析方法按照2.3的方法进行OA软骨细胞模型建立与川芎嗪干预,采用Trizol法提取干预后软骨细胞的总RNA,参照Promega逆转录试剂盒说明书逆转录获得cDNA模板。采用SYBR Premix Ex Taq Ⅱ染料法荧光定量试剂盒进行实时定量PCR扩增,Trx-2、ASK-1、Caspase-3及β-actin基因扩增引物序列见表1,反应体系参照试剂盒说明书,PCR扩增程序:95 ℃预变性5 min;94 ℃变性35 s,55 ℃退火40 s,72 ℃延伸35 s,35个循环;72 ℃延伸5 min。以β-actin为内参基因,采用2-ΔΔCT法计算Trx-2、ASK-1及Caspase-3 mRNA的相对表达量。

表1 实时定量PCR引物序列
2.7 软骨细胞凋亡相关基因的蛋白表达分析方法按照2.3的方法进行OA软骨细胞模型建立与川芎嗪干预,将干预后各组软骨细胞以无菌PBS清洗2次;加入适量的含PMSF(浓度为1 mmol·L-1)的RIPA裂解液后,转移至预冷的EP管中,于冰上裂解20 min;于4 ℃下以12000 r·min-1(离心半径10 cm)离心10 min,取上清。采用BCA蛋白定量分析试剂盒测定上清蛋白浓度,调整样品蛋白浓度使蛋白上样量一致,采用十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳。电泳结束后,将凝胶上的蛋白转至聚偏二氟乙烯膜,采用蛋白印迹法检测Trx-2、ASK-1、Caspase-3及β-actin的蛋白表达量,加入兔抗人Trx-2、ASK-1、Caspase-3一抗(1∶1000)和β-actin一抗(1∶800),于4 ℃过夜孵育;洗膜后,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶3000)。采用ECL试剂盒显色,于E-Gel Imager凝胶成像仪中显影并拍摄照片。采用Image J图像处理软件处理图片,提取蛋白条带的灰度值,分别以β-actin为参照,计算蛋白条带的相对灰度值,分析蛋白表达水平。
2.8 数据统计方法采用SPSS24.0统计学软件处理数据。4组软骨细胞凋亡率、活力吸光度值及 Trx-2、ASK-1、Caspase-3的mRNA和蛋白相对表达量的组间比较均采用单因素方差分析,组间两两比较均采用LSD-t检验。检验水准α=0.05。
3 结 果
3.1 软骨细胞培养结果原代细胞培养至第15天,可见组织块周围有细胞成簇生长,显微镜下观察细胞形态显示细胞呈梭形、三角形或多角形[图1(1)];显微镜下观察第3代软骨细胞形态显示,细胞多呈长梭形[图1(2)]。
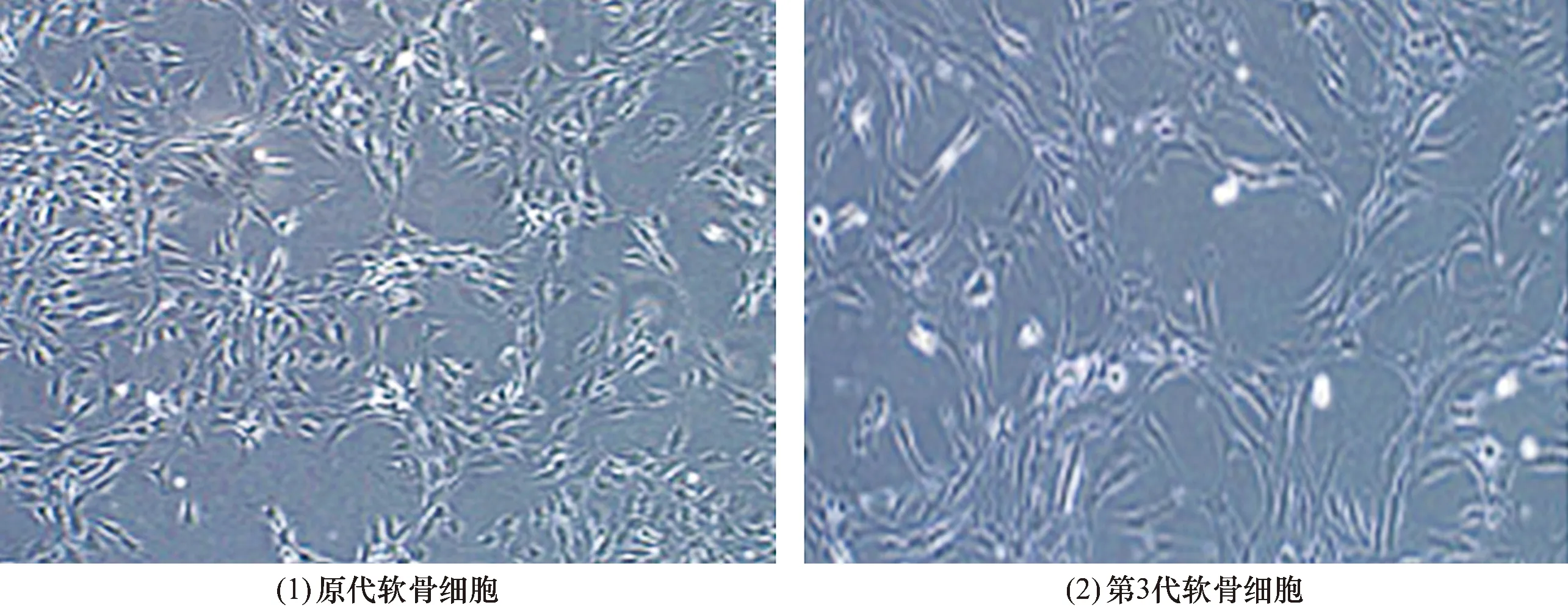
图1 软骨细胞形态观察结果(×100)
3.2 软骨细胞鉴定结果甲苯胺蓝染色显示,细胞呈长梭形,有1~3个细胞核,细胞质呈蓝色[图2(1)];免疫组化染色显示,细胞Ⅱ型胶原蛋白呈阳性,细胞质内可见黄色颗粒,细胞核无着色[图2(2)],表明为软骨细胞。
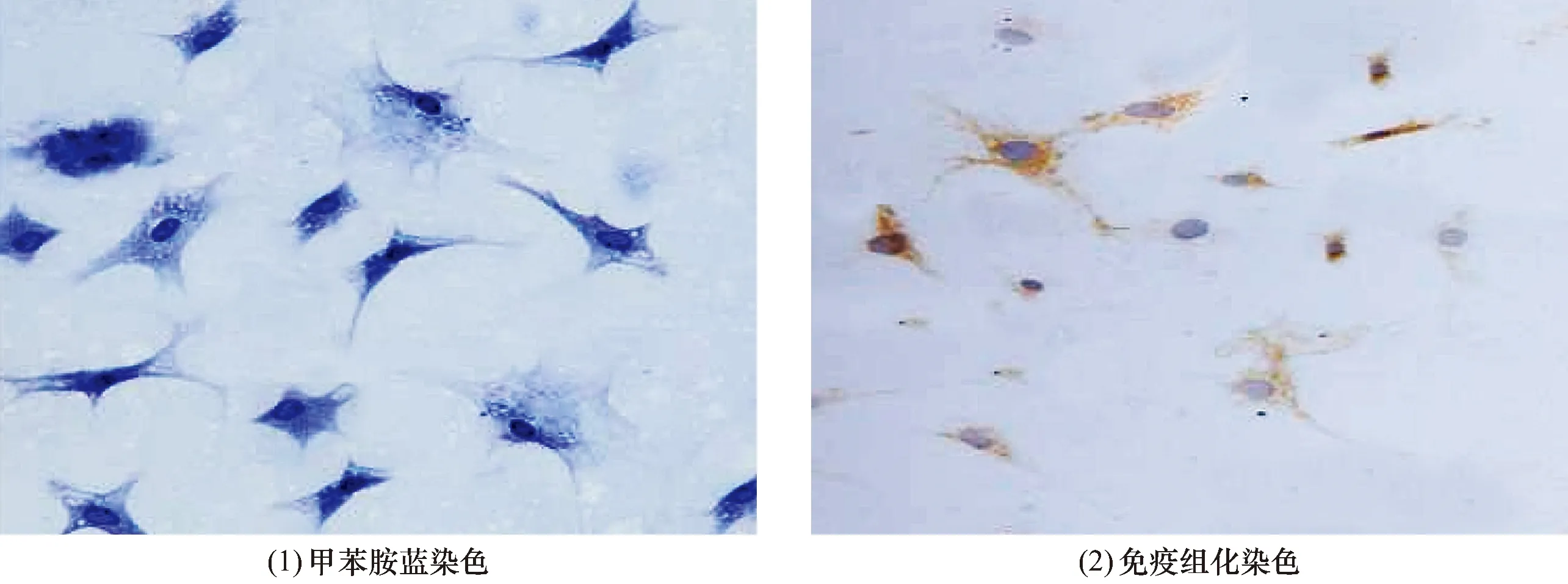
图2 第3代软骨细胞鉴定结果(×200)
3.3 软骨细胞凋亡率测定结果4组软骨细胞凋亡率比较,差异有统计学意义[(25.10±0.47)%,(22.08±0.25)%,(19.37±0.36)%,(16.05±0.58)%,F=13.776,P=0.000]。川芎嗪低、中、高浓度组软骨细胞凋亡率均低于对照组(LSD-t=12.685,P=0.000;LSD-t=21.642,P=0.000;LSD-t=27.107,P=0.000),川芎嗪中、高浓度组软骨细胞凋亡率均低于川芎嗪低浓度组(LSD-t=13.826,P=0.000;LSD-t=21.349,P=0.000),川芎嗪高浓度组软骨细胞凋亡率低于川芎嗪中浓度组(LSD-t=10.875,P=0.000)。见图3。
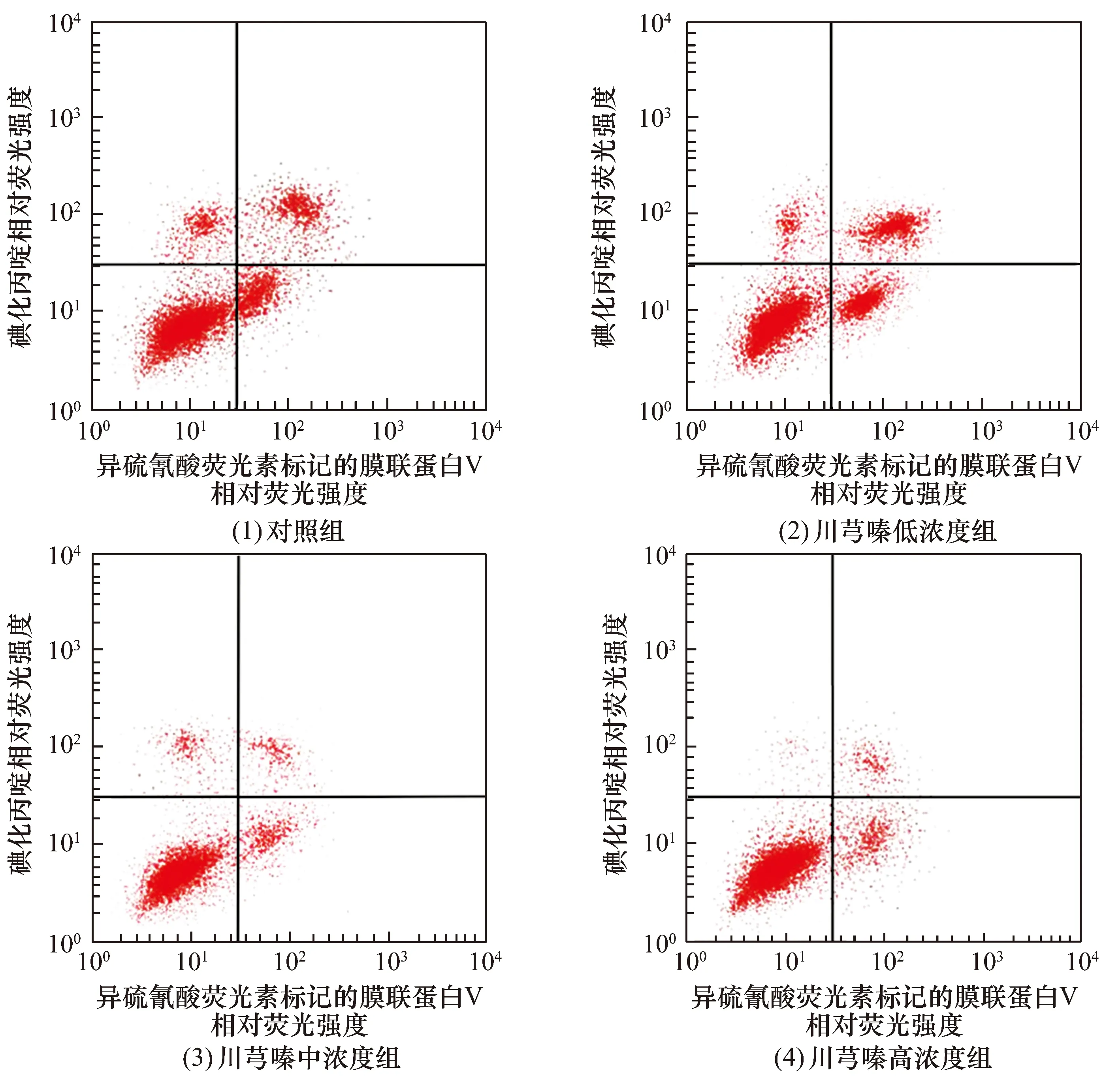
图3 4组骨关节炎软骨细胞凋亡率测定结果
3.4 软骨细胞活力测定结果4组软骨细胞活力比较,差异有统计学意义(吸光度值:0.25±0.04,0.41±0.02,0.54±0.02,0.60±0.01,F=131.875,P=0.000),川芎嗪低、中、高浓度组软骨细胞活力均高于对照组(LSD-t=8.000,P=0.000;LSD-t=14.500,P=0.000;LSD-t=18.981,P=0.000),川芎嗪中、高浓度组软骨细胞活力均高于川芎嗪低浓度组(LSD-t=10.277,P=0.000;LSD-t=19.000,P=0.000),川芎嗪高浓度组软骨细胞活力高于川芎嗪中浓度组(LSD-t=6.000,P=0.000)。
3.5 软骨细胞凋亡相关基因mRNA和蛋白表达分析结果4组软骨细胞Trx-2、ASK-1及Caspase-3的mRNA和蛋白相对表达量比较,组间差异均有统计学意义。川芎嗪低、中、高浓度组软骨细胞Trx-2的mRNA和蛋白相对表达量均高于对照组(mRNA:LSD-t=6.925,P=0.000;LSD-t=15.581,P=0.000;LSD-t=16.046,P=0.000;蛋白:LSD-t=2.479,P=0.000;LSD-t=23.000,P=0.000;LSD-t=33.988,P=0.000),川芎嗪中、高浓度组软骨细胞Trx-2的mRNA和蛋白相对表达量均高于川芎嗪低浓度组(mRNA:LSD-t=7.044,P=0.000;LSD-t=9.581,P=0.000;蛋白:LSD-t=6.149,P=0.000;LSD-t=15.321,P=0.000),川芎嗪高浓度组软骨细胞Trx-2的mRNA和蛋白相对表达量均高于川芎嗪中浓度组(LSD-t=3.994,P=0.004;LSD-t=18.605,P=0.000);川芎嗪低、中、高浓度组软骨细胞ASK-1和Caspase-3的mRNA和蛋白相对表达量均低于对照组(mRNA:LSD-t=8.808,P=0.000;LSD-t=10.398,P=0.000;LSD-t=19.350,P=0.000;LSD-t=3.796,P=0.000;LSD-t=5.096,P=0.000;LSD-t=10.028,P=0.000;蛋白:LSD-t=5.041,P=0.001;LSD-t=13.466,P=0.000;LSD-t=21.719,P=0.000;LSD-t=2.481,P=0.038;LSD-t=7.286,P=0.001;LSD-t=16.865,P=0.000),川芎嗪中、高浓度组软骨细胞ASK-1和Caspase-3的mRNA和蛋白相对表达量均低于川芎嗪低浓度组(mRNA:LSD-t=3.385,P=0.000;LSD-t=20.466,P=0.000;LSD-t=3.400,P=0.000;LSD-t=9.701,P=0.000;蛋白:LSD-t=8.296,P=0.000;LSD-t=17.303,P=0.000;LSD-t=6.228,P=0.000;LSD-t=17.365,P=0.000),川芎嗪高浓度组软骨细胞ASK-1和Caspase-3的mRNA和蛋白相对表达量均低于川芎嗪中浓度组(mRNA:LSD-t=9.550,P=0.005;LSD-t=3.619,P=0.007;蛋白:LSD-t=14.017,P=0.005;LSD-t=4.985,P=0.001)。见表2、图4。

Trx:硫氧还蛋白;ASK:凋亡信号调节激酶;Caspase:半胱氨酸天冬氨酸蛋白酶;β-actin:β-肌动蛋白;(1)对照组;(2)川芎嗪低浓度组;(3)川芎嗪中浓度组;(4)川芎嗪高浓度组。

表2 4组骨关节炎软骨细胞Trx-2、ASK-1及Caspase-3 mRNA和蛋白相对表达量
4 讨 论
OA是一种以关节软骨磨损和关节边缘骨质增生为主要病理特征的关节疾病[9]。软骨组织中没有神经血管,软骨细胞增殖与凋亡的平衡维系着软骨的生理状态[10-11]。在OA病理状态下,软骨细胞增殖与凋亡间的平衡被打破,软骨细胞表现出过度凋亡,加速了软骨的破坏[12]。研究表明,细胞凋亡相关因子在OA的发生发展过程中发挥重要作用,其能够促进软骨细胞基质金属蛋白酶的表达,抑制胶原蛋白和蛋白多糖的合成与分泌,导致关节软骨损伤,加速OA的进程[13-14]。因此,抑制软骨细胞的凋亡进程对于防治OA具有重要意义。川芎嗪是从川芎中分离出来的一种生物碱。Fan等[15]研究发现,对于由高半胱氨酸诱导的人脐静脉内皮细胞凋亡,川芎嗪可减轻细胞的氧化损伤,抑制细胞凋亡。曾利红等[16]研究发现,川芎嗪能够有效抑制OA大鼠软骨细胞凋亡,在阻止OA病情发展方面疗效显著。我们研究发现,随着川芎嗪浓度增加,OA软骨细胞凋亡率下降、活力提高,提示川芎嗪能够抑制人软骨细胞凋亡、提高细胞活力,且该作用在一定浓度范围内呈浓度依赖性。
细胞凋亡机制复杂,Trx-2/ASK-1/Caspase-3信号通路是细胞凋亡的重要通路之一。Trx是一类重要的氧化还原调节分子,广泛存在于生物体内;Trx-2是Trx家族成员,在调控细胞凋亡及氧化应激方面发挥着重要作用[17]。ASK-1是丝裂原活化蛋白激酶家族成员,活化后的ASK-1能够激活细胞凋亡通路,而ASK-1在细胞内与Trx-2结合形成复合物,可降低自身活性[18]。Caspase家族在细胞凋亡过程中发挥重要作用,其中Caspase-3是细胞凋亡的执行者之一,其活化后细胞凋亡将进入不可逆阶段,生理状态下Caspase-3以无活性酶原形式存在于细胞质中,Trx-2/ASK-1复合物可抑制Caspase-3活化[19]。外界信号可通过多种通路激活Caspase-3酶原,促使细胞凋亡,其中Trx-2/ASK-1/Caspase-3信号通路在细胞凋亡过程中发挥重要作用[18]。本研究发现,与对照组比较,川芎嗪干预后关节炎软骨细胞中 Trx-2 的mRNA和蛋白表达量均升高,而ASK-1、Caspase-3的mRNA和蛋白表达量均降低;提示川芎嗪通过调控Trx-2/ASK-1/Caspase-3信号通路发挥抑制软骨细胞凋亡的作用。
本研究结果表明,川芎嗪能够抑制人OA软骨细胞的凋亡,提高软骨细胞活力,且该作用在一定浓度范围内呈浓度依赖性;其作用机制可能与调控Trx-2/ASK-1/Caspase-3信号通路有关。
