新冠疫情下美国非认证N95呼吸器评估计划及其影响
2021-10-26张云裴晓辉周良彬黄敏菊
张云 裴晓辉 周良彬 黄敏菊*
1 广东省医疗器械质量监督检验所 (广东 广州 510663)
2 中国医疗器械行业协会 (北京 100035)
内容提要: 简要分析介绍新冠疫情下美国CDC的NPPTL所开展的非认证N95呼吸器PFE评估计划,为行业了解研究美国疫情中防护产品监管政策和检测工作的协同开展提供参考。
新冠肺炎疫情以来,作为常用个人防护产品,N95呼吸器(也常称为N95口罩)需求量剧增,全球都出现很大程度的供应短缺。为了应对这一危机,美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)发布了一系列应急策略,以期为在疫情中获取和使用有限的医疗器械物资来尽量获得个人防护提供指导[1]。其中包括:当N95呼吸器供应很少时:使用超过制造商货架寿命的N95呼吸器;使用与NIOSH认证呼吸器类似的、经其他国家标准批准的呼吸器(如中国的GB 2626-2006、GB 2626-2019、GB19083-2010);限制性地重复使用N95呼吸器等。相应地,美国食品药品管理局(U. S. Food and Drug Administration,FDA)对口罩、呼吸器、灭菌器、呼吸机等产品制定了紧急使用授权(Emergency Use Authorization,EUA)政策,对满足产品基本性能的产品,豁免相关程序和法规要求,使之前未获许可的制造商快速获得在美国的销售和使用授权,提高市场供应量[2]。在这样的政策促进下,大量国外生产的、未经认证的N95呼吸器开始进入美国市场。
面对外国产品的涌入和非常规使用政策的实施,为了保证防护产品的基本性能,保障公共卫生安全,CDC推出了一系列产品评估检测计划,包括国际呼吸器评估、超期呼吸器评估、净化后呼吸器评估以及新型呼吸器评估。
这些计划由美国国家个人防护技术实验室(National Personal Protective Technology Laboratory,NPPTL)具体开展,并在其官网上公布检测结果。NPPTL作为CDC的一个技术支持部门,其职责为通过发展个人防护技术知识和应用,减少工伤导致的外伤、疾病甚至死亡,它的工作包括呼吸器的审批评估及市场监管,确保呼吸器在美国的工作环境中使用时满足预期性能,且获得批准产品在市场上依然符合标准要求[3]。
NPPTL开展的系列计划中,针对未获得美国国家职业安全卫生研究所(National Institute for Occupational Safety and Health,NIOSH)认证N95呼吸器的国际呼吸器评估计划(以下简称“评估计划”)涉及面最广,影响也最大,且对我国防护产品的出口特别是进入美国市场产生了较大影响。本文拟对该计划的开展思路、进展及其影响做一简要分析,供行业内的政策研究者参考,以便更好地理解美国对N95呼吸器的应急管理以及其中检测工作的作用和影响。
1.评估计划工作思路
评估计划于2020年3月31日发布,其评估对象为与NIOSH认可N95呼吸器相似的、已获得外国(美国以外)标准认可的产品,检测指标为产品核心指标之一——颗粒过滤效率(Particulate Filter Efficiency,PFE)。作为应对新冠肺炎疫情的措施,评估结果不论是否合格都不与NIOSH认可工作相挂钩,也不作为该产品是否符合其宣称标准的判定依据。该评估旨在评估非NIOSH认证的、外国N95呼吸器过滤效率,以更加有效地保障该类产品的呼吸保护基本功能。
评估计划的PFE检测方法源自于NIOSH的过滤器效率测试方法TEB-APR-STP-0059[4](2019年12月19日修订版本,版本号3.2),并对检测时间和样品数量做了修改:测试时间方面,原方法未固定时间,需加载量累积加载NaCl气溶胶达到一定量,由NaCl气溶胶浓度和流量计算出测试时间,最短大约11.76min,修订版方法统一规定检测时间为10min;检测样品数量方面,原检测方法需样品数量为20个,修订版方法样品数量为10个一组。修改后测试方法具体条件为:取10个样品,在相对湿度85%±5%,温度(38±2.5)˚C环境下放置(25±1)h,对样品进行预处理;预处理后,样品放入密封容器中保存,并于10h内完成测试,测试所用NaCl气溶胶浓度不超过200mg/m3,流量为(85±4)L/min,记录过滤效率的最小值作为每个样品的检测结果,10个样品检测结果的最小值不低于95%则判定为合格。
出于保障市场上N95呼吸器基本使用性能的目的,评估计划的样品征集对象为美国N95呼吸器的使用方,不直接从制造商或代理商接收样品。评估计划针对的样品类型、生产地区和产品执行性能标准见表1。
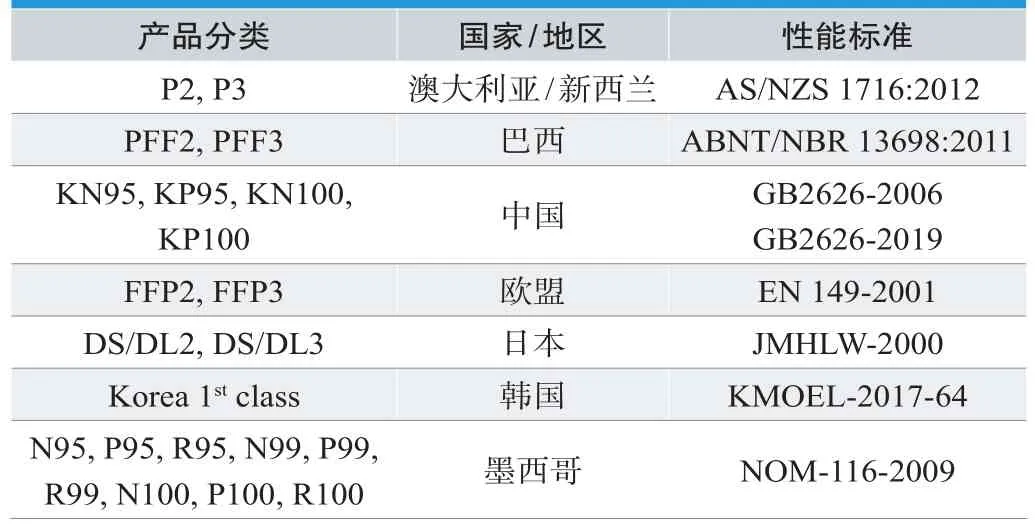
表1. NPPTL过滤效率测试的非NIOSH认证呼吸器分类
虽然上述产品类型与NIOSH批准的产品有相似的性能要求,但CDC不了解这些产品的持续制造商质量体系和产品质量控制,NIOSH也不知道产品离开制造商控制后的处理和储存情况。由于在疫情监管政策下,美国医疗工作者有可能使用这些未经NIOSH批准的口罩,NPPTL拟通过这一简化测试方法,初步评估产品颗粒过滤效率性能以确定其是否符合NIOSH相关要求。评估计划的结果并不与NIOSH的正式认证工作相挂钩。评估结果在提供给样品提供者的同时,也会在NPPTL的网页发布,发布的内容包括口罩的信息、样品照片、检测照片,以及每组10个口罩过滤效率的最小值和最大值。评估使用的测试方法不是NIOSH认证呼吸器用的标准测试程序,因此NPPTL发布评估结果的同时作如下表述:①被测试的呼吸器可能不能代表具有相同认证标志的所有呼吸器,因NIOSH对其他国家或国际认证的呼吸器供应商和经销商没有监管权;②该评估并不是对该呼吸器是否符合其相应认证规范进行确认;③该评估不是NIOSH认证程序的一部分,所得结果也并不能导致或阻止未来NIOSH的认证审批。
2.评估数据分析
截至2021年3月5日,NPPTL网站公布的检测结果见表2。该计划评估的产品共有来自305家制造商的共计379个型号,其中215个型号不合格[5]。从统计的结果看出,美国使用的非NIOSH认证呼吸器绝大部分来自中国,在进入美国的国外呼吸器市场中有极高占有率,表明疫情初期我国呼吸器产能相对较高,保证本国供应的同时,还大量供给美国市场。呼吸器的整体合格率偏低,仅43.1%,其中一方面是由于受疫情影响,原材料供应量不足,产品质量不稳定,产品本身质量不过关;另一方面,也是疫情初期美国呼吸器严重缺乏,为尽量提高防护产品可获得性,产品质量方面的要求相对弱化。

表2. 不同产地产品的PFE检测情况
参加评估的产品中,宣称符合的标准分别有GB2626、GB19083、EN149、GB/T 32610、T/CTCA7、KMOEL、USA(42 CFR 84)、ABNT/NBR 13698,其中GB 2626占比最大,约79.92%,其次为EN149、GB19083和42CFR84,占比分别约27.46%、4.92%和2.46%。合格率方面,经检测,其中合格率除KMOEL为100%(仅有1个报告结果),最高的为GB19083,约为91.67%,其后依次为42CFR84(约为83.33%)、GB2626(约为32.31%)、EN149(约为28.36%)。GB19083产品合格率接近符合GB2626的产品合格率的3倍,体现我国医疗器械管理体系下产品质量水平相对较高。
EUA产品方面,FDA的N95呼吸器EUA清单上共有100家制造商,其中被检测到的制造商26家,占比26.00%,22家结果合格,被检到的产品合格率约84.62%,4家结果不合格,其余制造商未被检测到,EUA清单上的制造商仅有四分之一被检测到,检测覆盖率较小,合格率相对较高,表明经FDA的EUA渠道进入美国市场的产品质量相对更有保障。
针对不同时间段的检测结果统计显示(见表3),随着评估计划开展和结果发布,以及相关监管政策的跟进(如EUA政策的变化,见第3章),美国市场在供应量提高的同时对于N95呼吸器产品质量(特别是PFE)的重视程度提高,后期进入美国的产品质量有所提升并趋于稳定。
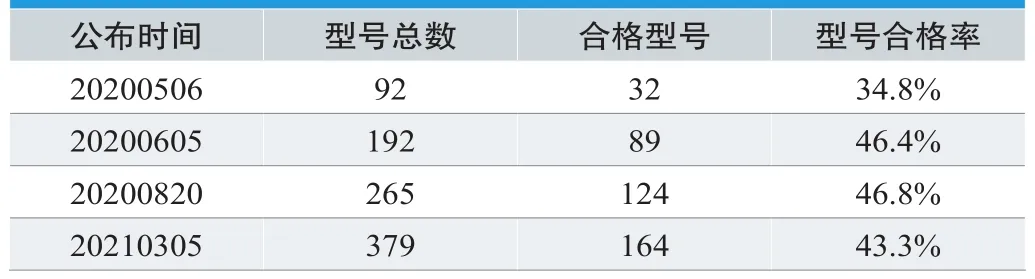
表3. 不同时间段检测结果
分析不合格产品测试数据发现,有些产品的PFE并非每个样品都不合格,其测试结果最小值与最大值之间相差很大,同一型号PFE结果甚至会从8.1%到99.49%,产品质量控制水平较差。通常这样的结果反映产品可能存在原材料不均匀、生产工艺缺乏有效控制、产品质检未能有效执行等方面问题。
3.评估计划的影响
3.1 对美国FDA监管政策的影响
美国FDA面对新冠疫情蔓延、防护产品供应不足的情况迅速制定发布EUA政策,并根据NPPTL检测的结果及时跟进并作出了调整。
FDA开始实施EUA政策之初,就以产品来自中国和非中国两种情况,针对性地发布了两份要求文件和清单,4月3日,FDA发布的针对中国的N95呼吸器EUA政策文件的授权条件为:持有一个或多个NIOSH批准证书的制造商按其他国家标准生产,或是有中国以外的监管机构许可认证,或是有公认的独立实验室出具的符合标准的合格检测报告。由于中国在疫情中实施了有力刺激防护产品产量的相关扶持政策,N95呼吸器产能较充足,因此EUA政策实施后,FDA的EUA清单上的大部分生产商都来自中国,2020年4月17日N95呼吸器EUA清单上的中国生产商有87家,非中国生产商仅有5家。
随着NPPTL对评估计划实施及其测试数据发布,FDA参考评估结果认为,通过原有程序获得EUA的N95呼吸器仍然有较大可能因过滤性能较差而不能提供足够的呼吸防护,进而修改了EUA要求,引入EUA清单移除程序(FDA可以从清单中移除其认为不满足EUA资格的呼吸器),取消了通过提交第三方合格检测报告获取EUA的途径,同时将原先通过该途径获得EUA的74家制造商从授权清单中移除,并要求制造商提交以NIOSH方法检测的PFE合格结果方能重新获得EUA(之前通过提供合格检测报告获得EUA的生产商,必须在45个自然日内提供按NPPTL评估计划中的TEBAPR-STP-0059修订版方法所测得的过滤效率结果,且结果须≥95%,才可以重新列入清单)。
随着这一政策变化,大批中国制造商的产品被移出EUA清单,对当时我国产品进入美国市场的贸易活动带来较大冲击和不利的国际舆论影响。在2020年5月7日FDA加入EUA清除程序后,清单中的中国制造商数量骤减,由4月17日的87家降至14家(其中,删除74家,新增1家)。实际上,根据2020年5月6日NPPTL公布的报告结果统计,被删除的74家制造商中仅11家的产品被检测,其中8家不合格,3家合格,剩余63家制造商的产品并没有被该评估计划所检测。
3.2 对我国N95呼吸器制造行业的影响
早在我国疫情初步受控,我国防护产品生产企业开始寻求产品外销的同时,我国相关监管部门就已经非常重视在提高产能的同时做好出口产品质量控制。2020年3月31日,商务部、海关总署、国家药监局发布《关于有序开展医疗物资出口的公告》(2020年第5号公告)[6],着力加强医疗物资出口的质量监管,并在后续工作中取得了明显的成效。2020年4月25日,我国商务部、海关总署、市场监管总局联合发布《关于进一步加强防疫物资出口质量监管的公告》[7](2020年第12号公告,以下简称《公告》),加强防疫物资质量监管、规范出口秩序。《公告》明确,加强非医用口罩出口质量监管。自4月26日起,出口的非医用口罩应当符合中国质量标准或国外质量标准。商务部确认取得国外标准认证或注册的非医用口罩生产企业清单,市场监管总局提供国内市场查处的非医用口罩质量不合格产品和企业清单,非医用口罩出口企业报关时须提交电子或书面的出口方和进口方共同声明,确认产品符合中国质量标准或国外质量标准,进口方接受所购产品质量标准且不用于医用用途,海关凭商务部提供的企业清单验放,对不在市场监管总局提供的企业清单内的,海关接受申报,予以验放。对4月26日之前已签订的采购合同,出口报关时须提交电子或书面的出口方和进口方共同声明。监管部门希望通过这一系列有针对性的举措,进一步提升出口防疫物资的质量,提前防范有关质量风险,维护中国制造公信力。
美国CDC评估计划的实施和测试数据的公布,以及后续EUA政策的调整,对中国呼吸器进入美国市场产生了一定程度的冲击,在国际舆论中对中国制造产品产生了不良影响。
实际上,该计划的初衷在于服务特定的N95呼吸器使用方,因此虽然获得了相当数量的中国产N95呼吸器测试数据,但这些产品的取样抽样未经科学设计,对于市场上产品数量和质量状况不具有代表性,所得数据只能代表使用方存疑样品的PFE性能,不能代表进入美国市场的中国产品整体情况,更不能代表我国该类产品的整体质量水平。客观上讲,该评估计划的测试结果体现了疫情期间在应急使用政策下进入美国市场的各国(主要是中国)部分N95呼吸器,通过NPPTL测试方法评估的过滤效率性能。其测试结果表现出的各国执行标准差异、制造商质量控制水平等方面问题,一定程度上,可以作为以美国市场为目标的N95呼吸器制造商的参考和借鉴,也可作为我国在控制相关产品对美出口时参考资料,但作为我国该类产品质量水平的整体评估结果来解读,明显是不客观、不科学的。
4.分析小结
美国CDC的这一评估计划,在新冠疫情中对N95呼吸器的质量保障和有效使用提供了直接、有力的技术支持,并为其监管政策的制定提供了数据支持和信息参考,可以认为NPPTL实验室的这一检测工作,为CDC疫情期间防护产品短缺情况下的应急监管政策起到了较为积极的技术支撑作用。
从评估计划公布的测试结果来看,该计划不仅为参与计划的N95呼吸器使用者提供了直接的评估数据,指导其产品的使用,其检测结果也为美国市场各方所引用参考,一定程度上成为N95呼吸器类产品进入美国市场重要参考信息,且直接对政府准入政策产生了影响。
以中国为主要产地的非NIOSH认证N95呼吸器,在疫情初期,大量涌入美国市场,行业内不时出现美国市场大量“天价”订单,成为行业相关企业急速扩展市场的一个重要方向。然而,随着我国产品持续涌入,美国监管措施开始产生影响,如本文所介绍的评估计划以及EUA政策,因为合规和质量问题引起的合同纠纷也不断出现。由于CDC评估计划导致的EUA清单上大量我国产品被移除,一时成为行业话题,对我国制造产品的质量信誉带来了一些争议和疑问。
从整体上来看,这是由于美国市场需求巨大、购买力强、需求紧急,导致其前期准入政策相对较松,各个购买方的要求也较低,在全球货源紧缺的情况下,大多重量不重质,因
此所得产品良莠不齐。另一方面,疫情初期,原材料、人员、生产条件都相对有限,多数生产方也多着眼于提高产能,常常忽略了质量控制。随着疫情逐步受控,美国政府出于公共卫生保障需求,我国有关部门出于国家品牌信誉考虑,都制定修改了相关政策,产品质量整体有所提升。从技术层面分析,评估结果显示,各国产品执行标准的差异,生产者对产品质量的控制水平,都是影响产品合格率的重要因素。
美国CDC这一评估计划的实施,体现了其检测机构与政府监管相关部门的相互协调配合,于疫情中关键物资的保障和监管方面发挥了有力的技术支持作用。检验机构提高自身检验能力,积极履行市场质量监测职能,不仅可以帮助和督促企业质量把关,保障市场上流通的产品质量,还能在突发情况中高效准确地提供应急产品检测结果,协助监管部门在应急事件中迅速掌握亟需的市场产品水平的关键技术参数,为监管部门高效科学地定策施策提供有力的技术支撑。
