6S-5-甲基四氢叶酸钙对小鼠免疫力的增强作用研究
2021-10-26马文斌成永之连增林
薛 娟 马文斌 涂 华 刘 康 成永之 连增林▲
1.北京金康和信药业科技有限公司,北京 100176;2.连云港金康和信药业有限公司,江苏连云港 222000
补充叶酸(folic acid,FA)能够降低神经管畸形及脑卒中的发病率,有助于多种疾病的治疗[1-2],叶酸还原酶将非活性的叶酸代谢形成的5-甲基四氢叶酸等活性叶酸激活,5-亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是叶酸的关键代谢酶[3-4],然而,有26.4%的中国人因为存在该酶的基因位点突变,不能将叶酸转化为活性的5-甲基四氢叶酸,无法发挥其治疗作用,有人群应用的局限性[5]。
6S-5-甲基四氢叶酸钙(商品名:叶源酸®)是一种创新型5-甲基四氢叶酸的钙盐,它能够克服叶酸还原酶点突变所致的叶酸活性转化的限制,适用于各种人群。目前,该专利产品作为叶酸新来源已经被允许用于调制乳粉和固体饮料[6]。但是,至今国内外对其研究多集中在合成方法、含量检测、稳定性等方面[7-8],尚未对其功能展开深入研究,为探讨其潜在的医疗保健价值,本研究探讨6S-5-甲基四氢叶酸钙对机体免疫力的作用。
1 材料与方法
1.1 材料
6S-5-甲基四氢叶酸钙[9](连云港金康和信公司,批号 20141209,发明专利号:ZL201410280541.4)为类白色结晶粉末,实验以饮用纯净水为溶媒,分别配制成低 0.8 mg/(kg·d)、中 1.7 mg/(kg·d)、高5.0 mg/(kg·d)三个剂量,分别相当于人推荐量的5、10、30倍;SPF级ICR小鼠购自上海西普尔-必凯公司[SCXK(沪)2013-0016],雄性,体重16~20 g,动物质量合格证号为2008001646720,实验前,动物在实验室内适应性喂养4 d。
1.2 实验方法
样品液配制方法:取6S-5-甲基四氢叶酸钙0.12 g,加溶媒至240 ml,溶解后混匀,得高剂量为0.5 mg/ml;取高剂量溶液 70 ml,加溶媒 140 ml,混匀后得中剂量为0.17 mg/ml;取中剂量溶液70 ml,加溶媒70 ml,混匀后得低剂量为0.08 mg/ml,按照小鼠1.0 ml/100g体重给药。
按照体重将动物随机分成阴性对照组、低剂量组、中剂量组和高剂量组,每组各10只,低剂量组、中剂量组和高剂量组分别灌胃给予低0.8 mg/(kg·d)、中1.7 mg/(kg·d)、高5.0 mg/(kg·d)剂量的样品液,阴性对照组灌胃给予同等容积的饮用纯净水。每日给药1次,连续30~38 d。
1.3 观察指标
1.3.1 小鼠体重及脏器/体重比 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药,在第一次给样品之前(始重)、给样品的第15天(中重)、给样品的第30天(终重),称量小鼠的体重并记录;实验第37天,取胸腺和脾脏称重,计算胸腺/体重比和脾脏/体重比值。
1.3.2 小鼠脾淋巴细胞增殖能力 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第36天,处死动物,参照瞿飘飘[10]的方法用刀豆蛋白A(concanavalin A,ConA)诱导小鼠脾淋巴细胞转化,MTT法检测细胞增殖情况,在570 nm波长处测定吸光值(OD值),根据式(1)计算淋巴细胞的增殖能力。

1.3.3 小鼠迟发型超敏(delayed type hypersensitivity,DTH)反应 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第34天,腹腔注射0.2 ml 2%(v/v)压积绵羊红细胞(sheep red blood cell,SRBC)悬液,免疫后的第 4 天,参照何晓波等[11]的方法皮下注射20%(v/v)SRBC,测量攻击前后其足跖周长间的差值,以此来表示DTH程度。
1.3.4 小鼠抗体生成细胞溶血空斑数 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第31天,腹腔注射0.2 ml 2% (v/v)SRBC悬液进行免疫,4 d后处死动物,制备脾细胞悬液(5×106个/ml),参照李咏梅等[12]方法混合琼脂糖培养基、10% SRBC(v/v)和脾细胞悬液,并倾倒在玻片上,加入稀释后的补体温育1 h,计数溶血的空斑数。
1.3.5 小鼠血清溶血素测定抗体积数 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第34天,腹腔注射0.2 ml 2%(v/v)(SRBC)悬液进行免疫,免疫5 d后,收集血清作倍比稀释,参照赵珺彦等[13]的方法将血清置于微量血凝板,并与等量0.5% SRBC悬液混匀,37℃温箱中孵育3 h,观察并记录血球凝集程度级数,根据式(2)计算出抗体积数。
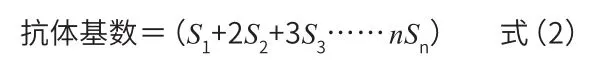
式中:倍比稀释的指数用1、2、3……n代表,凝集程度级数用S代表。
1.3.6 小鼠碳廓清实验吞噬指数 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第38天,尾静脉注入墨汁后立即计时,参照邱红梅等[14]的方法在墨汁注入后的2、10 min眼眶取血,加入到2 ml 0.1% Na2CO3溶液中,在600 nm波长处测定OD值,而后称量肝重、脾重,根据式(3)(4)计算吞噬指数。

1.3.7 小鼠腹腔巨噬细胞吞噬鸡红细胞数 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第37天,向小鼠腹腔内注射1 ml 20%(v/v)鸡红细胞悬液,间隔30 min后处死,参照陈丽芳等[15]的方法取腹腔洗液滴加在载玻片上,37℃培养箱中孵育30 min,Giemsa染色后在油镜下计数巨噬细胞,依照下式(5)计算吞噬百分率。

1.3.8 自然杀伤细胞(natural killer cells,NK cells)活性测定实验 动物按照分组分别灌胃给予低、中、高样品液和饮用纯净水,所有组连续给药至实验第36天,处死动物,参照朱鸿哲[16]的方法制备靶细胞和脾细胞悬液(效应细胞),按照效靶比50∶1加入96孔板,放置在37℃ 、5% CO2培养箱中培养4 h,每孔取上清液100 µl置于96孔板,同时,加入等量LDH基质液,反应7 min后,每孔加入30 µl 1 mol/L的盐酸溶液,在490 nm处测OD值,并根据式(6)计算NK细胞的活性。

1.4 统计学处理
2 结果
2.1 各组小鼠体重及脏器/体重比
各剂量组小鼠体重随着给药时间延长而增加,与阴性对照组比较,差异无统计学意义(P>0.05);各剂量组小鼠的脾脏/体重比、胸腺/体重比均低于阴性对照组,差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠体重及脏器/体重比值比较()

表1 各组小鼠体重及脏器/体重比值比较()
组别 n 始重(g) 中重(g) 终重(g) 胸腺/体重(mg/g) 脾脏/体重(mg/g)阴性对照组 10 18.8±0.4 26.4±0.9 37.2±1.0 1.58±0.22 4.56±0.91低剂量组 10 18.8±0.4 27.0±0.8 37.2±1.3 1.55±0.20 4.12±0.32中剂量组 10 18.8±0.5 26.1±1.1 36.9±1.0 1.52±0.16 4.04±0.40高剂量组 10 18.8±0.5 26.9±1.4 36.7±1.6 1.50±0.20 4.29±0.48 F值 0.090 1.893 0.675 0.327 1.592 P值 0.965 0.143 0.572 0.806 0.208
2.2 各组小鼠脾淋巴细胞增殖能力和DTH反应程度比较
各剂量组小鼠脾淋巴细胞增殖能力OD差值随剂量升高而增加,中、高剂量组显著高于阴性对照组,差异有统计学意义(P<0.05);各剂量组小鼠左后足跖部周长差值均有所增加,差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠脾淋巴细胞增殖能力和DTH反应程度比较()
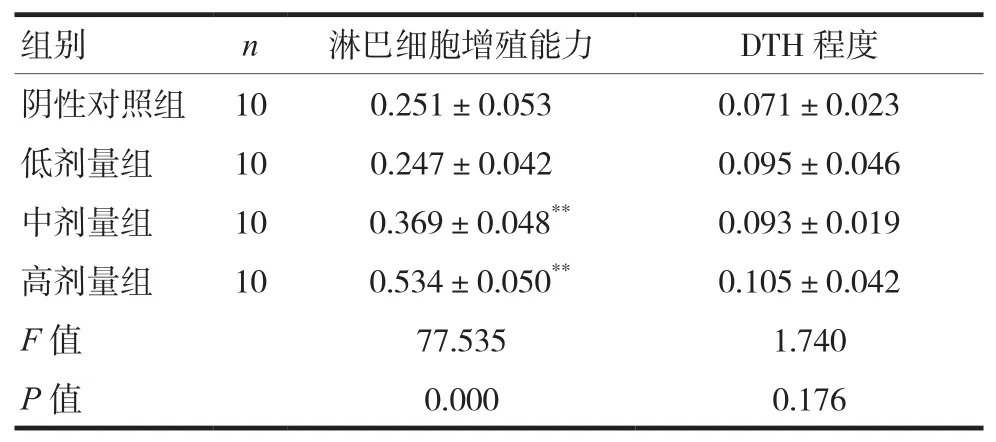
表2 各组小鼠脾淋巴细胞增殖能力和DTH反应程度比较()
注:与阴性对照组比较,**P<0.01
阴性对照组 10 0.251±0.053 0.071±0.023低剂量组 10 0.247±0.042 0.095±0.046中剂量组 10 0.369±0.048** 0.093±0.019高剂量组 10 0.534±0.050** 0.105±0.042 F值 77.535 1.740 P值 0.000 0.176组别 n 淋巴细胞增殖能力 DTH程度
2.3 各组小鼠抗体生成细胞溶血空斑数和血清溶血素抗体积数比较
各剂量组溶血空斑数和血清溶血素抗体积数随剂量升高而增加,中、高剂量组显著高于阴性对照组,差异有统计学意义(P<0.05)。见表3。
表3 各组小鼠抗体生成细胞溶血空斑数和血清溶血素抗体积数()

表3 各组小鼠抗体生成细胞溶血空斑数和血清溶血素抗体积数()
注:与阴性对照组比较,*P<0.05,**P<0.01
阴性对照组 10 28.3±3.2 54.3±8.8低剂量组 10 29.6±3.5 64.3±19.3中剂量组 10 37.0±2.8** 86.6±29.8*高剂量组 10 41.2±2.1** 91.0±29.7**F值 43.553 5.574 P值 0.000 0.003组别 n 溶血空斑数(个)/全脾细胞数 抗体积数
2.4 各组小鼠碳廓清实验吞噬指数比较
各剂量组吞噬指数随剂量升高而增加,显著高于阴性对照组,差异有统计学意义(P<0.05)。见表4。
表4 各组小鼠碳廓清实验吞噬指数比较()

表4 各组小鼠碳廓清实验吞噬指数比较()
注:与阴性对照组比较,*P<0.05,**P<0.01
组别 n 吞噬指数阴性对照组 10 5.79±0.68低剂量组 10 6.63±0.71*中剂量组 10 6.88±0.91**高剂量组 10 7.10±0.74**F值 5.553 P值 0.003
2.5 各组小鼠腹腔巨噬细胞吞噬鸡红细胞指数比较
各剂量组的吞噬百分率(P)和吞噬指数X数值均增加,中、高剂量组显著高于阴性对照组,差异有统计学意义(P<0.05)。见表5。
表5 各组小鼠腹腔巨噬细胞吞噬鸡红细胞指数()

表5 各组小鼠腹腔巨噬细胞吞噬鸡红细胞指数()
注:与阴性对照组比较,*P<0.05
组别 n 吞噬百分率(%) 吞噬指数X阴性对照组 10 35.5±1.8 0.638±0.019低剂量组 10 38.7±3.3 0.671±0.034中剂量组 10 40.0±3.2* 0.684±0.033*高剂量组 10 39.6±4.9* 0.680±0.050*F值 3.398 3.407 P值 0.028 0.028
2.6 各组小鼠NK cells活性比较
各剂量组小鼠NK cells活性均增加,显著高于阴性对照组,差异有统计学意义(P<0.05)。见表6。
表6 各组小鼠NK cells活性比较()
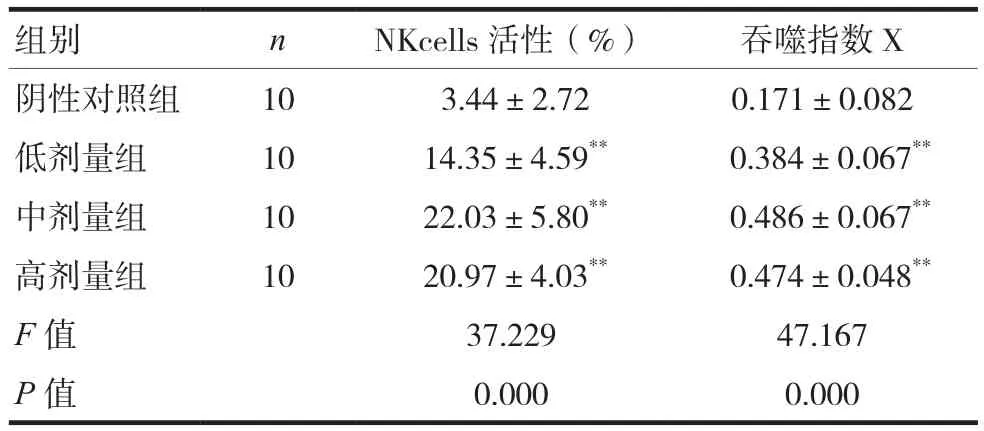
表6 各组小鼠NK cells活性比较()
注:与阴性对照组比较,**P<0.01
组别指数X阴性对照组 10 3.44±2.72 0.171±0.082低剂量组 10 14.35±4.59** 0.384±0.067**中剂量组 10 22.03±5.80** 0.486±0.067**高剂量组 10 20.97±4.03** 0.474±0.048**F值 37.229 47.167 P值 0.000 0.000
3 讨论
本研究中小鼠灌胃给予6S-5-甲基四氢叶酸钙后,三个剂量组小鼠体重变化差别不大,脾脏/体重比、胸腺/体重比平均值低于阴性对照组,小鼠迟发型超敏反应增强,差异无统计学意义(P>0.05),提示6S-5-甲基四氢叶酸钙未显著改变小鼠体重、脏器重量以及DTH反应;低、中、高剂量组小鼠碳廓清功能、NK细胞活性均显著增加(P<0.05),提示6S-5-甲基四氢叶酸钙能显著提高小鼠单核巨噬细胞吞噬能力和NK细胞杀伤靶细胞的能力;中、高剂量组小鼠淋巴细胞增殖能力、溶血空斑数、抗体积数和巨噬细胞吞噬鸡红细胞能力均显著提高(P<0.05)。实验结果表明,6S-5-甲基四氢叶酸钙具有增强小鼠免疫力的作用。
免疫系统是机体防御外来抗原物质的屏障,在机体免疫应答中,通常由非特异性免疫和特异性免疫反应共同发挥作用。免疫能力的强弱与机体抗病能力和疾病预后具有密切关系。巨噬细胞、淋巴细胞、自然杀伤细胞均为发挥免疫功能最重要的免疫指标,考察其变化与否是直接评价人体免疫能力以及各种药物对机体免疫调节作用的重要手段。
本研究采用小鼠和细胞实验研究了6S-5-甲基四氢叶酸钙的免疫调节作用。实验结果显示,6S-5-甲基四氢叶酸钙能够显著增加巨噬细胞吞噬鸡红细胞的吞噬指数,可能是由于其刺激吞噬细胞数量增加所致,为非特异性免疫增强的表现形式;NK细胞是免疫系统中一类特殊的淋巴细胞,它可以被激活以介导细胞毒性活性,并产生高水平的细胞因子和趋化因子,参与非特异性的抗病毒防御机制。而且,NK细胞还在改善造血和实体器官移植、促进抗肿瘤免疫治疗、控制炎症和自身免疫疾病方面具有广阔的前景[16]。本研究中,三个剂量组6S-5-甲基四氢叶酸钙均能显著提高NK细胞的活性,提示6S-5-甲基四氢叶酸钙能够通过提升这些免疫相关细胞活性,从而提高机体的免疫能力,发挥治病防病的重要功能。
特异性免疫属于后天获得性免疫,通过T淋巴细胞和B淋巴细胞进行抗原特异性的免疫反应,特异性免疫反应在预防麻疹和流感嗜血杆菌引起的呼吸道疾病等常见传染病中至关重要[17-18]。为了评价6S-5-甲基四氢叶酸钙对小鼠体液免疫的影响,本研究测定了给药后各组溶血空斑数、抗体积数,三个剂量组指标均显著增加,表明参与抗体合成的巨噬细胞、T和B淋巴细胞亚群的反应性增强。细胞免疫涉及T淋巴细胞及其产物(淋巴因子),ConA诱导淋巴细胞转化和DTH反应需要激活的T淋巴细胞对给定抗原的特异性识别,从而增殖和释放细胞因子,淋巴细胞增殖能力和DTH反应体现了细胞因子诱导巨噬细胞募集和激活的能力。本研究中,三个剂量组DTH反应均增加,中、高剂量组淋巴细胞增殖能力显著增强,小鼠对T细胞依赖抗原反应的增加揭示了6S-5-甲基四氢叶酸钙对T细胞的刺激作用。
叶酸是人体必需的维生素,参与体内蛋白质和DNA的合成,它是一碳代谢的重要甲基供体[19],补充叶酸对人体健康大有裨益[20-21]。本研究结果证明了,6S-5-甲基四氢叶酸钙能够明显增强小鼠特异性和非特异性免疫反应,提示6S-5-甲基四氢叶酸钙在免疫增强研究领域具有重要的应用前景和开发利用价值。6S-5-甲基四氢叶酸作为叶酸在血浆中循环最活跃的形式[22],它可以避免因叶酸代谢酶基因多态性导致的叶酸代谢障碍[23-24],因而具有更高的生物利用度以及生理活性[25]。目前对于6S-5-甲基四氢叶酸钙的研发还处在初期阶段,未来我们将会积极探索6S-5-甲基四氢叶酸钙在免疫和炎症等方面的开发和应用。
综上所述,6S-5-甲基四氢叶酸钙具有增强免疫力功能,为后续开发利用奠定了坚实的基础。
