Fe3+掺杂BiOBr的制备及可见光降解2,4-D的性能研究
2021-10-25谭志斌朱炎聪黄佳蕾陈力然刘超
谭志斌 朱炎聪 黄佳蕾 陈力然 刘超
(长沙理工大学水利工程学院,湖南长沙 410004)
1 引言
在农业生产中由于施药指导的缺乏和农药生产加工废水的不规范排放,大量农药残留于水环境中,给人类和生态安全带来严重威胁。2,4-二氯苯氧乙酸(2,4-D)属苯氧烷类除草剂,是1 500多种除草剂和农药的主要活性物质,又因其成本低,成为世界上最常用的除草剂之一。有研究指出,暴露于2,4-D环境中可能导致人类的神经中毒、生殖缺陷和神经内分泌紊乱,还有可能致癌和致突变[1]。传统的水处理方法无法有效地降解2,4-D,目前急需一种高效稳定的技术来降解这种污染物。
光催化氧化技术是高级氧化技术(AOP)中的一种,是指在光催化剂的参与下,将光能转化为化学能,然后将污染物转化为CO2和H2O等无毒小分子的技术,其在降解农药和减少有毒成分上具有巨大潜力。在众多光催化剂中,BiOBr具有光催化能力强、化学性质稳定等优势,是一种良好的半导体材料。其特殊的层状结构和间接跃迁的方式促进了空穴-电子对的分离,在光催化领域内潜力巨大。然而,BiOBr在光激发后产生的光生电子和光生空穴分离效率低且电子迁移速率低的特性限制了它在光催化领域中的推广。构建异质结和元素掺杂是提升光催化剂性能的有效方法[2]。元素掺杂是在光催化剂晶格内引入少量杂质,引起光催化材料的价带或导带发生改变而形成杂质能级,从而影响能带结构,这种杂质能级也会形成光生电子空穴对的捕获阱,进而延长光生载流子复合,提升光催化活性[3]。还有研究指出,掺杂后的BiOBr纳米片的分散性和结晶性均优于纯BiOBr[4],这对光催化材料性能的改善大有裨益。
本文通过BiOBr基光催化剂在可见光下降解2,4-D的光催化性能,首先确定溶剂热法的最适制备温度,进而合成一系列金属元素掺杂的BiOBr,确定最佳掺杂元素Fe3+,最后进一步优化掺杂量,达到最佳光催化活性,并通过动力学拟合进一步分析降解数据,为处理2,4-D污染与全面减少其有毒成分提供思路。
2 实验部分
2.1 试剂与材料
溴化钠(NaBr)、硝酸铋[Bi(NO3)3·5H2O]、乙二醇[CH2(OH)2]、硝酸铁[Fe(NO3)3·9H2O]、硝酸铈[Ce(NO3)3·6H2O]、硝酸铜[Cu(NO3)2·3H2O]、硝酸钴[Co(NO3)2·6H2O],以上试剂均为分析纯,国药集团化学试剂有限公司;2,4-D,97%,上海麦克林生化科技有限公司;实验用水均为超纯水。
2.2 仪器与测试方法
电子分析天平,岛津实验器材有限公司;水热反应釜,英国马尔文仪器有限公司;氙灯光源,低温恒温槽,北京泊菲莱科技有限公司;紫外可见分光光度计,岛津实验器材有限公司;电热恒温干燥箱,无锡卓盛实验设备有限公司;超纯水机,重庆力德高端水处理设备研发有限公司。
2.3 催化剂的制备
采用溶剂热法制备金属元素掺杂的BiOBr。以Fe3+掺杂比为5%为例,以NaBr作为Br源,以Bi(NO3)3·5H2O作为Bi源,以Fe(NO3)3·9H2O作为Fe源。准确称取0.972 g Bi(NO3)3·5H2O加入适量乙二醇中,剧烈搅拌至完全溶解,逐滴滴加10 mL 0.2 mol/L NaBr溶液,继续搅拌5 min后,滴加10 mL 10 mmol/L Fe(NO3)3·9H2O溶液,搅拌30 min。随后将混合液加入聚四氟乙烯衬里的反应釜中用烘箱进行反应,设置反应温度,反应时间为12 h。溶剂热反应结束后,待反应釜冷却至室温,用真空抽滤机抽滤,并用酒精和超纯水清洗3次样品。得到的样品在60℃烘箱中烘干10 h,最后研磨备用,记为Fe0.5-BiOBr。此外,按照上述制备方法,不添加Fe(NO3)3·9H2O溶液,制备纯BiOBr。
2.4 光催化性能
实验采用BiOBr基催化剂,利用可见光(λ>420 nm)降解2,4-D,测试其光催化性能。利用300 W氙灯配置420 nm滤光片提供可见光光源。用电子天平称取50 mg光催化剂置于10 mg/L 2,4-D溶液中,在黑暗下搅拌30 min以达到吸附-解吸平衡,然后将夹套烧杯置于氙灯光源下10 cm处,并通过恒温槽循环供给25℃水,保证反应溶液处于恒温状态,整个过程保持在磁力搅拌下进行。在光催化降解过程中,每隔20 min抽取3 mL左右上清液,通过0.45μm微孔滤膜过滤,使用紫外可见分光光度计测试其溶液浓度(测试波长为282 nm),然后计算其降解率。光催化降解2,4-D效率(η)可采用下式计算:
η=(C0-Ct)/C0
式中,C0表示2,4-D溶液初始浓度,mg/L;Ct表示实验某时刻上清液浓度,mg/L;η表示降解效率,%。
3 结果与讨论
3.1 BiOBr制备温度优化
溶剂热反应温度可通过影响前驱体的溶解、成核和晶体生长等阶段导致样品的光催化性能发生一定的变化。为确定最佳的溶剂热温度,实验过程仅调节溶剂热反应温度制备BiOBr,进而研究BiOBr光催化降解活性的变化。不同溶剂热温度(100,120,140,160℃)下制备的BiOBr光催化剂表现出的吸附和降解性能如图1所示。在暗反应阶段,复合催化剂的吸附性能在140,160℃没有明显变化,在120℃时显著增强,在100℃表现最优。然而,在光反应过程中,120℃下制备的BiOBr表现出最佳的光催化活性。尽管在暗反应阶段100℃制备的样品表现出最佳的吸附性能,但是其光催化降解效率最低。综上所述,溶剂热反应温度为120℃时样品的光催化性能最好,后续采用120℃为光催化剂的制备温度。
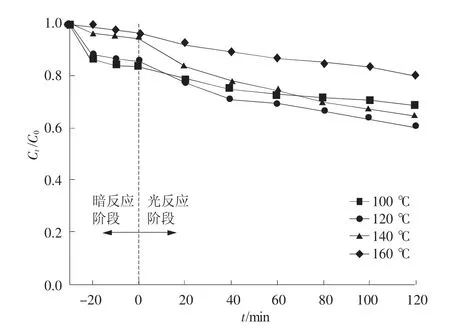
图1 不同温度下BiOBr对2,4-D降解效率
3.2 金属元素掺杂优化
为制备对2,4-D选择性降解最优的光催化材料,实验选用铁(Fe3+)、钴(Co2+)、铜(Cu2+)、铈(Ce3+)4种不同金属元素以3%掺杂比例掺杂BiOBr,合成的4种光催化剂的光催化性能如图2所示。其中,Cu2+掺杂BiOBr在暗反应阶段表现出最佳吸附性能,但在光反应阶段催化能力较差,可能由于Cu2+掺杂导致BiOBr比表面积增大,使其吸附能力增强[5],但可能是掺杂过后掩盖BiOBr表面活性位点导致光催化能力下降。其余3种金属元素掺杂BiOBr后制备的光催化剂产生的光催化活性均优于纯BiOBr,这可能是由于掺杂元素在BiOBr中引入了杂质能级,使得光生电子跃迁方式更加多样,并且掺杂过后可能使BiOBr提升对入射光的捕获能力,光响应范围拓宽,产生更多的光生载流子[6],这两种机制均可有效限制光生电子和光生空穴的复合,进而提升光催化降解2,4-D效率。在4种金属元素掺杂中,Fe3+使得BiOBr光催化性能表现最佳。后续研究保持在Fe3+元素掺杂前提下,变换Fe3+元素掺杂比以获得最佳光催化性能。
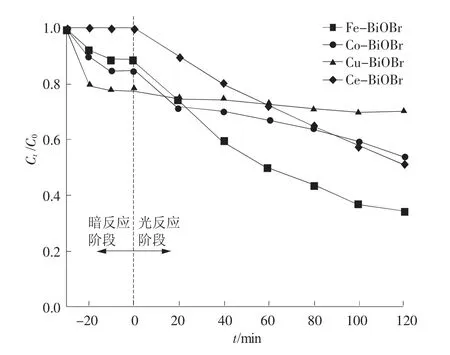
图2 不同金属元素掺杂对2,4-D降解效率
3.3 Fe3+掺杂比例优化
不同掺杂比的Fe3+掺杂BiOBr复合光催化剂降解2,4-D的光催化活性如图3所示。当Fe3+的掺杂比为5%时,系统对2,4-D的光催化降解效率最高,120 min后可达81.8%,比纯BiOBr的降解率高出42.1%。当Fe3+的掺杂比低于5%时,随着Fe3+掺杂量逐渐升高,对2,4-D的降解率也逐渐升高,Fe0.01-BiOBr和Fe0.03-BiOBr作用2,4-D时的降解率分别为38.8%和73.0%。这可能是随着适量掺杂比的Fe3+的掺杂,使得BiOBr表面产生一定数量的氧空位并且在BiOBr引入杂质能级,使系统捕获载流子增加,光催化活性随之提高。而过量掺杂比的Fe3+掺杂后,容易引起光催化材料的团聚,干扰光催化性能[7]。另外,过量的Fe3+掺杂还能产生过多缺陷,缺陷能形成光生载流子的复合中心,限制光催化性能。
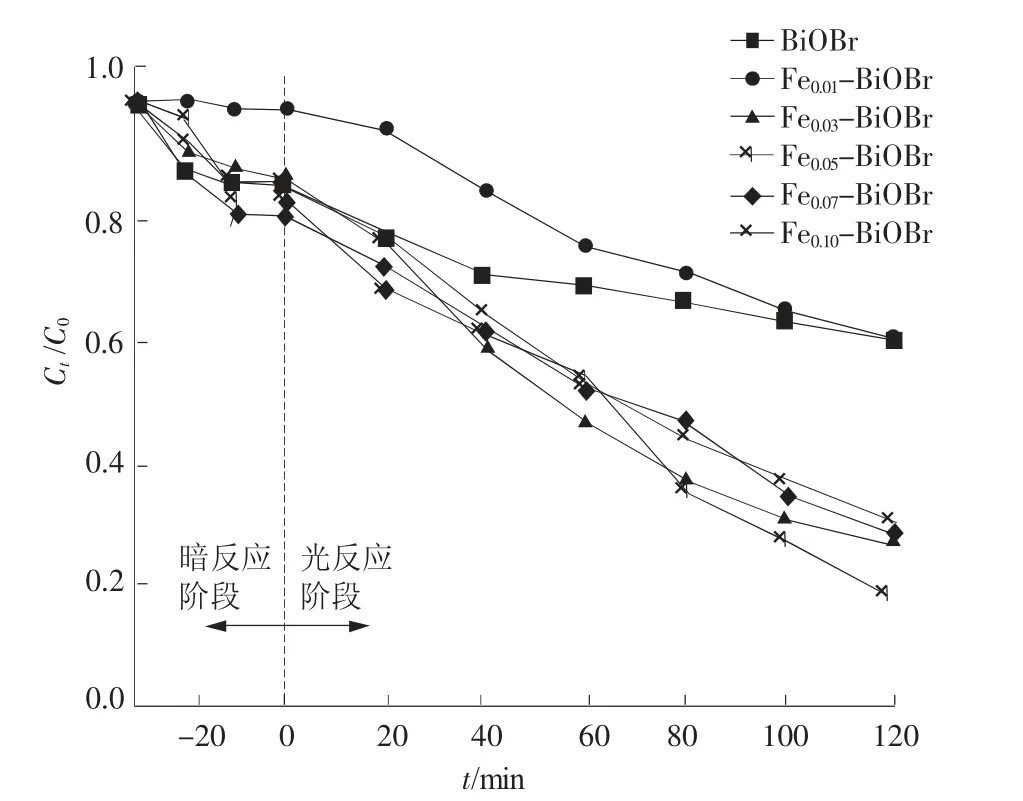
图3 Fe3+不同掺杂比的BiOBr对2,4-D降解效率
3.4 动力学拟合
为进一步研究光催化降解特性,对本实验光反应阶段数据进行第一动力学拟合,Fe3+不同掺杂比的BiOBr对2,4-D动力学分析见图4。

图4 Fe3+不同掺杂比的BiOBr对2,4-D动力学分析
Fe3+不同掺杂比的BiOBr对2,4-D去除率及动力学分析见表1。

表1 Fe3+不同掺杂比的BiOBr对2,4-D去除率及动力学分析
由表1可以看出,当Fe3+掺杂后,反应速率常数k明显增大。实验中k值大小顺序为:Fe0.05-BiOBr>Fe0.03-BiOBr>Fe0.07-BiOBr>Fe0.10-BiOBr>BiOBr>Fe0.01-BiOBr。Fe0.05-BiOBr的k值是BiOBr的2.9倍,表现出掺杂过后的光催化剂优异的理化性质。
4 结论
本实验以NaBr作为Br源,以Bi(NO3)3·5H2O作为Bi源,在确定BiOBr最佳制备温度后,利用溶剂热法制备不同元素、不同掺杂比例的BiOBr光催化剂,进而测试其光催化降解2,4-D性能,得出如下结论:
(1)利用溶剂热法通过4种不同温度(100,120,140,160℃)制备BiOBr光催化剂,120℃下制备的光催化剂性能表现最佳,光催化性能较100,140,160℃分别提升8.5%,4.4%,19.67%。
(2)利用Fe3+,Co2+,Cu2+,Ce3+4种元素掺杂BiOBr,对比光催化性能可知,Fe3+掺杂更有利于提升BiOBr光催化性能。
(3)当Fe3+掺杂比为5%时,Fe0.05-BiOBr光催化活性最佳,120 min后对2,4-D降解率达81.8%,较纯BiOBr提升约42.1%,经过第一动力学拟合后,速率常数为0.012 25 min-1。
