壳聚糖/β-甘油磷酸钠/胶原水凝胶包裹IR-780碘化物标记肌腱干细胞的体内示踪研究
2021-10-25杨志金盛晓飞段少飞唐康来
杨志金,徐 江 ,盛晓飞 ,陈 康 ,段少飞 ,李 斌 ,唐康来
1.中国人民解放军联勤保障部队第九二O医院康复医学科,昆明 650032;2.陆军军医大学第一附属医院骨科运动医学中心,重庆 400038
肌腱损伤在体育运动及其他剧烈活动中均十分常见。肌腱自身再生能力较差,自然愈合常形成瘢痕组织,导致机械性能下降,且容易再次损伤。肌腱损伤的常规治疗方法包括非手术治疗及手术治疗,但这些治疗方法均疗效有限,不能恢复肌腱的自然结构及机械性能。干细胞治疗有促进损伤肌腱组织再生的潜能,肌腱干细胞(tendon stem cells,TSCs)是来源于肌腱的间充质干细胞。肌腱组织工程使用TSCs促进损伤肌腱组织再生,是一项极有前景的治疗方法。
干细胞局部注射很难避免细胞渗漏等问题,且干细胞也很难在损伤部位长时间驻留,因此需研究更适宜的干细胞移植技术。可使用生物支架材料包裹干细胞局部注射治疗肌腱损伤,同时TSCs也需要合适的支架材料以保持其干性,及成肌腱分化方向。水凝胶是制作组织工程支架最经济、有效的方法,水凝胶为移植的干细胞提供了一个模拟肌腱细胞外基质(extracellular matrix,ECM)的载体和微环境。壳聚糖(Chitosan,C)/β-甘油磷酸钠(β-glycerophosphate,GP)/胶原(collagen,Co)水凝胶是近年组织工程领域重点关注的一种可注射温敏水凝胶,其加入了肌腱组织的主要组成成分Ⅰ型胶原,可能更适宜作为肌腱组织工程支架。
外源性干细胞移植在组织再生及功能修复方面极具前景[1]。干细胞移植后迁移到损伤部位,存活并分化为靶细胞而发挥功能。确定移植的干细胞是否可以定位在受损的器官或组织中,是干细胞移植治疗的基础[2]。为了监测干细胞在体内的分布、存活、增殖、分化等生物学行为,合适的干细胞示踪技术起到至关重要的作用[3-4]。活体光学成像技术(optical imaging,OI)由于具有损伤小、灵敏度高、实时动态监测和没有放射性等优点,是近年研究的热点。其中近红外(near-infrared,NIR)荧光探针在细胞培养及动物体内实验中均有广泛研究[5]。菁染料是目前被广泛应用的一种近红外荧光探针,吲哚菁绿(Indocyanine green,ICG)已被食品药品监督管理局(food and drug administration,FDA)批准应用于临床,包括:心脏功能检测、眼科视网膜血管造影及肝功能检测等[6-7]。同时ICG被用于干细胞的标记示踪[8]。虽然ICG的临床应用广泛,但它为水溶性荧光探针,在体内代谢较快,成像时间较短。且用于标记干细胞的标记效率低、荧光信号强度较弱等因素限制了其在干细胞体内示踪中的应用。IR-780碘化物是一种新型的近红外七甲川花菁类荧光探针,具有良好的光学特性。IR-780碘化物用于标记干细胞,具有良好的生物相容性及独特的光学性能[9]。
本研究拟对用IR-780碘化物标记,由C/GP/Co水凝胶包裹,移植至动物体内的TSCs进行示踪观察,观察移植后带荧光标记的TSCs的分布及存活情况,为进一步C/GP/Co水凝胶包裹TSCs移植至体内的动物实验奠定基础。
材料与方法
1 材料
1.1实验动物 14只雄性SD大鼠(4周龄,体重约100g,陆军军医大学实验动物中心提供)。所有动物严格按照实验动物治疗和处理指南进行处理,实验程序均由陆军军医大学动物研究医学伦理委员会批准[SYXK(渝)20170002]。
1.2主要试剂 低糖DMEM培养基(Hyclone公司,美国);胎牛血清(Gibco公司,美国);Ⅰ型胶原酶(Sigma公司,美国);胰蛋白酶(Hyclone公司,美国);青-链霉素双抗(Hyclone公司,美国);Hoechst染色液(上海碧云天公司,中国);Mito-Tracker Green (Invitrogen公司,美国);IR-780碘化物(Sigma公司,美国);RNaseA(北京鼎国昌盛公司,中国);PI染色液(北京鼎国昌盛公司,中国);CCK-8试剂盒(合肥Biosharp公司,中国) ;PBS缓冲液(北京中杉金桥公司,中国);DAPI染色液(上海碧云天公司,中国)。
1.3主要仪器 YJ-1450型超净工作台(苏州净化设备厂,中国);3211型细胞培养箱(Forma公司,美国);37℃恒温水浴箱(哈尔滨东明医疗仪器厂,中国);90-2型磁力搅拌器(上海沪西分析仪器厂,中国);OLYMPUS-IX70荧光显微镜(Olympus 公司,日本);Leica TCS SP2激光共聚焦显微镜(Leica公司,德国);KODAK多功能活体成像系统(KODAK公司,美国);FACStar Plus 流式细胞仪(BD公司,美国);iMarkTM酶标仪(Bio-Rad 公司,美国)。
2 方法
2.1IR-780碘化物的配制 IR-780碘化物为深绿色粉末,用二甲亚砜(DMSO)溶解后调整浓度至10mM,分装至1.5mL EP管,置于-20℃冰箱避光保存。
2.2大鼠跟腱来源TSCs的分离及培养 取4周龄SD雄性大鼠2只,体重约100g,CO2麻醉处死后,无菌条件下取双侧跟腱中段组织,剔除腱鞘及腱周结缔组织。将肌腱均匀剪碎成1mm×1mm组织块,每100mg肌腱组织加入含3mg/mLⅠ型胶原酶和4mg/mL中性蛋白酶混合溶液1mL,37℃孵箱消化2h。加入与消化液等体积的10%胎牛血清(FBS)溶液终止消化,收集细胞悬液,用血细胞计数板计数细胞。细胞计数后,用含20%FBS的适量DMEM培养基调整细胞密度至(1~2)×104cells/mL,将混悬液种植于75cm2细胞培养瓶中,10mL/瓶,将培养瓶置于37℃、CO2浓度为5%的孵箱中静置培养。每3d更换培养基并在显微镜下观察生长情况。当细胞生长至70%~80%融合时,即可传代。原代为P0代,扩增至P1~P3代用于进一步实验。取P2代细胞进行克隆形成能力及成骨、成软骨、成脂肪分化等实验,鉴定为TSCs 后用于后续实验[10]。
2.3C/GP/Co水凝胶的配制 在超净台中,冰浴条件下吸取6mL C溶液加入10mL无菌离心管中,置于冰上预冷。再将1mL GP溶液逐滴加入到C溶液中并不断震荡离心管,使其充分混合均匀,即可获得C/GP溶液,体积比为6∶1。将7mLC/GP溶液加入50mL无菌离心管中,将8mL 2mg/mL的Co溶液快速加入C/GP溶液中,不断震荡离心管,使其充分混合均匀,即可获得C/GP/Co溶液,体积比为6∶1∶8。
2.4IR-780碘化物标记TSCs细胞内定位 将P2代TSCs从培养瓶消化下来,调整浓度为5×106/mL,分装于5个1.5mL无菌EP管中,每个EP管200μL。1 000rpm离心5min后弃上清,以含IR-780碘化物20μM的无血清DMEM培养基200μL重悬细胞。混匀后置于37℃、5%CO2孵箱内孵育15min。用含10%FBS的完全培养基重悬为单细胞悬液,调整细胞浓度为2×105/mL。将标记好的TSCs按照1mL/皿接种于激光共聚焦专用培养皿中,置于37℃、5%CO2孵箱内培养。培养24h细胞完全贴壁,弃培养基,PBS漂洗3次,每次5min。每个培养皿加入1mL含100nM Mito-Tracker Green荧光探针的培养基,37℃孵育30min,用Hoechst染色液复染细胞核。激光共聚焦显微镜下观察IR-780碘化物标记TSCs的细胞内定位。
2.5检测IR-780碘化物标记TSCs的阳性率 IR-780碘化物标记TSCs方法同上,1 000rpm离心5min后弃上清,用4%多聚甲醛固定30min,再次1 000rpm离心5min后弃上清。每样品管加入200μL PBS溶液重悬,制备为单细胞悬液,使用FACStar Plus流式细胞仪检测IR-780标记的阳性细胞比例,以正常未标记TSCs为阴性对照。
2.6检测IR-780碘化物标记TSCs对其细胞周期的影响 将P2代TSCs从培养瓶消化下来,调整细胞浓度为5×106/mL,分装于15 mL离心管中。1 000rpm离心5min后弃上清,以含IR-780碘化物20μM的无血清DMEM培养基重悬细胞。混匀后置于37℃、5% CO2孵箱内孵育15min。用含10%FBS的完全培养基重悬为单细胞悬液,调整细胞浓度为2×105/mL。将标记好的TSCs及正常TSCs按照2×105/mL接种于培养瓶中,置于37℃、5%CO2孵箱内培养。培养24h后,IR-780碘化物标记细胞及正常细胞完全贴壁,弃培养基,PBS漂洗3次,每次5min。用0.25%胰蛋白酶分别将IR-780碘化物标记细胞及正常细胞从培养瓶消化下来,1 000rpm离心5min,弃上清。用PBS溶液重悬细胞,并转移至1.5mL EP管中,1 000rpm离心5min后弃上清。分别加入70%冷乙醇溶液固定IR-780碘化物标记细胞及正常细胞,置于4℃冰箱,过夜。分别加入RNase A,37℃条件下30min。分别加入PI,37℃条件下10min。使用FACStar Plus流式细胞仪检测IR-780标记细胞及正常细胞的细胞周期。
2.7检测IR-780碘化物标记TSCs对其增殖的影响 将标记好的P2代TSCs及正常P2代TSCs按照2×105/mL接种于培养瓶中,置于37℃、5%CO2孵箱内培养。培养24h后,IR-780碘化物标记细胞及正常TSCs完全贴壁,弃培养基,PBS漂洗3次,每次5min。用0.25%胰蛋白酶分别将IR-780碘化物标记细胞及正常TSCs从培养瓶消化下来,1 000rpm离心5min,弃上清。用含10%FBS的完全培养基将IR-780碘化物标记细胞及正常TSCs重悬制备为单细胞悬液,调整细胞浓度为2×104/mL。将IR-780碘化物标记细胞及正常TSCs单细胞悬液分别加入到96孔板中,每孔加入100μL细胞悬液,即每孔细胞总数为0.2×104/孔。将96孔板置于37℃、5% CO2孵箱中,静置培养,每3d换液1次。在培养1、4、7d后,按10μL/孔分别加入CCK-8试剂,置于37℃、5% CO2孵箱中,静置培养2h后在酶标仪上读取波长为450nm的光密度值(optical density,OD)。各组每个时间点设置6个复孔。
2.8C/GP/Co水凝胶混合IR-780碘化物标记的TSCs体内活体成像观察 4只SD大鼠用于活体成像观察,用2.5%戊巴比妥钠溶液按大鼠体重(4.5mg/kg)腹腔注射麻醉后,将大鼠左侧后肢置于伸膝、踝背屈90°、稍外展位固定,使左侧跟腱暴露清楚。每只大鼠的左侧后肢制作跟腱缺损模型,右侧后肢不做任何处置。将大鼠左侧后肢局部褪毛,常规消毒铺巾。将SD大鼠左侧跟腱处皮肤纵行切开约1.5 cm,钝性分离跟腱周围组织,将跟腱完整暴露。然后将跟腱中间1/3完整切除,上至肌腱连接处,下至跟骨,缺损大小约10mm×1mm。术后用丝线逐层缝合皮肤及皮下组织。由同一名术者完成4只SD大鼠的左侧跟腱缺损模型制作。
在超净台中,冰浴条件下制备C/GP/Co溶液1.5mL。收集IR-780碘化物标记的TSCs 4×106个,将4×106个细胞加入1.5mL C/GP/Co溶液中,充分混合均匀,备用。用1mL注射器抽取300μL上述混合溶液,注射至大鼠左侧跟腱损伤部位。用相同方法,由同一名术者依次完成4只SD大鼠左侧跟腱的注射。将4只SD大鼠分笼饲养,自由活动。4只SD大鼠分别于注射后1、7、14、28d用CO2麻醉后,置于KODAK多功能活体成像系统内观察,用Kodak MI software 5.0.1软件进行荧光信号强度分析。
2.9C/GP/Co水凝胶混合IR-780碘化物标记的TSCs体内注射后的组织学分析 8只SD大鼠用于组织学分析,大鼠跟腱损伤模型及C/GP/Co水凝胶混合IR-780碘化物标记的TSCs注射方法同上。分别于注射后1、7、14、28d随机取2只SD大鼠,用CO2过度麻醉法处死后,取材用于组织学观察。先剔除大鼠跟腱腱膜及周围脂肪组织,放入组织盛装盒内,加入组织保存液,迅速转移至-80℃冰箱,冷冻30min。待肌腱组织冷冻为固体后,转移至冰冻切片机切片,切片厚度8μm。将两张相邻切片贴附于干净的载玻片上,4%多聚甲醛固定30min,室温晾干。用DAPI染色液染色10min,水溶性封片剂封片。切片于Leica激光共聚焦显微镜下观察。
3 统计学分析
结 果
1 IR-780碘化物标记TSCs的细胞内定位
激光共聚焦显微镜下观察,可见IR-780碘化物标记TSCs的荧光信号呈红色,分布在细胞胞浆,呈点状及线状形态。用线粒体特异性探针Mito-tracker green双标后发现,Mito-tracker green的绿色荧光与IR-780红色荧光共同定位于细胞线粒体,证实IR-780标记TSCs定位于细胞线粒体内。见图1。
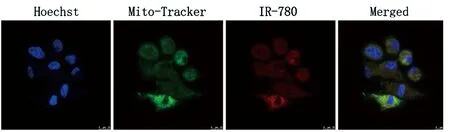
图1 IR-780碘化物标记大鼠TSCs细胞内定位。Hoechst染细胞核,呈蓝色;Mito-tracker green为绿色荧光;IR-780为红色荧光。标尺:2μm
2 流式细胞仪检测IR-780碘化物标记TSCs的阳性率
IR-780碘化物标记的TSCs经流式细胞仪检测,细胞标记阳性率95.75%,荧光强度显著高于对照组细胞。见图2。
3 IR-780碘化物标记对TSCs细胞周期的影响
IR-780碘化物标记的TSCs经流式细胞仪检测,结果证实:IR-780对TSCs的细胞周期无显著影响。IR-780碘化物标记的TSCs与正常TSCs的细胞周期比较差异无统计学意义。见图3。
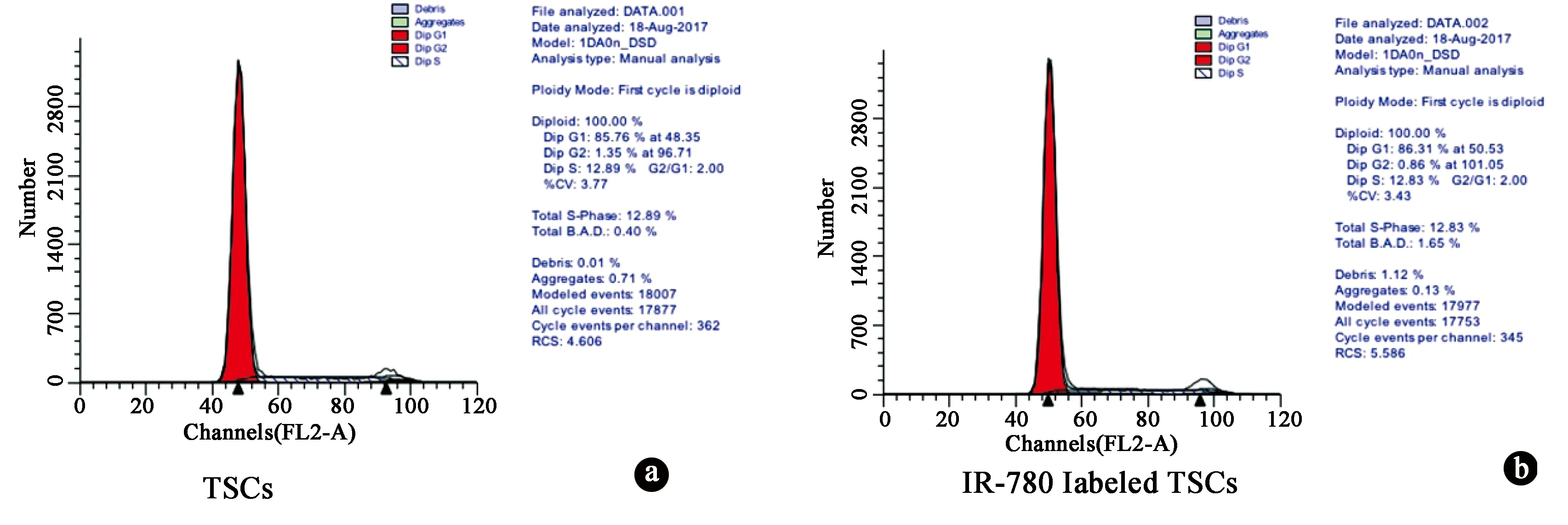
图3 IR-780碘化物标记大鼠TSCs对其细胞周期的影响。 a.正常TSCs的细胞周期;b.IR-780碘化物标记的TSCs的细胞周期
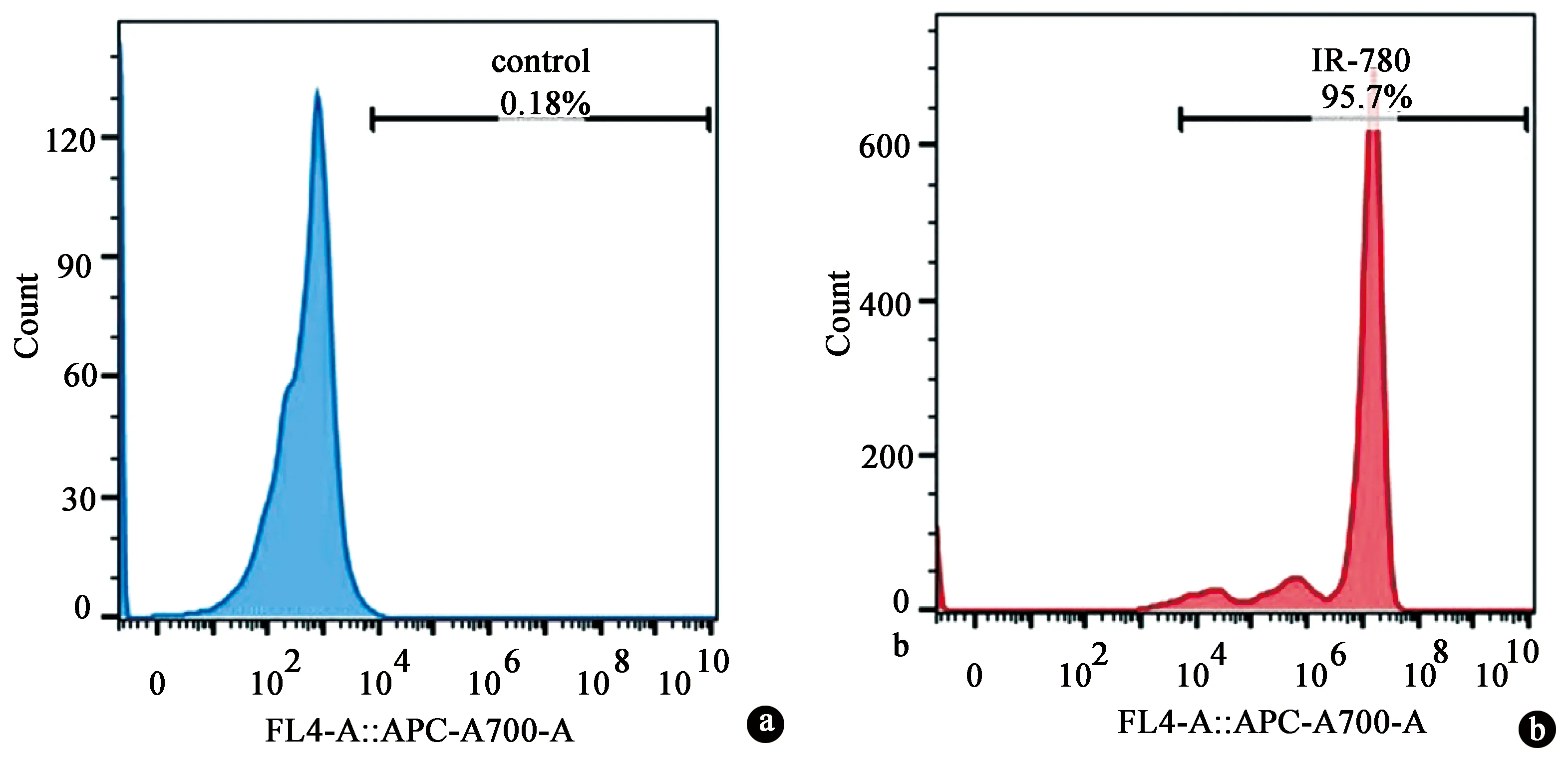
图2 流式细胞仪检测IR-780碘化物标记TSCs的阳性率。a.正常TSCs;b.IR-780碘化物标记的TSCs
4 IR-780碘化物标记对TSCs细胞增殖能力的影响
TSCs及IR-780碘化物标记TSCs在培养1、4及7d时两组细胞的OD值均逐渐增高,与正常TSCs相比,IR-780碘化物标记对细胞的增殖能力无显著影响,各时间点两组之间差异无统计学意义。见图4。TSCs及IR-780碘化物标记TSCs在培养1、4及7d时两组细胞的OD值均逐渐增高,各时间点两组之间比较差异无统计学意义。
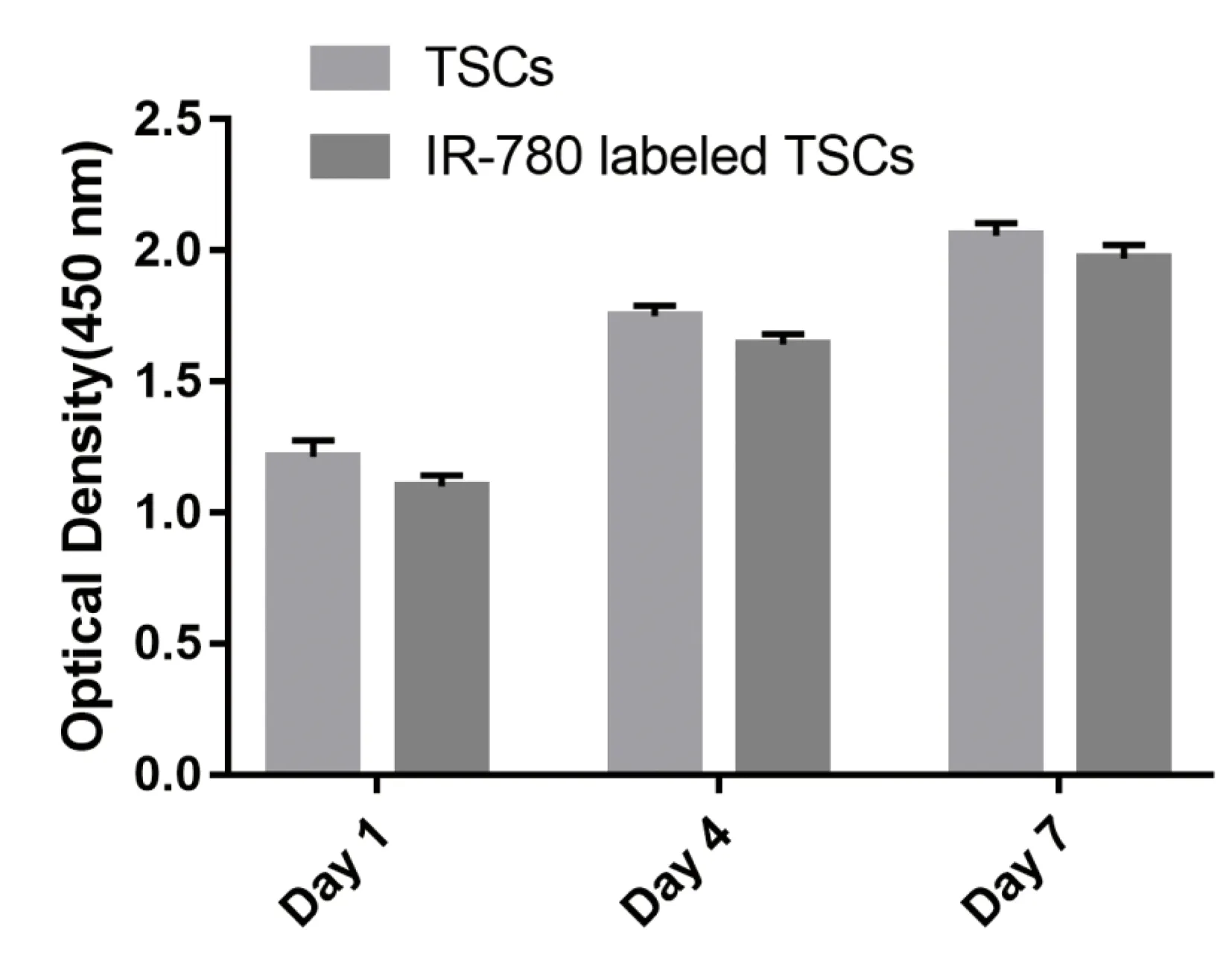
图4 CCK-8法检测IR-780碘化物标记TSCs增殖的影响
5 C/GP/Co水凝胶混合IR-780碘化物标记的TSCs在大鼠体内活体成像观察
大鼠左侧跟腱损伤部位注射C/GP/Co水凝胶混合IR-780碘化物标记的TSCs溶液后,分别于注射后1、7、14、28d活体成像观察。注射后1d活体成像观察显示:大鼠左侧跟腱损伤区域及周围,可检测到强荧光信号,与周围组织比较明显。注射后7、14及28d,随着时间延长,荧光信号逐渐减弱,但注射后28d仍可检测到明显荧光信号。见图5。
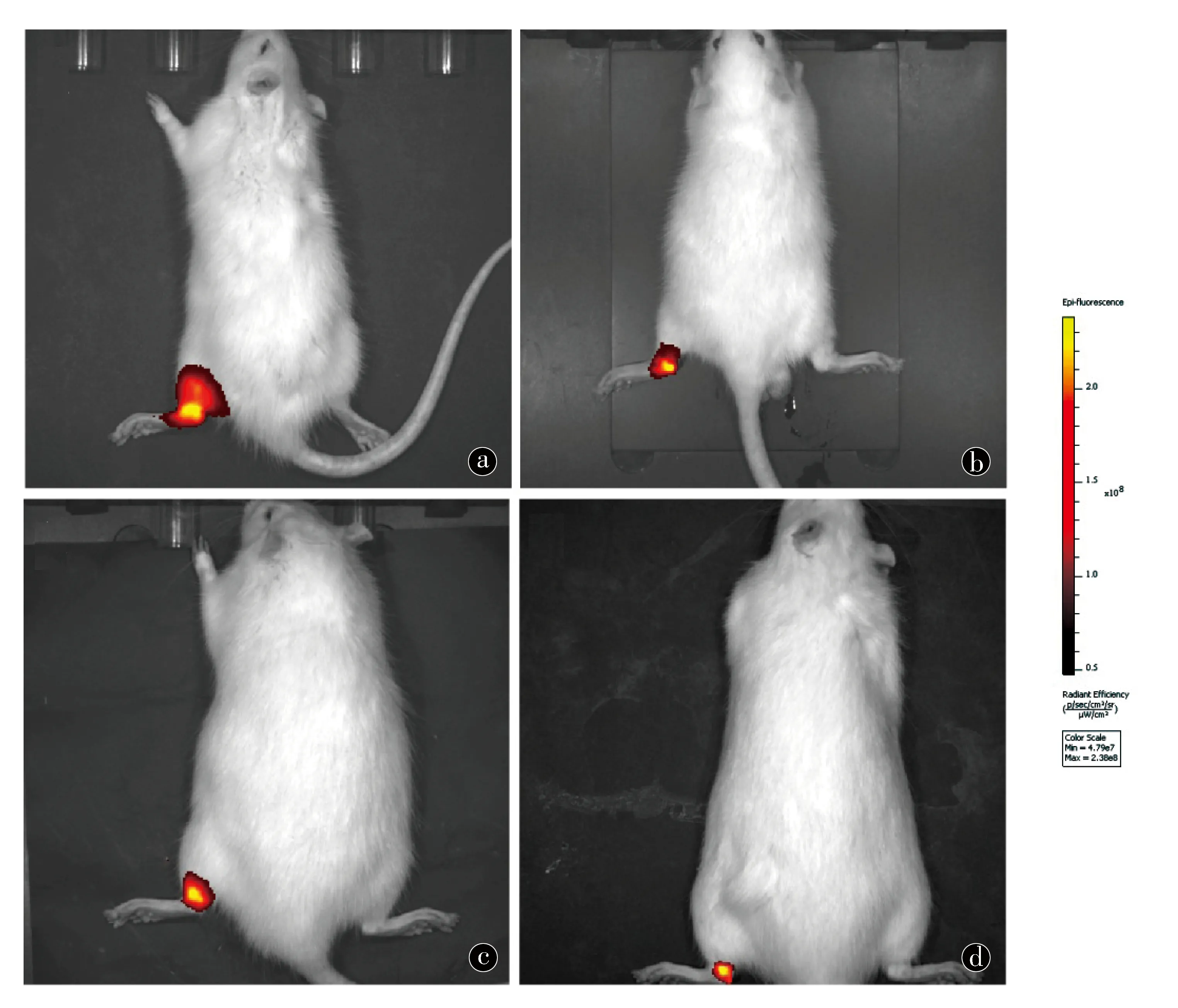
图5 C/GP/Co水凝胶混合IR-780碘化物标记的TSCs在大鼠体内活体成像观察。a.注射后1d;b.注射后7d:c.注射后14d:d.注射后28d
6 激光共聚焦显微镜观察
大鼠跟腱组织荧光染色激光共聚焦显微镜下观察,可见IR-780碘化物标记TSCs的荧光信号呈红色,分布在细胞胞浆,DAPI染细胞核,荧光信号呈蓝色。IR-780碘化物标记TSCs的荧光信号在注射后1d时最强,注射后7、14及28d,随着时间延长,荧光信号呈逐渐减弱趋势,但注射后28d仍可检测到明显荧光信号。见图6。
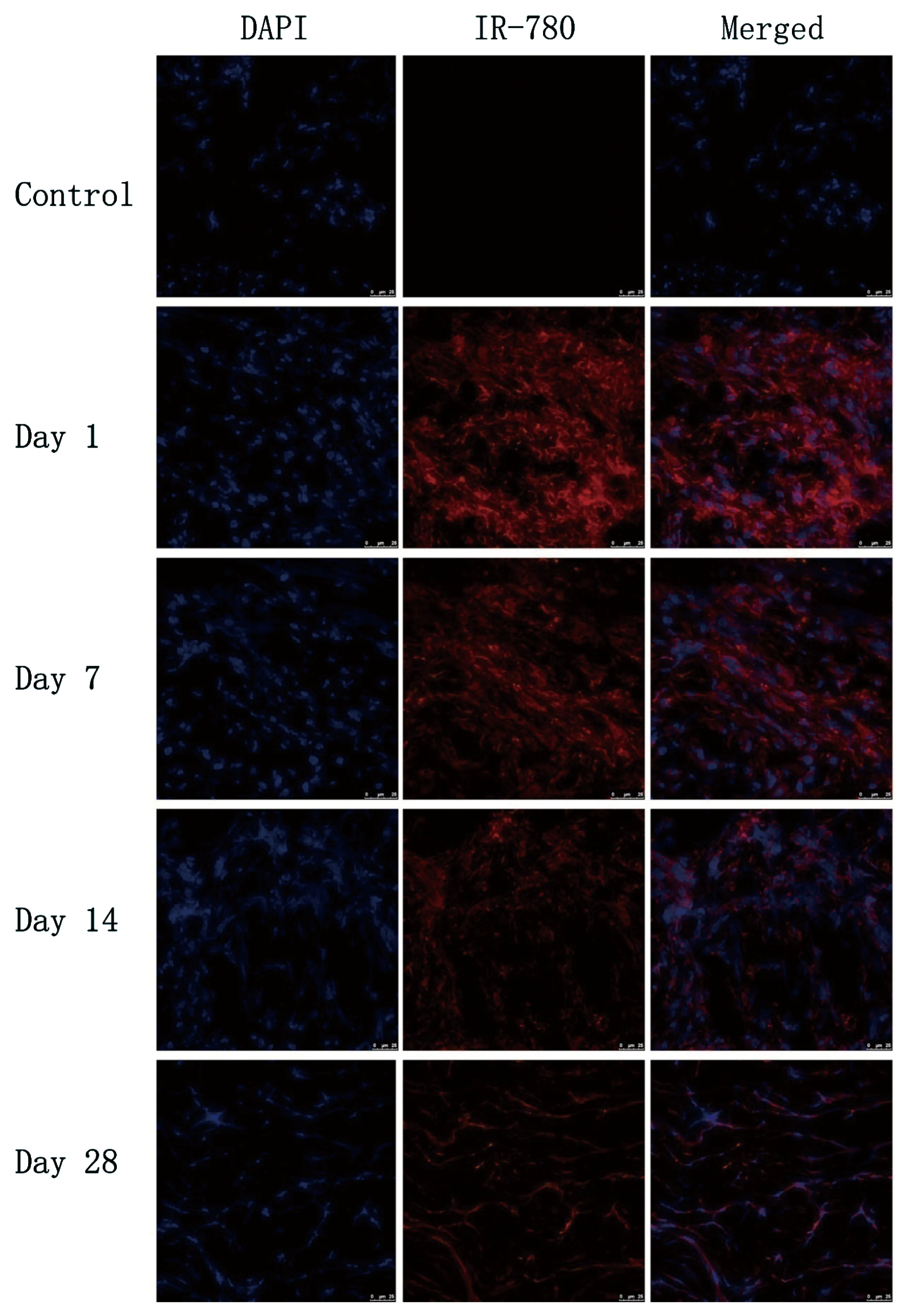
图6 C/GP/Co水凝胶混合IR-780碘化物标记的TSCs注射至大鼠体内后激光共聚焦显微镜观察。DAPI染细胞核,荧光信号呈蓝色;IR-780为红色荧光。标尺:5μm。IR-780荧光信号在1d时最强,注射后7、14及28d,荧光信号呈逐渐减弱趋势, 28d时仍可检测到明显红色荧光信号
讨 论
干细胞移植治疗肌腱损伤修复过程中,对移植后的干细胞进行非侵入性的实时观察至关重要。干细胞标记及示踪技术一直是干细胞移植损伤修复研究的难点,通过细胞示踪技术监测干细胞移植后在机体内的存活、分布、增殖及分化情况,是干细胞移植治疗领域关注的热点问题。移植干细胞的示踪及监测,对评估其治疗效果至关重要[11]。干细胞标记及示踪技术目前常用的有荧光蛋白标记示踪法、磁共振对比增强剂标记示踪法、荧光染料标记示踪法、核酸标记技术及同位素标记技术等[2]。
荧光蛋白示踪的原理是通过质粒、腺病毒及慢病毒等载体,将荧光蛋白基因与目的基因整合后在宿主细胞内表达,经激发光照射后发出荧光。常见的有绿色荧光蛋白(greenfluorescent protein,GFP)及红色荧光蛋白(red fluorescentprotein,RFP)等。GFP有很多优点,不需加入底物或酶即可发射稳定的绿色荧光,可在荧光显微镜下观察活细胞情况等。但GFP标记存在实验周期长、费用高的缺点。此外,GFP还存在表达水平在不同动物个体间及同一动物不同细胞间差异很大;移植前GFP高表达,移植后可能出现低表达等[12]。磁共振对比增强剂标记示踪法,其原理是在体外将待移植细胞用MRI增强剂标记后移植至体内,然后利用MRI对细胞进行追踪。目前研究较多的是磁共振示踪剂是超顺磁性氧化铁(SPIO),但其细胞标记率较低,且MRI检测不能反映干细胞的存活状态和微环境的变化[13]。
NIR荧光成像技术具有较强的组织穿透能力,NIR在其光谱范围内能在机体及组织自发荧光,对组织细胞的低毒性及高敏感性等特点,且可以实时、无创、体外连续监测,检测灵敏度高、操作较容易,并能进行非侵入式的实时深层组织成像,在干细胞标记示踪中展现出巨大的应用潜力[14-15]。
七甲川花菁染料作为一类经典的近红外荧光探针,当前已广泛应用于生物医学成像研究。IR-780碘化物是七甲川菁染料中的一种新型近红外荧光小分子,在干细胞标记、移植后动物活体成像及组织学检查中均有明显优势。Zhang等[9]用近红外荧光染料IR-780碘化物对大鼠来源皮肤干细胞等进行标记,研究结果表明:IR-780碘化物能简单、有效地标记干细胞,且对干细胞的增殖、分化影响较小,此外部分来自标记细胞的泄漏染料可以被血液循环系统清除掉,对干细胞周围未标记的细胞影响不明显。
本实验研究结果表明,IR-780碘化物可有效标记TSCs,灵敏度高、特异性强、操作简单、方便价廉,对细胞或机体影响小。IR-780碘化物标记TSCs后定位于细胞的线粒体内,对细胞周期及细胞增殖能力无明显影响。IR-780碘化物标记的TSCs在活体成像系统可实现长时间示踪及观察,且可在激光共聚焦显微镜下行组织学观察。
笔者的研究结果证实:IR-780碘化物可有效标记TSCs并用于实时示踪,C/GP/Co水凝胶包裹IR-780碘化物标记的TSCs注射至大鼠跟腱损伤部位后,TSCs在肌腱损伤部位存活良好,IR-780碘化物标记TSCs的荧光信号在注射后1d时最强,注射后7、14及28d,随着时间延长,荧光信号呈逐渐减弱趋势,但注射28d后活体成像及激光共聚焦显微镜观察仍可检测到明显荧光信号,且大鼠身体其他部位从注射后1~28d均无显著IR-780碘化物荧光信号。TSCs通过C/GP/Co水凝胶包裹注射至大鼠跟腱损伤部位,可长时间存活并驻留于损伤部位发挥治疗效应。C/GP/Co水凝胶包裹TSCs可用于进一步的动物跟腱损伤体内实验研究。
