卵形鲳鲹 SST1基因的克隆与组织表达
2021-10-24冯鹏霏潘传燕余艳玲杜雪松张永德罗洪林
黄 姻,冯鹏霏,潘传燕,余艳玲,武 霞,杜雪松,张永德,罗洪林
(1.广西壮族自治区水产科学研究院 广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西师范大学 生命科学学院,广西桂林 541006)
生长激素(Growth hormone,GH)是脊椎动物主要的生长调节因子,受多种激素的调控,通过其受体GHR作用于靶组织,或通过刺激肝脏产生胰岛素样生长因子(Insulin like growth factor,IGF)间接发挥作用[1]。在控制GH释放的众多激素中,生长抑素(Somatostatin,SS)是最直接有效的抑制剂[2]。SS是一个多肽激素家族,不仅可以直接抑制GH和IGF-1的合成与分泌,还可以通过降低对GH与IGF-1结合的敏感性,并以垂体外的方式影响GH-IGF-1系统[3-4],在动物的生长、发育和代谢等许多方面发挥重要的作用[5-6]。SS主要通过与靶细胞表面的特异性受体(Somatostatin receptor,SST)结合而发挥抑制GH分泌的作用[7]。SST是一种跨膜受体,属于G蛋白偶联受体(G-protein-coupled receptors,GPCRs)超家族,在动物体内已经发现7个SST(SST1~SST7),但目前在硬骨鱼中尚未鉴定到SST4[8-9]。SST分布在机体多个系统和组织器官中,包括中枢神经系统、肠道、垂体、肾脏、甲状腺、肺、免疫细胞和各种癌细胞[10-11]。每个SST都具有亚型选择性、组织特异性和种属特异性的分布模式,参与细胞内不同信号传导的激活过程。研究表明,SST1可影响体质量并导致生长迟缓[12],还可以影响形态性状的发育,包括体长、体高和胸围等[13]。
卵形鲳鲹(Trachinotusovatus)是中国名贵的海水养殖鱼类,也是适合中国近、远海集约化养殖的重要品种之一,它具有生长快、适应性强等优良的生物学特性,其人工养殖近年来在中国南部沿海地区得到迅速发展[14],已成为中国农业部推荐的9种海水养殖品种之一。然而,由于育种工作的滞后,导致卵形鲳鲹出现明显的种质退化现象,种群遗传多样性面临较高的丢失风险[15],因此,开展卵形鲳鲹生长发育相关功能基因的研究,对促进卵形鲳鲹种质资源的开发利用及其产业的健康持续发展意义重大。SST1基因的表达与动物生长发育和形体性状显著相关,可作为研究生长相关的候选基因之一。本研究克隆卵形鲳鲹的SST1基因,并对其所表达的受体蛋白进行生物信息学分析,预测其可能的生物学功能,采用荧光定量PCR的方法对SST1基因在卵形鲳鲹不同胚胎发育时期及其幼鱼不同组织中的分布和表达进行定量分析,旨在为进一步研究卵形鲳鲹SST1及SS基因在其生长发育过程中的作用奠定基础。
1 材料与方法
1.1 材 料
卵形鲳鲹取自深圳市南澳镇大鹏湾海域人工养殖群体,对卵形鲳鲹进行人工繁育[16],采集其胚胎发育的受精卵期、4细胞期、16细胞期、多细胞期、高囊胚期、原肠早期、原肠中期、原肠末期、胚体形成期、眼囊期、耳囊期、心脏跳动期、晶体出现期、初孵仔期共14个不同时期组织样品各50~100 mg,每个时期3个生物学重复。另取雌雄各3尾,体质量为523~586 g的卵形鲳鲹幼鱼,经MS222麻醉致死后,分别剖取其背鳍、皮肤、肌肉、眼睛、腮、脑、心脏、肝脏、脾脏、头肾、精巢、卵巢、胃、肠共14个组织样品各50~100 mg,每个组织雌雄各3个生物学重复。样品经液氮速冻后转入-80 ℃超低温冰箱保存,用于SST1组织表达研究。
1.2 方 法
1.2.1SST1基因的生物信息学分析 登录BioProjec(https://www.ncbi.nlm.nih.gov/bioproject),从卵形鲳鲹的基因组(登录号:PRJNA574895)中找到SST1基因序列(ID:EVM0001630),利用NCBI BLAST对卵形鲳鲹与其他物种的SST1基因序列(表1)进行同源比对分析,下载与卵形鲳鲹相近的18种鱼类的SST1基因序列,采用Mega X软件对卵形鲳鲹与这18种近缘鱼类的SST1基因序列进行多重比对,计算遗传距离,采用Poisson模型,对空位采用完全删除(Complete deletion),并用“bootstrap”1 000次自举检测各分支的置信度,构建NJ系统进化树,采用Evolview 3.0对进化树进行美化。
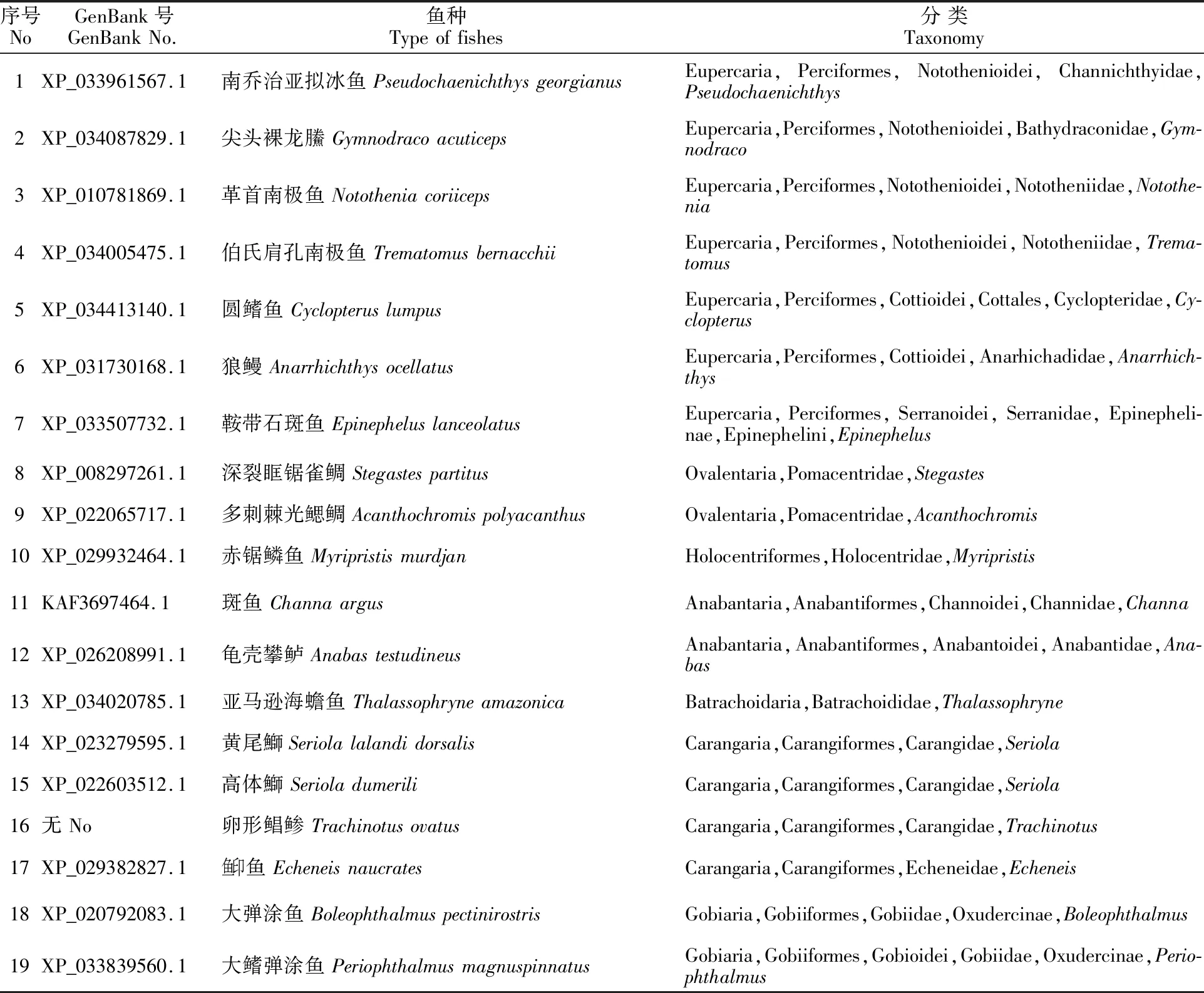
表1 19种鱼类的 SST1基因信息Table 1 SST1 gene information of 19 fish species
参考有关文献中的相关方法[17-18],利用NCBI的ORF finder对卵形鲳鲹的SST1基因序列进行开放阅读框及其所编码的氨基酸序列进行预测分析;采用Protparam分析基因所表达SST1蛋白的理化特性;DNASTAR 7.1分析SST1蛋白的亲水性、抗原指数,NetSurfP预测蛋白的二级结构,Phyre2同源构建其三维结构模型,并用SAVES 5.0软件对构建的模型进行评估;TMHMM分析其跨膜结构;采用SignalP分析其信号肽,采用NetPhos 2.0分析其磷酸化位点,PSORT预测其亚细胞定位。在线分析软件的分析内容与网址信息见表2。

表2 SST1基因在线分析软件信息Table 2 Information of online analysis software for SST1 gene
1.2.2 总RNA提取及反转录 按照RNA提取试剂盒[天根生物科技(北京)有限公司]的操作说明,分别提取卵形鲳鲹14个胚胎发育时期组织样品和幼鱼14个脏器组织样品的总RNA,采用NanoDrop One检测RNA质量浓度,通过20 g/L 琼脂糖凝胶电泳检测其完整度。再根据Hiscript Ⅲ反转录试剂盒操作说明进行反转录,合成 cDNA第一链。
1.2.3 卵形鲳鲹SST1基因的表达分析 以18S rRNA为内参基因[19],根据卵形鲳鲹SST1基因序列设计荧光定量PCR引物(SST1-F:5′-GGTCCCTGATGTGTCGGTTGG-3′;SST1-R:5′-ACAGTGGGTCTGCGGTAGCG-3′),以卵形鲳鲹14个不同胚胎发育时期和幼鱼14个组织的cDNA为模板进行荧光定量PCR扩增。反应体系为15 μL,其中7.5 μL的ChamQ SYBR qPCR Mix,上下游引物(10 μmol/L)各0.3 μL,cDNA模板1.2 μL,5.7 μL的ddH2O,每个样品3个重复。SST1基因的表达量采用相对Ct法(2-△△Ct)进行统计分析。
1.2.4 统计分析SST1基因在卵形鲳鲹14个不同胚胎发育时期和幼鱼14个组织中的表达量结果用 “平均值±标准差”来表示,运用统计学软件IBM SPSS Statistics 19.0对结果进行相对独立的单因素方差分析(ANOVA),利用Duncan’s多重比较分析各组织间的差异显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 SST1基因的生物学信息
2.1.1SST1同源性及进化分析 将卵形鲳鲹SST1基因的氨基酸序列与同科近缘鱼类黄尾鰤(XM_023423827)和高体鰤(XM_022747791.1)进行序列比对,序列相似度为92.38%和 91.87%,确定该序列为卵形鲳鲹的SST1基因序列。利用卵形鲳鲹SST1基因与其他18种鱼类的SST1基因比对分析,构建ML系统进化树(图1)。所分析的鱼类主要聚成3支,其中一支为鲈形目(Perciformes)鱼类,包括南极鱼亚目(Notothenioidei)、杜父鱼亚目(Cottioidei)、鮨亚目(Serranoidei)鱼类;第二支主要由雀鲷科(Pomacentridae)、金鳞鱼科(Holocentridae)、攀鲈目(Anabantiformes)、蟾鱼科(Batrachoididae)等鱼类聚合而成;第三支主要由鲹形目(Carangiformes)、虾虎鱼目(Gobiiformes)等鱼类聚合而成。其中卵形鲳鲹、黄尾鰤与高体鰤均属于鲹科(Carangidae)鱼类,具有较近的遗传距离,而鱼印鱼(Echeneis naucrates)为鱼印科(Echeneidae)鱼类,遗传距离则稍远。
2.1.2SST1基因的序列基本结构及编码蛋白的理化性质分析 卵形鲳鲹SST1基因的cDNA序列长度为1 155 bp(图2),序列中A、C、G、T含量分别为20.78%(240个)、26.58%(307个)、25.89%(299个)和26.75%(309个),GC含量(52.48%)高于AT含量(47.53%),说明编码区的DNA双链较为稳定。卵形鲳鲹SST1基因序列的开放阅读框为1 104 bp,编码368个氨基酸,其包含7 TM_GPCR_Srx结构域。所编码的蛋白分子质量为41.42 ku,理论等电点为8.47,为碱性蛋白。带负电荷的残基总数(Asp + Glu)为26,带正电荷的残基总数(Arg + Lys)为31,说明SST1所编码的蛋白为带正电的蛋白。蛋白不稳定性指数(Ⅱ)为39.82,说明该蛋白为较稳定的蛋白。
卵形鲳鲹SST1基因编码的蛋白平均亲水系数(GRAVY)为0.539,说明该蛋白为疏水性蛋白。序列中含有较多的疏水性氨基酸,疏水性区段主要集中于34~63、70~95、103~134、152~175、195~226、246~271、279~289、311~318位氨基酸(图3)。疏水性氨基酸中色氨酸Trp、苯丙氨酸Phe、缬氨酸Val、亮氨酸Leu、异亮氨酸Ile、丙氨酸Ala和甲硫氨酸Met分别占编码氨基酸的1.90%、5.71%、11.14%、10.60%、6.79%、8.15%和3.50%。跨膜区分析结果(图4)显示,SST1蛋白存在7个跨膜结构域,跨膜结构域的位置为36~58、71~93、108~130、151~173、198~220、247~269、279~301。
2.1.3SST1基因编码蛋白的抗原性及亚细胞定位分析 采用Protean中的Jameson-Wolf方法预测卵形鲳鲹SST1蛋白的抗原指数,了解其可能的抗原表位位点。由图5可看出,其抗原指数较高的区段为第22~35、64~68、141~150、176~185、234~245、272~278、301~310、318~328、333~339、341~351、354~362位氨基酸。SST1蛋白全长序列中潜在的抗原表位相对不是很丰富,且相对较集中在序列的尾端。对SST1亚细胞定位进行预测分析,发现其主要定位于细胞质膜,推测其在细胞膜发挥作用。
2.1.4SST1基因编码蛋白的信号肽及磷酸化位点分析 采用Signal P对SST1蛋白进行预测分析,未发现信号肽位点(图6)。磷酸化位点预测结果(图7)显示,丝氨酸磷酸化位点有4个,主要位于240、308、320、341位点;苏氨酸磷酸化位点5个,主要位于149、339、362、366、367位点;酪氨酸磷酸化位点8个,主要位于9、24、27、28、58、133、329、361位点。这17个磷酸化位点的可信度均为0.70以上,说明其可信度较高。
2.1.5 SST1蛋白结构预测 采用NetSurfP对SST1蛋白的二级结构进行在线预测,结果如图8所示,SST1蛋白二级结构主要包含α-螺旋(Alpha helix)、延伸链(Extended strand)及无规则卷曲(Random coil)3 种类型,其中α-螺旋氨基酸有150个,占总数的40.76%、延伸链氨基酸60个,占总数的16.13%、无规则卷曲氨基酸149个,占总数的40.49%。
利用Phyre 2对SST1蛋白进行三级结构预测,构建SST1三维结构模型,同源建模的模板序列与SST1序列的一致度为43%,模型的可信度为100%。SST1蛋白三维结构(图9-a)显示,其主体结构为由7段α-螺旋并列扭曲排列成一柱状结构,该结构也是跨膜区的主要结构,柱状结构的一端连接一个由4个α-螺旋排列成的小短柱状结构,位于胞外(图9-b)。采用SAVES在线程序对构建的SST1蛋白模型进行评估,结果显示,77.70%的残基平均3D-1D得分≥ 0.2,ERRAT质量评分为100,Procheck 9项评估中,通过4项,警告5项,无错误项,说明构建的模型可靠性较高。
2.2 SST1基因在卵形鲳鲹不同胚胎发育时期的表达分析
SST1基因在卵形鲳鲹胚胎发育的14个关键时期均有表达,结果见图10。由图可知,从受精卵期到晶体出现期SST1基因都是低表达;进入初孵仔期SST1基因表达量开始急剧增加,极显著高于此前的各个胚胎发育时期(P<0.01)。
2.3 SST1基因在卵形鲳鲹幼鱼不同组织中的表达分析
对卵形鲳鲹幼鱼的14个组织进行SST1表达量检测,结果见图11,SST1基因在卵形鲳鲹脑组织中呈现高度的表达,其表达量极显著高于其他13个组织(P<0.01),其次是在卵巢中也呈现高度的表达,其表达量极显著高于另外12个组织(P<0.01),在精巢中的表达量低于卵巢,但显著高于皮肤组织(P<0.05),极显著高于其他10个组织(P<0.01),皮肤组织的表达量相对较低,但显著高于其他10个组织(P<0.05)。肌肉、心、肝等10个组织的表达量极低,其组间差异不显著(P>0.05)。
3 讨 论
SST1作为SS其中的一个特异性受体,介导了SS在动物生长发育过程中所发挥的负调控作用[20]。目前,SST1基因在赤点石斑鱼(Epinephelusakaara)[21]、斜带石斑鱼(Epinepheluscoioides)[22]、线翎电鳗(Apteronotusalbifrons)[23]、虹鳟(Oncorhynchusmykiss)[24]等鱼类中已被鉴定或克隆。本研究结果表明,卵形鲳鲹SST1基因开放阅读框1104 bp,编码368个氨基酸,与赤点石斑鱼[21]384个氨基酸大小接近,蛋白分子质量为41.42 ku,带正电荷,理论等电点为8.47,属于碱性蛋白,且蛋白较稳定。亚细胞定位与跨膜结构分析结果显示,蛋白主要定位于细胞质膜,存在7个跨膜结构,三级结构显示,其主体结构是由7段α-螺旋并列扭曲排列成一柱状结构,位于跨膜区,这与SST1属于GPCRs超家族,而GPCRs由7个跨膜受体结构域组成结果一致[25]。
磷酸化是蛋白质翻译后修饰(Protein post-translational modifcation,PTM)中最常见的类型,在真核生物的几乎所有细胞过程中都发挥重要的作用[26]。蛋白的磷酸化是在蛋白质上引入带负电的磷酸基团,导致蛋白质构象和功能活性发生变化,大多数磷酸化发生在蛋白质的丝氨酸残基上,苏氨酸和酪氨酸残基的磷酸化作用不如丝氨酸残基的磷酸化[27]。蛋白的磷酸化调节细胞的多种生物过程,如基因表达、代谢、细胞周期调节、分化和凋亡等[28-29]。据估计,大约30%的人类蛋白质在其生命周期的某个时刻被磷酸化[28]。本研究发现,卵形鲳鲹SST1蛋白具有17个磷酸化位点,其中丝氨酸磷酸化位点有4个,主要位于蛋白的第3细胞内环和C-端,定位于细胞内。苏氨酸磷酸化位点有5个,主要位于蛋白的第2细胞内环和C-端,定位于细胞内;酪氨酸磷酸化位点有8个,主要位于蛋白的N-端、第1、2细胞内环和C-端,定位于细胞外和细胞内,而对于SST来说,第3细胞内环和C-端潜在磷酸化位点对磷酸化、内化和脱敏非常重要[30-31]。预测结果显示,卵形鲳鲹SST1蛋白存在较多的磷酸化位点,推测该蛋白存在磷酸化现象,但需通过质谱分析等方法进一步研究。
系统发育树为研究物种起源及其分子进化,进而探索基因功能提供了依据。系统发育分析表明SST家族可聚为2个大分支和7个主要分支,其中一个大分支包含SST2、3、5和7,另一个包含SST1、4和6,SST1和SST4彼此密切相关,SST6型存在于许多鱼类中,但在四足动物和鸟类中不存在[9],而在人类、其他四足动物和鸟类中存在的SST4型似乎在所有被调查的硬骨鱼类基因组中都缺失[32-33]。本研究对卵形鲳鲹与其他18种鱼类SST1基因的系统发育分析表明,系统发育树有3个主要分支,其中一支由鲈形目(Perciformes)7种鱼类组成,第二支主要由雀鲷科(Pomacentridae)、金鳞鱼科(Holocentridae)、攀鲈目(Anabantiformes)与蟾鱼科(Batrachoididae)等6种鱼类聚合而成;第三支主要由鲹形目(Carangiformes)、虾虎鱼目(Gobiiformes)等6种鱼类聚合而成,其中卵形鲳鲹、黄尾鰤与高体鰤均属于鲹科(Carangidae)鱼类,显示了较近的遗传距离。SST1基因的系统发育树代表了这些物种SST1基因的进化关系,但与这些物种的系统分类学存在较高的一致性。
SS与SST广泛存在于鱼类发育的不同时期以及各个组织中。SST的表达直接影响着SS对GH分泌的双向调节作用[34]。本研究发现SST1在卵形鲳鲹的初孵仔期之前的受精卵期、4细胞期、16细胞期、多细胞期、高囊胚期、原肠早期、原肠中期、原肠末期、胚体形成期、眼囊期、耳囊期、心脏跳动期和晶体出现期这13个胚胎发育时期都是微量的低表达,直到初孵仔期表达量迅速升高。这一结果与生长抑素前体(PreprosomatostatinⅠ,PPSⅠ)的mRNA在大西洋鳕鱼(Gadus morhua)胚胎发育过程中的表达量变化趋势一致[35]。说明SS高表达能抑制GH的分泌,低表达却能促进GH的分泌促进细胞增殖和分化,而SS与SST基因的表达受胚胎发育过程以及动物的营养状况有关。
虽然SST的基因分布存在重叠现象,但却具有明显的表达模式特异性,SST作用机制存在组织特异性应答[36]。本研究通过荧光定量PCR分析发现,SST1在卵形鲳鲹不同组织中的表达量差异极显著,其中在脑部组织中显著高度表达,其次是卵巢和精巢,而在其他10个组织中的表达量则较低。Slagter等[24]对虹鳟(Oncorhynchus mykiss)的研究发现,SST1在脑、胃、胰腺和肾脏中高表达,而Zhang等[21]发现赤点石斑鱼SST1在20个组织中广泛表达,并且在每个组织中的表达水平非常相似。上述研究说明SST1可能介导了卵形鲳鲹的多种生理功能,其表达分布可能存在组织特异性和种属特异性,不同种属的SST1基因表达模式的差异,表明其在调节不同的生理过程中可能存在功能差异。
大脑和垂体表达多种神经肽,如GH、促性腺激素释放激素(GnRH)、卵泡刺激素(FSH)、黄体生成激素(LH)、催乳素(PRL)和睾酮(testosterone,Ts)等[37],它们共同调控动物的生长和繁殖,并且SST也参与了这些过程[4,38]。本研究结果显示卵形鲳鲹脑部SST1高表达,说明SST1可能参与了神经内分泌活动。卵巢中SST1的高表达表明它可能参与生殖激素的调节,在雌性性腺发育中发挥重要作用。
4 结 论
总之,SST1在卵形鲳鲹发育的不同时期和不同组织中均有表达,其中,在初孵仔期呈现高表达以抑制GH的分泌,在其他时期则呈现低表达,更有利于GH分泌促进细胞的增殖分化与机体发育;在脑组织中表达量最高,其次是卵巢和精巢,表明SST1可能在神经内分泌、雌性性腺发育及精子发生过程中都发挥着重要作用。
