牡蛎酶解超滤组分对TM4小鼠睾丸支持细胞的氧化损伤保护作用
2021-10-23张雪妍秦小明林海生曹文红郑惠娜高加龙章超桦
张雪妍,秦小明, 2,林海生, 2,曹文红, 2,郑惠娜, 2,高加龙, 2,章超桦, 2
(1. 广东海洋大学食品科技学院,广东 湛江 524088; 2. 广东省水产品加工与安全重点实验室/广东普通高等学校水产品深加工重点实验室/国家贝类加工技术研发分中心 (湛江) /南海生物资源开发与利用协同创新中心,广东 湛江 524088)
近年来男性不育症的发病率呈逐年升高趋势,调查显示全球8%~12%育龄夫妇患有不育症[1],其中归因于男性伴侣的占近50%[2]。生殖系统疾病[3]、环境污染[4-5]、内分泌失调[6]和药物[7]引起的生殖损伤均可导致男性不育。睾丸的生殖激素改变[6]、细胞凋亡[8]、氧化损伤[9]和组织结构异常可能是男性生殖功能障碍的机制。睾丸支持细胞作为睾丸生精的“营养细胞”,为生殖细胞发育、存活和成熟提供微环境,其所形成的血睾屏障可有效保护生殖细胞免受有毒物质的破坏。因此,体外研究睾丸支持细胞对物质的敏感性可能是间接衡量这些物质在精子形成中发挥作用的有效途径。雷公藤 (Tripterygium wilfordii Hook. f.) 中药制剂在临床上长期用于治疗炎症及免疫系统疾病,而雷公藤甲素 (TP,C20H24O6) 作为雷公藤的药理和毒性作用的主要有效成分[10],其副作用中发生率最高的是生殖毒性[11]。TP摄入过多会导致睾丸萎缩、激素合成代谢紊乱及精子活力下降等[11-12]。研究表明,TP可降低TM4小鼠睾丸支持细胞存活率、增加细胞活性氧 (ROS)蓄积并诱导细胞凋亡途径的激活[13]。因此,TP的生殖毒性极大限制了其临床应用。
香港牡蛎 (Crassostrea hongkongensis),俗称生蚝,因其肉质鲜美,富含蛋白质、糖原、氨基酸、脂肪酸和无机盐等[14],被冠以“海洋牛奶”的美称[15]。牡蛎已被我国卫生部批准为药食两用材料[16]。牡蛎肉提取物具有抗氧化[17]、增强机体免疫[18]、抗疲劳[19]、抗皮肤光老化[20]、降血压[21]、降血糖[22]、醒酒护肝[23]和生殖保健[24]等多种生物活性。研究表明,小分子牡蛎多肽可提高小鼠血清性激素水平及其精子质量[25]。Li等[26]发现近江牡蛎 (Ostrea rivularis) 多糖可抑制过氧化氢 (H2O2) 诱导的TM4细胞氧化应激水平,改善环磷酰胺所致小鼠睾丸组织损伤,提高精子存活率并减少精子畸形。可见牡蛎肉提取物具有改善雄性生殖功能的潜能,但其有效成分、作用机理尚不明确。本研究以香港牡蛎为原料,以TM4小鼠 (Mus musculus) 睾丸支持细胞株为研究对象,探究牡蛎酶解超滤组分对TP诱导的TM4小鼠睾丸支持细胞氧化损伤的保护作用,在细胞水平上探讨牡蛎酶解超滤组分对TP抗生育作用的减毒效果,以期为研发以牡蛎为原料的改善男性生殖健康的保健功能食品提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜香港牡蛎购于湛江海鲜批发市场,动物蛋白酶 (酶活力 3×104U·g−1) 购于广西南宁庞博生物有限公司,DMED/F12培养基购自Gibco公司,马血清、青/链霉素双抗购自HyClone公司,噻唑兰(MTT) 购自 Genview 公司,TP (纯度>98%) 购自美伦生物技术有限公司,还原型谷胱甘肽 (GSH) 测定试剂盒和丙二醇 (MDA) 测定试剂盒购自南京建成生物工程研究所,ROS检测试剂盒和BCA蛋白浓度测定试剂盒均购自碧云天生物研究所,小鼠睾丸支持细胞株 (TM4) 购于广州赛库生物技术有限公司。
1.2 仪器与设备
XX42PMINI超滤装置 (美国 Milipore 公司);Lynx6000高速落地离心机 (美国Thermo公司);R-1005旋转蒸发仪 (郑州长城科工贸有限公司);1200型半制备高效液相色谱仪 (美国Agilent公司);7500cx电感耦合等离子体质谱 (ICP-MS,美国Agilent公司);HHT4-LX-C50L型立式压力蒸汽灭菌器 (北京中西远大科技有限公司);CKX41型倒置显微镜 (日本Olympus公司);SW-CJ-2FD型超净工作台 (苏州净化有限公司);Forma 370型二氧化碳 (CO2) 恒温箱 Multiskan FC型酶标仪 (美国Thermo公司);5810R型高速台式冷冻离心机 (德国 Eppendorf公司)。
1.3 实验方法
1.3.1 牡蛎酶解产物超滤组分的制备 取新鲜牡蛎肉,经洗净、沥干,然后按料水质量体积比1∶3 (g·mL−1) 加入预冷的蒸馏水,高速匀浆,按照酶活和底物 1 000∶1 (U·g−1) 的比例加入动物蛋白酶[27],酶解液沸水浴灭活10 min,冷却至室温,最后以 12 000 r·min−1离心 20 min 取上清液,并对其进行超滤分级,利用超滤装置及3、5、10 ku超滤膜对酶解液进行分级处理,进口压力控制在60 psi,得到<3、3~5、5~10和>10 ku 4个超滤组分,收集各个组分,冷冻干燥备用。
1.3.2 牡蛎酶解产物超滤组分的分子量分布测定 参考Li等[28]的测定方法,通过高效凝胶过滤色谱法测定牡蛎酶解超滤组分的分子量分布。使用蛋白分析色谱柱 Waters Protein-pak 60A (WAT085250),流动相浓度为 0.05 mol·L−1、pH 8.3的 Tris-HCl缓冲液。将洗脱速度控制在 0.7 mL·min−1,设置柱温 25 ℃;检测波长 214 nm,每次进样 20 μL。
1.3.3 牡蛎酶解产物超滤组分的微量金属元素测定 铜 (Cu)、锌 (Zn)、锰 (Mn)、硒 (Se) 微量金属元素按照GB/T 5009.268—2016,采用微波消解-电感耦合等离子体质谱法进行测定。
1.3.4 TM4细胞的培养 TM4细胞在 D-MEM/F-12培养基 (体积分数92.5%) 中培养,该培养基补充有体积分数5%马血清和体积分数2.5%优质胎牛血清,37 ℃细胞培养箱中培养 [体积分数5%CO2,湿度95%]。当细胞融合至80%~90%时,用胰酶消化,按照1∶3的比例进行传代培养,选择对数生长期的细胞进行实验。
1.3.5 牡蛎酶解超滤组分对 TM4细胞生长的影响 将 TM4细胞浓度稀释至 1×104个·mL−1[29],按每孔200 μL接种至96孔板,待细胞生长到融合状态,小心吸出培养基,每孔加入20 μL含不同质量浓度 (0、50、100、250、500、1 000 μg·mL−1) 的牡蛎酶解超滤组分 (<3、3~5、5~10和>10 ku),每组设置6个平行,并分别培养12和24 h。培养结束后,用磷酸缓冲液 PBS配置 5 g·L−1噻唑蓝(MTT) 溶液,每孔加入 20 μL MTT 溶液,并将培养板温育4 h。小心吸走上清液,向每孔中加入100 μL DMSO,然后摇动 10 min。用酶标仪测量上清液的吸光度值 (测定波长570 nm)。以不加牡蛎酶解超滤组分为空白对照组,按式 (1) 计算细胞存活率 (%)。

式中:R为细胞存活率;A0为空白对照组上清液的吸光度;A1为实验组上清液的吸光度。
1.3.6 TP对 TM4细胞生长的影响 同 1.3.5的方法,将牡蛎酶解超滤组分换成不同浓度的TP (0、125、250、500、1 000 nmol·L−1)[13]。以不加 TP为空白对照,按式 (1) 计算细胞存活率。
1.3.7 牡蛎酶解超滤组分对TP诱导TM4细胞毒性的保护作用 将 TM4细胞浓度稀释至 1×104个·mL−1,按每孔 200 μL 接种至 96孔板,待细胞生长至融合状态时,弃掉旧培养基,设置空白对照组(加入同等体积培养液);TP 模型组 (500 nmol·L−1);牡蛎酶解超滤组分+TP实验组 (加入不同质量浓度的牡蛎酶解超滤组分),质量浓度分别为50、100、250、500 μg·mL−1;细胞孵育 6 h/12 h 后小心吸出培养液,除空白对照组外均加入含TP的无血清培养液,TP终浓度为 500 nmol·L−1,于 37 ℃、含5% CO2孵育培养箱中培养24 h,采用MTT法测定吸光度值,计算牡蛎酶解超滤组分对TP所致TM4细胞存活率的变化量,每组设定6个复孔。
1.3.8 牡蛎酶解超滤组分对TP诱导TM4细胞的氧化应激损伤的生化检测 将 TM4细胞浓度稀释至 1.5×104个·mL−1,按每个 5 mL体积接种至60 mm培养皿中,待细胞生长至融合状态时,进行分组。实验组加入不同质量浓度的牡蛎酶解超滤组分,质量浓度分别为 50、100、250 μg·mL−1;空白对照组和TP模型组加入不含样品的培养基,细胞孵育12 h后小心吸出培养液,除空白对照组外均加入含TP的无血清培养液,TP终浓度为500 nmol·L−1,于 37 ℃、含 5% CO2孵育培养箱中培养24 h。细胞经过不同样品和TP处理后,收集细胞进行各指标的测定[30]。分别用试剂盒提供的方法测定细胞内GSH和MDA含量。通过BCA蛋白测定试剂盒确定相应的样品蛋白质含量。
1.3.9 活性氧试剂盒检测 ROS的生成 将<3 ku超滤组分在不同浓度下提前与TM4细胞培养6 h后,TP (500 nmol·L−1) 作用 TM4细胞造模 3 h[29]。细胞培养达到测定时间,按试剂盒说明将DCFHDA工作液采用无血清培养基稀释,使其终浓度为10 μmol·L−1。去除含样品的培养基,每孔加入DCFH-DA 稀释液 500 μL,避光孵育 45 min。采用无血清培养基洗涤细胞5次,2 min∙次−1。细胞采用倒置荧光显微镜拍照并保存,同时采用多功能酶标仪检测细胞荧光值。
1.3.10 数据统计分析 采用 Excel 2016、Origin 2018、SPSS 19.0软件对数据进行分析处理,用LSD多重比较和t检验进行差异显著性分析 (α=0.05)。
2 结果与分析
2.1 牡蛎酶解超滤组分分子量分布
超滤作为一种初步分离手段,具有操作便利、节省材料、保留样品活性等优点。分子量分布测定可有效评价超滤分级的分离效果。>10 ku超滤组分中>10 ku的成分占67.96%,<3 ku超滤组分中<3 ku的小分子物质占57.48%,各个超滤组分中,随着分子量的降低,<3 ku的小分子物质占比不断升高,>10 ku的大分子物质占比不断降低 (表1),表明通过超滤分级将大分子物质和小分子物质进行了有效分离。而在牡蛎酶解产物中,3~5 ku和5~10 ku 2个分子量区间的物质占比较低,因此分离难度较大。
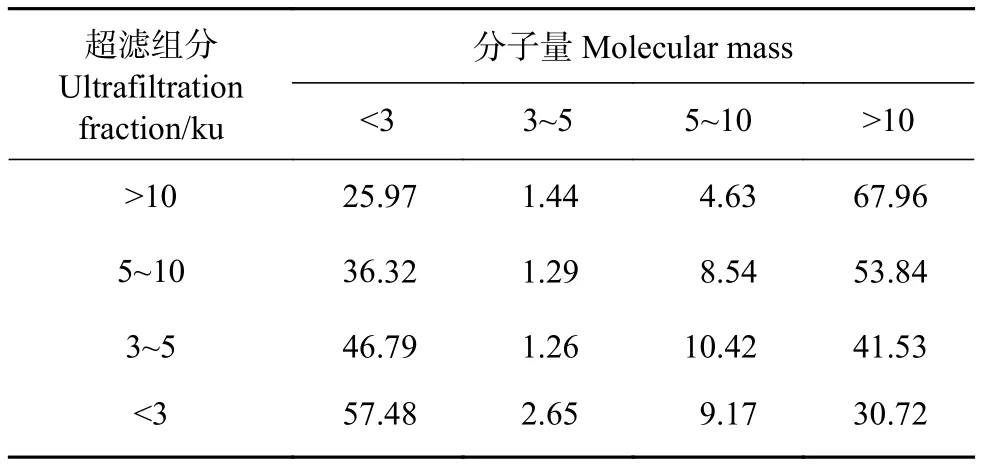
表1 超滤膜分级后不同分子量区间的成分占各超滤组分的比值Table 1 Ratio of different molecular mass ingredients to each ultrafiltration fraction after ultrafiltration membrane classification%
本研究选取的原料、酶解工艺和超滤分级方法均参照笔者课题组前期研究[27],前期研究对牡蛎酶解产物及其超滤组分的基本成分分析发现,牡蛎酶解粉中蛋白质 (41.26%) 和糖类 (50.07%) 为主要组成成分,而经过超滤分级,<3 ku超滤组分的蛋白质比例达72.3%[27],结合分子量分布结果,说明<3 ku超滤组分中的主要成分为小分子肽和游离氨基酸。
2.2 牡蛎酶解产物超滤组分的微量金属元素含量
各个牡蛎酶解超滤组分富含Cu、Zn、Mn、Se等微量金属元素 (表2)。其中,Zn是影响男性生育的重要营养物质,精浆和前列腺中均具有高浓度的Zn。精液中适量的Zn对精子产生与维持精子正常形态、数量、功能均至关重要[31]。此外,睾丸的发育和类固醇生成都离不开Zn的参与,在性腺功能低下、少精症、弱精症和无精子症患者体内常见Zn缺乏。牡蛎中Zn含量高于其他食物,质量分数一般为 61.33~616.98 mg·kg–1[32],而<3、3~5和5~10 ku超滤组分中Zn质量分数分别高达3 019、2 998和 3 128 mg·kg–1。<3、3~5和 5~10 ku超滤组分中Cu、Zn、Mn的质量分数均高于>10 ku超滤组分,说明小分子物质与金属元素的结合效率更高,更易富集金属元素。本研究也发现,牡蛎中的Zn可与牡蛎肉中的蛋白质和氨基酸结合,而牡蛎肉中占比较高的谷氨酸 (Glu)、亮氨酸 (Leu)、精氨酸 (Arg) 和天冬氨酸 (Asp) 表现出很强的金属结合亲和力[33]。
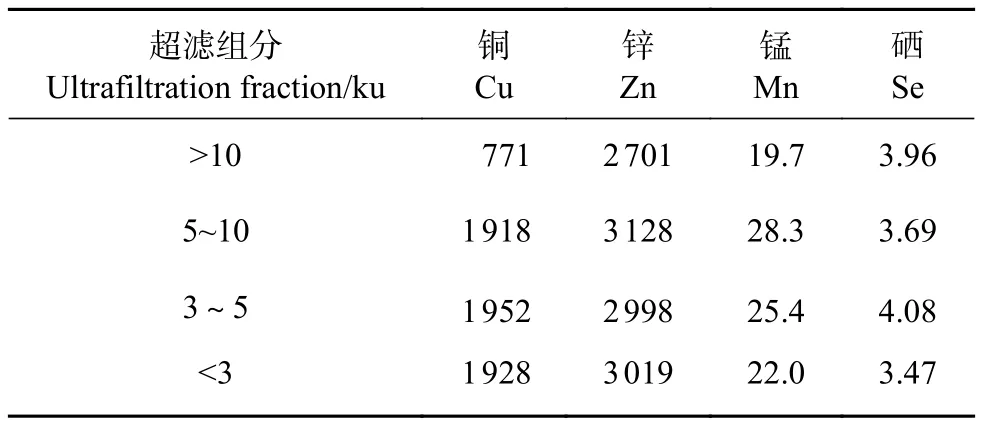
表2 牡蛎超滤组分微量金属元素质量分数Table 2 Mass fractions of trace metal elements in oyster ultrafiltration fractionsmg·kg–1
2.3 牡蛎酶解超滤组分对TM4细胞生长的影响
为确保本研究中牡蛎酶解超滤组分在质量浓度范围内对TM4细胞存活率不存在抑制作用,将细胞与各质量浓度的牡蛎酶解超滤组分 (<3、3~5、5~10和>10 ku) 孵育 12和 24 h,通过 MTT 法测定细胞存活率。结果显示,分别作用12和24 h后,在 1 000 μg·mL−1质量浓度范围内,与空白对照组相比,TM4细胞存活率均有不同程度的增加 (P<0.05,图1),说明各牡蛎酶解超滤组分对TM4细胞均无细胞毒性作用。
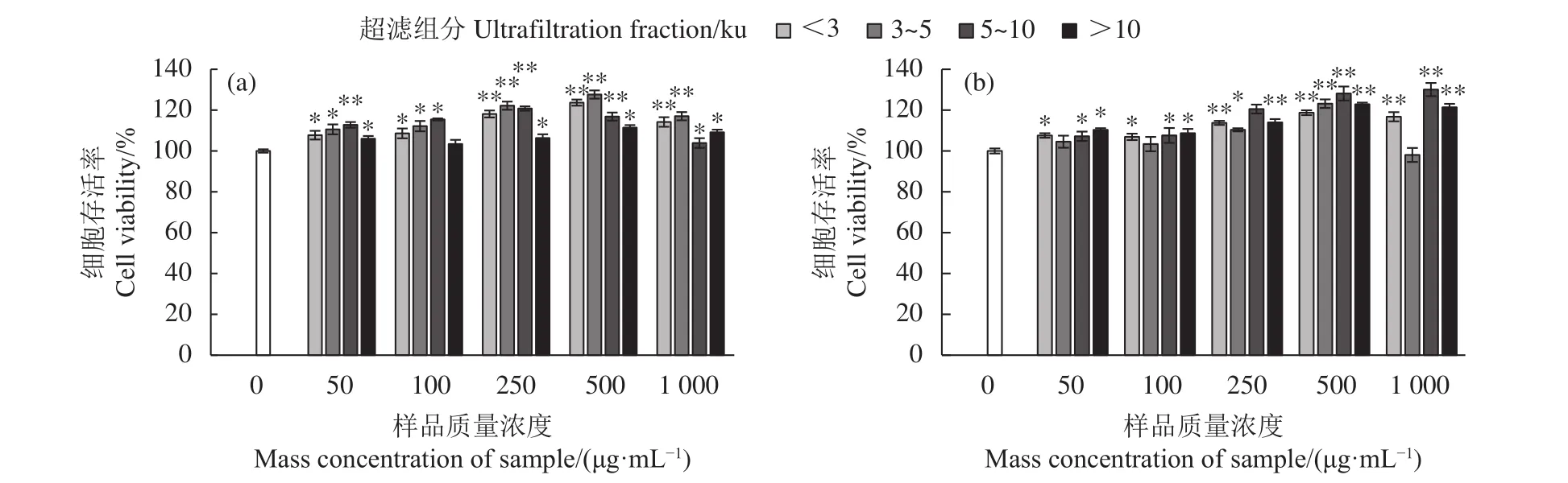
图1 牡蛎酶解超滤组分作用于TM4细胞12 h (a) 和24 h (b) 后的细胞存活率与空白对照组相比,*. 显著差异 (P<0.05);**. 极显著差异 (P<0.01)。Figure 1 Cell viability of oyster hydrolyzed ultrafiltration fractions after treatment on TM4 cells for 12 h (a) and 24 h (b)Compared with the control group, *. Significant difference (P<0.05); **. Very significant difference (P<0.01).
2.4 TP对TM4细胞生长的抑制作用
已有研究表明TP具有较强的生殖毒性作用,而睾丸支持细胞作为维持睾丸微环境、组成血睾屏障的主要功能细胞,对有毒物质和药物十分敏感[13]。用不同浓度 (125、250、500和 1 000 nmol·L−1)TP处理TM4细胞24 h,随着TP浓度增加,TM4细胞存活率呈剂量依赖性降低,与空白对照组相比,各浓度TP对TM4细胞存活率的影响均差异显著 (P<0.05,图2)。Wang等[13]研究也表明,TP以剂量依赖和时间依赖性的方式显著抑制TM4细胞的生长,24 h 的 50% 抑制浓度 (IC50) 为 (669.5±269.45) nmol·L−1。根据本实验结果及前人[13,29-30]的研究方法,选取 500 nmol·L−1为后续造模损伤浓度。

图2 雷公藤甲素对TM4细胞的毒性作用上标不同字母表示具有显著性差异 (P<0.05);图3—图5同此。Figure 2 Cytotoxic effect of TP on TM4 cellsDifferent superscript letters indicate significant difference (P<0.05).The same case in Figure 3−Figure 5.
2.5 牡蛎酶解超滤组分对TP诱导TM4细胞毒性的保护作用
牡蛎酶解超滤组分分别预处理TM4细胞6和12 h,TP (500 nmol·L−1) 作用 TM4细胞 24 h 进行毒性损伤,与TP模型组相比,牡蛎酶解超滤组分各剂量组的细胞存活率均显著提高 (P<0.05,图3),说明各牡蛎酶解超滤组分对TP损伤后TM4细胞的活力均具有保护作用,且呈现较好的剂量依赖性。其中,<3 ku 超滤组分在 250 μg·mL−1质量浓度范围内各个剂量组的细胞存活率均具有显著性差异 (图 3-b);在 250和 500 μg·mL−1作用下,<3、3~5和5~10 ku超滤组分的细胞存活率显著高于>10 ku超滤组分 (P<0.05),且与空白对照组无显著性差异(P>0.05),说明<3、3~5和 5~10 ku 3个超滤组分对TP损伤TM4细胞活力具有很好的保护效果,且效果优于>10 ku超滤组分。研究表明小分子物质更容易被机体利用和吸收,且具有更高的生物利用率和生物活性[34],结合本研究结果,说明小分子物质对TP损伤的TM4细胞活力具有更好的保护效果。
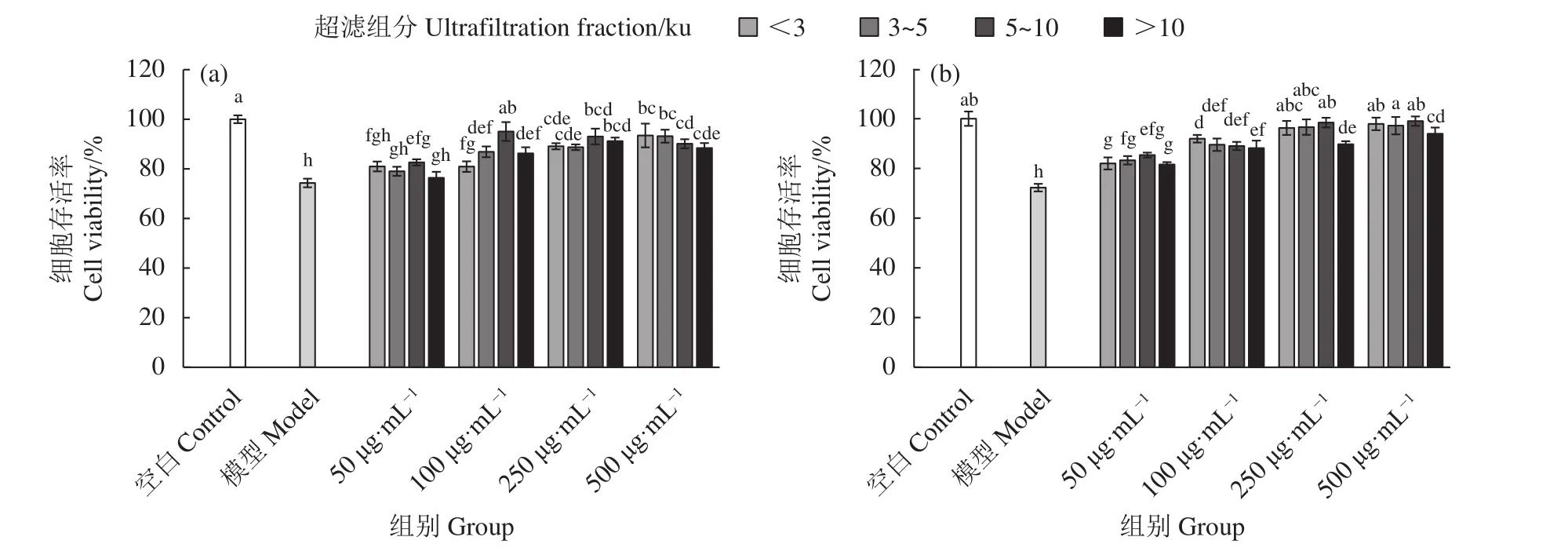
图3 牡蛎超滤组分对雷公藤甲素诱导TM4细胞毒性的保护作用 (预处理时间:a. 6 h;b. 12 h)Figure 3 Protective effect of oyster ultrafiltration fractions on TP-induced TM4 cytotoxicity (Pretreatment time: a. 6 h; b. 12 h)
研究表明Zn具有保护睾丸组织毒性损伤的作用,可抑制镉、乙醇等生殖毒性物质对生殖细胞的影响[35-36]。本研究中牡蛎酶解超滤组分中富含Zn,且<3、3~5和5~10 ku超滤组分的Zn含量高于>10 ku超滤组分,结合细胞存活率实验结果,推测牡蛎酶解超滤组分在改善TP诱导的TM4细胞凋亡过程中Zn可能起到了一定的协同作用。
2.6 牡蛎酶解超滤组分对TP诱导TM4细胞氧化应激损伤的生化检测
GSH作为一种低分子清除剂,可有效减少机体的氧化损伤,是衡量机体抗氧化能力的重要指标。TP显著降低TM4细胞内GSH含量,且具有剂量依赖性 (P<0.05,图4-a),说明TP作用于TM4细胞会降低其细胞内抗氧化能力。
各牡蛎酶解超滤组分对TM4细胞的保护效果见图5。与TP模型组相比,不同质量浓度 (50、100、250 μg·mL−1) 的<3 ku 超滤组分均可显著提高TM4细胞内GSH含量,显著抑制TP对TM4细胞的氧化损伤且呈现剂量依赖性 (P<0.05);此外,<3 ku 超滤组分 250 μg·mL−1剂量组的 GSH 含量均显著高于其他超滤组分的各个剂量组 (P<0.05)。
自由基作用于脂质发生过氧化反应,生成的终产物则为MDA,其水平反映了机体脂质过氧化的强度和速率,间接反映了组织过氧化损伤程度,还可影响细胞线粒体呼吸链复合物及线粒体内关键酶活性,同时加剧细胞膜损伤,具有细胞毒性。与空白对照组相比,TP可显著诱导TM4细胞中MDA含量的升高,且呈现剂量依赖性 (P<0.05,图4-b),说明TP作用于TM4细胞会显著增加细胞的脂质过氧化程度。
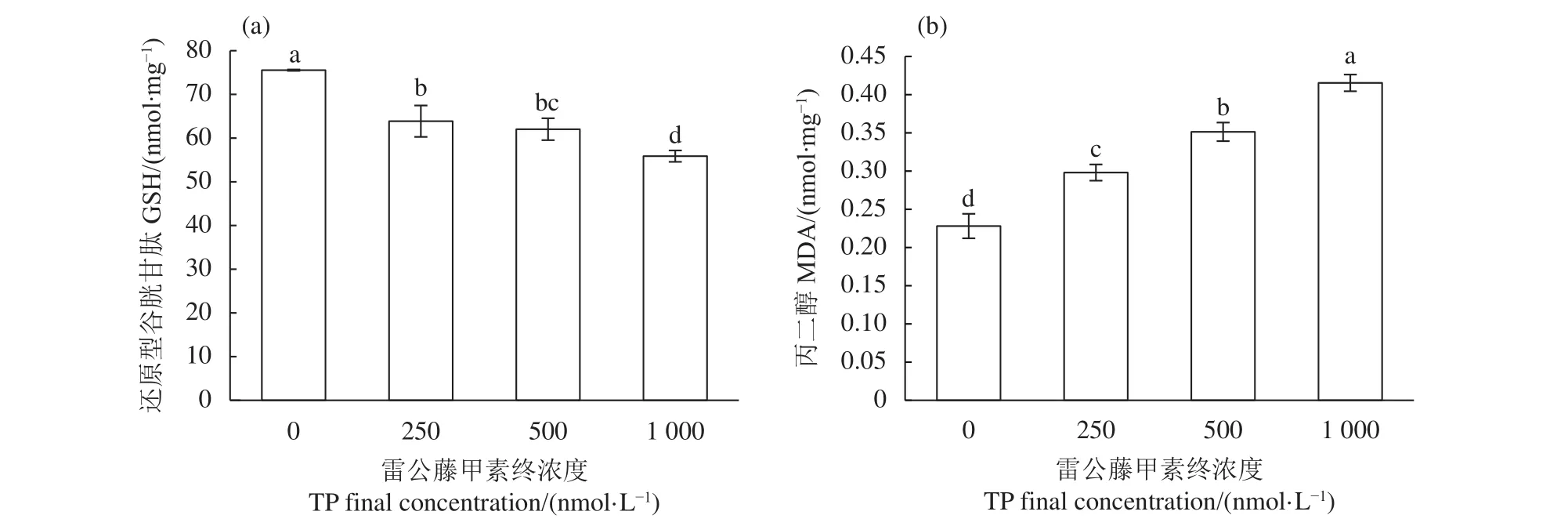
图4 雷公藤甲素对TM4细胞内还原型谷胱甘肽和丙二醇含量的影响Figure 4 Effect of TP on GSH and MDA content in TM4 cells
与TP模型组相比,不同质量浓度的各牡蛎超滤组分均不同程度地抑制TP对TM4细胞的脂质过氧化损伤 (图 5-b)。其中,<3 ku 和 5~10 ku 超滤组分在 100 μg·mL−1作用浓度下,抑制细胞内脂质过氧化效果最显著 (P<0.05),且与空白对照组无显著性差异,而在 50和 250 μg·mL−1质量浓度下,<3 ku超滤组分抑制效果优于 5~10 ku (P<0.05)。
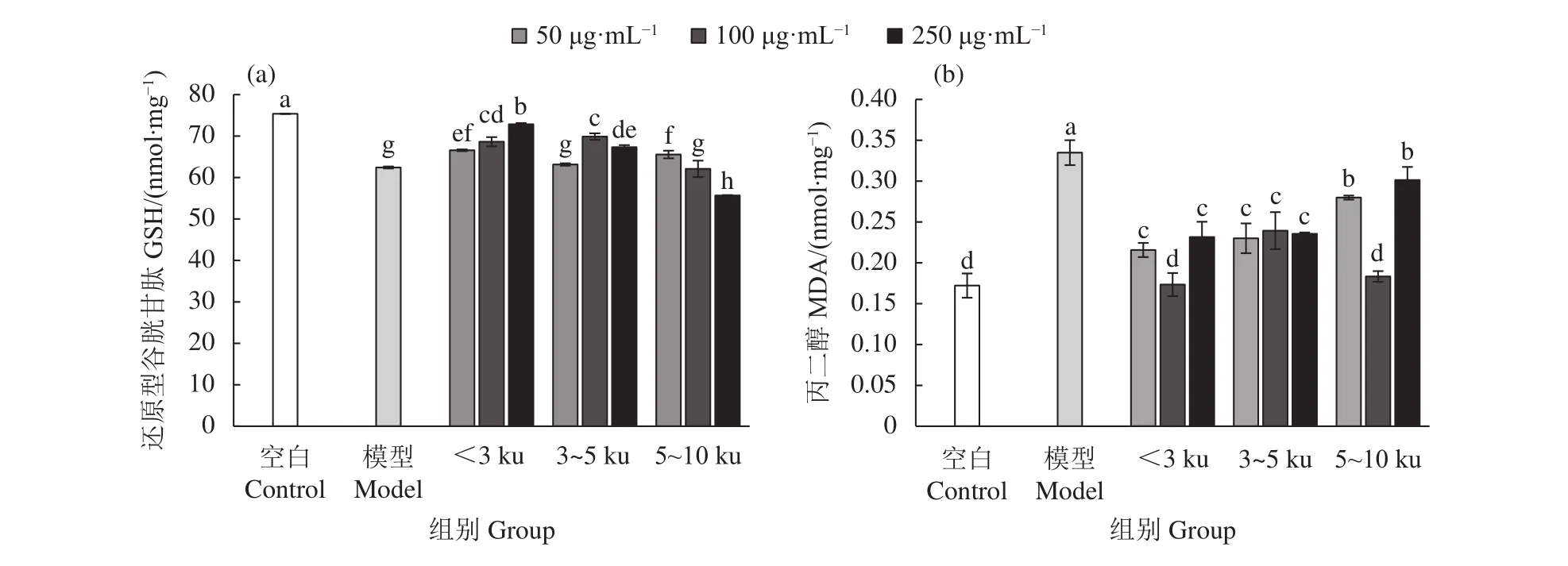
图5 牡蛎超滤组分对雷公藤甲素诱导TM4细胞内还原型谷胱甘肽和丙二醇含量的影响Figure 5 Effect of oyster ultrafiltration fractions on GSH and MDA content in TM4 cells induced by TP
综上,<3 ku超滤组分在各超滤组分中对TM4细胞抗氧化损伤的活性最强。刘姝等[37]和林海生[38]研究也表明,牡蛎酶解液中抗氧化活性物质主要集中于<3 ku的小分子活性肽,而相关研究也表明TP主要通过诱导TM4细胞氧化应激导致细胞凋亡[29],因此<3 ku超滤组分中对TP起主要拮抗作用的可能是具有抗氧化活性的小分子活性肽。
2.7 牡蛎酶解超滤组分对TP诱导TM4细胞内活性氧水平的影响
活性氧 (Reactive oxygen species, ROS) 是指化学性质活泼的具有含氧基团的化合物。有研究表明,TP对睾丸支持细胞的毒性作用机制与ROS的过量产生和抗氧化防御系统的失活有关[30]。ROS的过度积累或持续存在会导致线粒体功能障碍,释放细胞色素C进入细胞质,从而导致细胞凋亡。TP可通过增加氧化应激水平产生毒性作用。活性氧水平与细胞分化以及精子发生的生理过程密切相关,而活性氧水平的异常升高会导致生精细胞凋亡,影响正常的生精过程[39]。根据细胞内GSH和MDA含量测定结果,对<3 ku超滤组分提前预处理 TM4细胞 6 h 后,TP (500 nmol·L−1) 作用 TM4细胞造模3 h,如DCFH-DA检测所证实,在TP暴露下细胞内ROS水平显著增加,但经<3 ku超滤组分预处理的各个剂量组,与TP模型组相比,可显著抑制TP诱导的ROS积累 (图6和图7)。本实验结果表明,<3 ku超滤组分可抑制过量ROS的生成,为其减少睾丸组织的氧化损伤提供实验依据。

图6 DCFH-DA探针法检测TM4睾丸支持细胞内活性氧 (200×)Figure 6 Intracellular ROS in TM4 Sertoli cells indicated as green fluorescence by DCFH-DA

图7 <3 ku牡蛎超滤组分对雷公藤甲素诱导TM4细胞内活性氧水平的影响与模型组相比,*. 显著差异 (P<0.05);**. 极显著差异 (P<0.01);与空白对照组相比,#. 显著差异 (P<0.05);##. 极显著差异 (P<0.01)。Figure 7 Effect of <3 ku ultrafiltration fractions from oyster on TP-induced reactive oxygen species in TM4 cellsCompared with the model group, *. Significant difference (P<0.05);**. Very significant difference (P<0.01). Compared with the control group, #. Significant difference (P<0.05);##. Very significant difference (P<0.01).
3 结论
本研究通过TP损伤TM4细胞构建生殖细胞损伤模型,探究了牡蛎酶解超滤组分对TP诱导的氧化损伤的保护作用。结果表明,<3 ku超滤组分可有效抵抗TP对TM4小鼠睾丸支持细胞的毒性损伤,提高细胞存活率,减少细胞内ROS的产生和脂质过氧化,增强TM4细胞的抗氧化能力。本研究也提示小分子量的牡蛎酶解产物可用于抗生殖毒性损伤的保健食品利用和开发。在此基础上,还有待通过动物模型来验证<3 ku超滤组分对TP诱导的生殖损伤的保护作用及相关机制。
