投喂乙醇假丝酵母对罗非鱼生长、免疫和肠道菌群的影响
2021-10-23廖庆钊陈福艳黄婵婵黄罗冬申佩弘
廖庆钊,陈福艳,覃 雅,黄婵婵,黄罗冬,申佩弘
(1. 广西大学,广西 南宁 530005; 2. 广西水产科学研究院,广西 南宁 530021)
罗非鱼属于杂食性鱼类,具有易养殖、生长快的特点,是世界上第二大经济养殖型鱼类[1-2]。在罗非鱼集约化养殖中病害是目前制约其产业发展的首要因素。中国南方罗非鱼养殖场经常爆发由链球菌引发的鱼病。罗非鱼对无乳链球菌 (Streptococcus agalactiae) 极为敏感,感染后死亡率高,造成的经济损失巨大[3]。一直以来,养殖户主要通过抗生素和其他化学药物进行鱼病防控。滥用抗生素会引发耐药致病菌增多、抗性基因传播和生态失衡等问题[4-5]。为解决罗非鱼细菌病害问题,缓解对抗生素的依赖,亟需寻找防控病害的新资源。
利用环境友好型微生物作为饲料添加剂来提高鱼类抗病能力,是当下生态可持续养殖的新探索[6]。研究表明,发酵食品中的微生物 (酵母类和乳酸杆菌类) 对鱼类有显著的益生作用[5,7-9]。关于乙醇假丝酵母 (Candida ethanolica) 的研究报道主要集中于食品发酵方面,如可可豆发酵中乙醇假丝酵母通过产生一些有机酸以及蛋白质而表现出较强的抗真菌能力[10];在酿造山西老陈醋的过程中添加乙醇假丝酵母可以起到提香作用[11];在制作芒果汁工艺中利用乙醇假丝酵母混合菌液可以改善其风味[12]。在动物饲养方面,Fernandes等[13]对牛瘤胃的酵母群落结构分析指出乙醇假丝酵母对牛具有益生潜能;Inoue等[14]用乙醇假丝酵母发酵鱼粉饲喂小鼠,发现小鼠的免疫力得到显著增强。因此,乙醇假丝酵母是一种有益生潜能的微生物,具有重要的开发利用价值。
乙醇假丝酵母应用于水产养殖尚未见报道,本文利用实验室前期分离并保存的一株乙醇假丝酵母(Candida ethanolica 菌株 GXU01) 作为饲料添加菌对罗非鱼进行养殖实验,并以罗非鱼的生长性能、消化能力、肠道菌群结构和免疫抗病能力等指标评价乙醇假丝酵母的益生作用,以期为罗非鱼健康养殖寻找更有效的饲用添加菌。
1 材料与方法
1.1 实验用鱼及菌株
尼罗罗非鱼 (Oreochroms niloticus) 样本取自广西水产科学研究院。菌株乙醇假丝酵母保存于广西大学生命科学与技术学院资源与环境微生物实验室。将菌株GXU01在PDA培养基上活化后,接种于糖蜜液体培养基 (质量分数:糖蜜6%,尿素0.1%,硫酸铵0.1%,灭菌降温后加无水乙醇2%)中,37 ℃ 振荡 (200 r·min−1) 培养 48 h,6 000 r·min−1离心收集菌体。使用磷酸盐缓冲液 (PBS) 对菌体冲洗 3遍,将悬浮菌液稀释成 108CFU·mL−1。
1.2 实验设计
选用体质量为 (100±15) g的健康罗非鱼180尾,随机分成2组:对照组 (CK) 为基础饲料中添加 PBS[15-17],实验组 (T5) 为基础饲料中添加GXU01菌体悬浮液,分别设置3个重复,每个重复 30尾,在鱼塘中设置长 2 m×宽 1 m×深 1 m 的网箱饲养。每2周换水1次,确保池塘中的水质达到鱼类生长要求,养殖期间平均水温25~32 ℃。
1.3 实验饲料制备与饲喂
实验基础饲料购自广西安桂水产饲料有限公司,饲料大小 2 mm,主要成分 (质量分数) 为 粗蛋白28%、粗灰分13%、水12%、粗纤维10%、粗脂肪3%、钙2%、总磷1.5%、赖氨酸1.3%、氯化钠1%。在饲喂实验开始时,禁食24 h并称质量,按鱼体质量2%投喂饲料,每天上、下午分别喂食1次。饲喂前30 min在9 g基础日粮中加入1 mL浓度为 108CFU·mL−1的悬浮菌液,充分混匀并晾干后投喂[16]。每2周称质量1次,以调整饲料投喂量,每次投喂30 min后收集剩余饲料,以确定饲料摄入量。分别在喂养30和60 d后,对各组鱼的生长性能、血清非特异性免疫参数和肠道菌群结构进行分析。
1.4 生长性能测定与样品采集
参照Tan等[17]的研究用增质量 (WG)、饲料系数 (FCR)、饲料效率 (FE) 和成活率评价生长性能。饲养30和60 d后,从每个重复随机取3尾鱼。麻醉后采集血样,将血清于−20 ℃保存,用于测定血清非特异性免疫力。用500 mg·L−1麻醉剂 (MS-222) 对鱼实施安乐死,冰面解剖,每尾鱼取肝脏1 g,用于测定抗氧化能力。取全肠道样品,称取500 mg添加9.5 mL预冷PBS缓冲液进行匀浆处理,4 ℃、12 000 r·min−1离心 15 min,将上清液转移至干净的10 mL样品管中用于蛋白酶、淀粉酶、纤维素酶和木聚糖酶活性测定;剩余的肠道样品用于微生物群落结构分析。用Bradford法测定总蛋白[18]。肝脏和消化道样品均用液氮速冻,−80 ℃ 保存。
1.5 消化酶活性的测定
蛋白酶测定参照Tan等[17]的方法,木聚糖酶活性测定参照Saputra等[15]的方法,纤维素酶活性测定参照Ullah等[16]的方法,以上均用超微量微孔板分光光度计 (BioTek Instruments, Inc.) 测定。淀粉酶活性采用淀粉酶 (AMS) 测试盒 (购自南京建成生物工程研究所) 测定。
1.6 血清非特异性免疫参数测定
血清超氧化物歧化酶 (SOD) 和溶菌酶 (LZM)活性用试剂盒 (南京建成) 测定。补体C3和C4用相应的鱼补体蛋白 (C3和C4) ELISA试剂盒测定,其原理应用双抗体夹心法测定补体蛋白水平,在含纯化的补体蛋白 (C3或C4) 抗体微孔板中,加入补体蛋白,再与HRP标记的补体蛋白 (C3或C4) 抗体结合形成抗体-抗原-酶标抗体复合物,经过彻底清洗后用TMB显色,通过显色的深浅测定补体蛋白的水平。
1.7 肝脏抗氧化能力的测定
肝脏总抗氧化能力 (T-AOC) 和丙二醛 (MDA)测定严格按照相应的试剂盒 (南京建成) 说明进行。
1.8 肠道微生物群落结构测定分析
在实验第4和第8周采集消化道样本分析微生物多样性。用 FastDNA Spin kit for Soil (MP Biomedicals) 试剂盒提取消化道样本中的DNA,所有实验流程都严格按照制造商的说明操作。利用以下引物从获得的DNA中扩增出16S rDNA基因的可变V3—V4区:5'-ACTCCTACGGGAGGCAGCA-3'和 5'-GGACTACHVGGGTWTCTAAT-3'。随后使用高通量测序 (HTS) 技术对PCR产物进行测序。对原始测序序列进行过滤、双端拼接,得到优化序列 (Tags);将优化序列进行聚类,划分操作分类单元 (Operational taxonomic units, OTU),并根据OTU的序列组成得到其物种分类,基于OTU分析结果,对样品进行分类学分析,研究样品中的微生物群落结构。
1.9 攻毒试验
无乳链球菌用TSB培养基于37 ℃培养24 h,3 000 r·min−1、4 ℃ 离心 10 min 收集菌体细胞,并用PBS冲洗3次。在攻毒试验之前,用PBS将收集的无乳链球菌稀释成浓度梯度 (105、106、107、108和 109CFU·mL−1),每个浓度取0.1 mL 对 10尾200 g左右的罗非鱼进行肌肉注射,确定7 d 50% 致死量 (LD50) 为 108CFU·mL−1。饲喂实验结束后,每组随机选10尾鱼置于1 m3的水桶中养殖,并注射 0.1 mL浓度为 108CFU·mL−1的无乳链球菌,以注射PBS缓冲液的CK组作为阴性对照组。每24 h记录死亡情况,统计7 d死亡率。
1.10 数据分析
数据采用SPSS 25.0软件进行t检验分析,P<0.05视为具有统计学显著性。计算结果以“平均值±标准差 ()”表示。
2 结果
2.1 饲喂GXU01对罗非鱼生长性能和消化酶活性的影响
饲喂GXU01后,罗非鱼的生长特性 (表1) 和消化性能 (图1) 测定结果显示,与CK组比,T5组的饲料转化率及消化酶 (蛋白酶、淀粉酶和木聚糖酶) 活性均显著提高,说明酵母饲料可以改善罗非鱼的生长和消化。
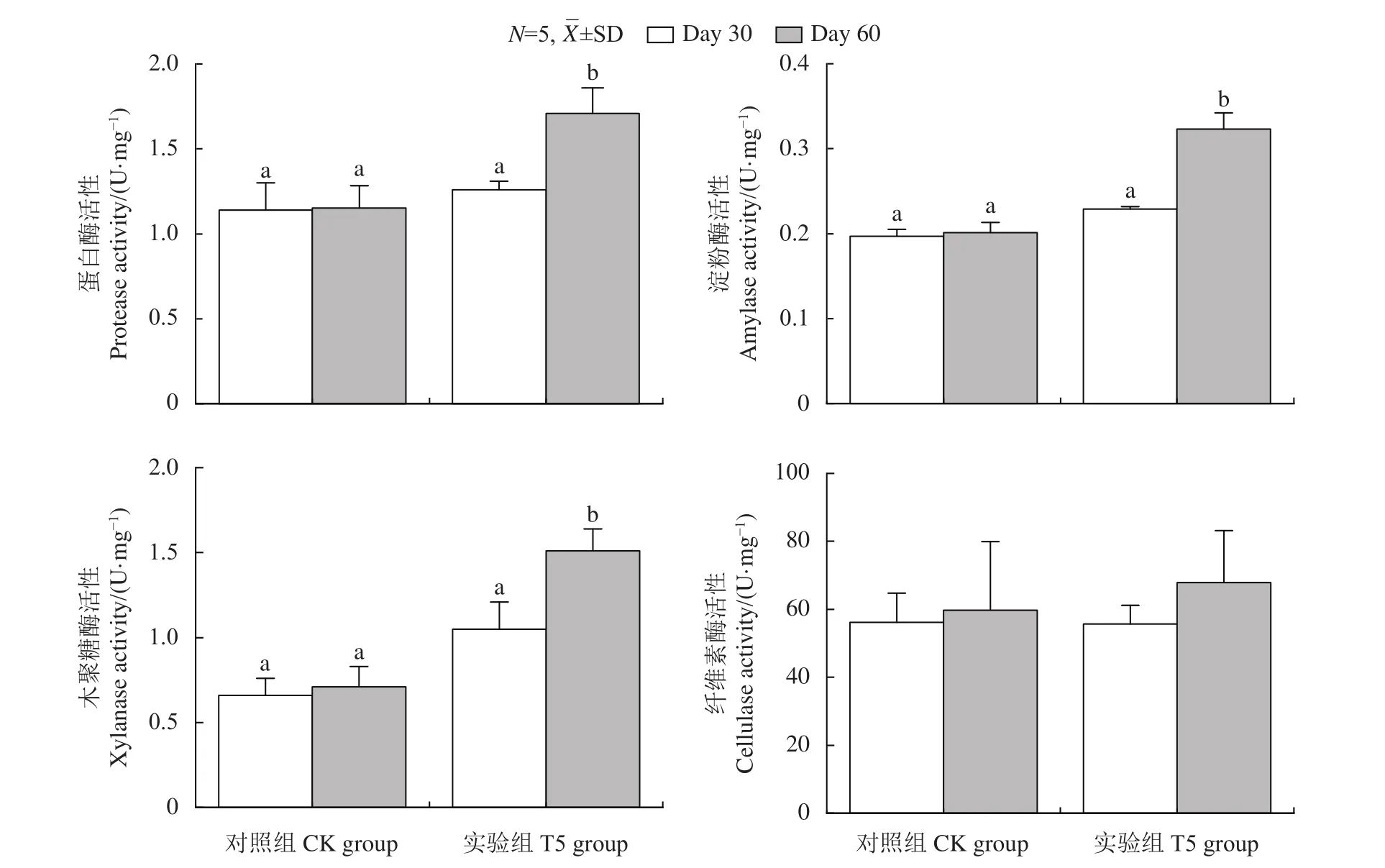
图1 GXU01对罗非鱼肠道蛋白酶、淀粉酶、木聚糖酶和纤维素酶活性的影响CK和T5分别为对照组和GXU01实验组;Day 30、Day 60分别表示饲养30和60 d取样;柱上不同字母表示差异性显著 (P<0.05);图2同此。Figure 1 Effects of GXU01 on activity of gut proteinase, amylase, xylanase and cellulase in tilapiasCK and T5 indicate control and GXU01 treated group, respectively; samples were marked as Day 30 on 30th day and Day 60 on 60th day of feeding; different letters on the bar indicate significant difference (P<0.05). The same case in Figure 2.
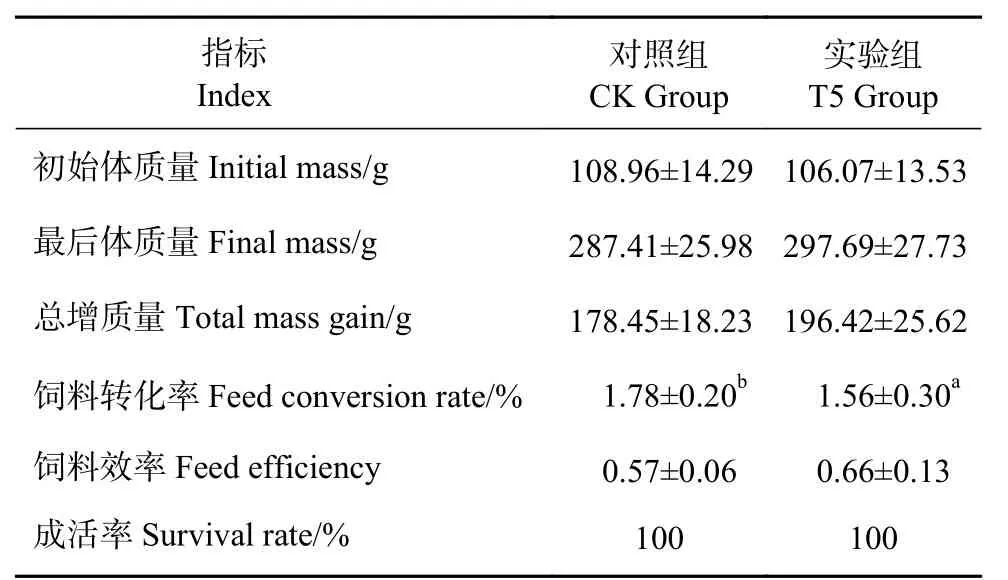
表1 GXU01饲料对罗非鱼生长性能的影响Table 1 Effects of GXU01 feed on growth performance of tilapia
2.2 饲喂GXU01对罗非鱼血清非特异性免疫力的影响
血清溶菌酶和补体蛋白是常用于评价鱼类非特异性免疫的指标。与CK组相比,T5组2个月后罗非鱼血清LZM活性和C3含量显著提高 (图2),说明GXU01具有显著增强罗非鱼非特异性免疫力的作用。
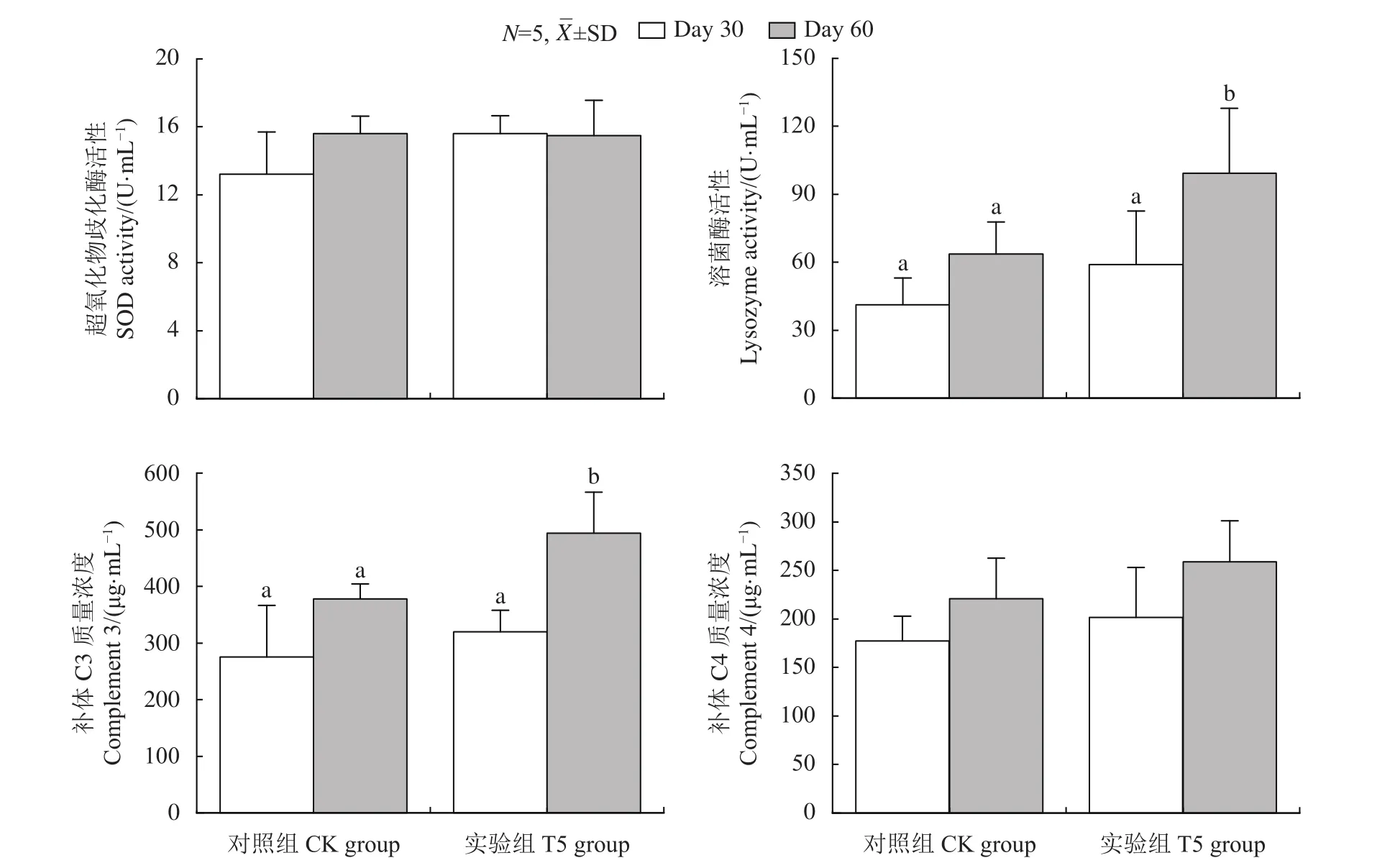
图2 GXU01对罗非鱼血清超氧化物歧化酶活性、溶菌酶活性、补体C3和补体C4质量浓度的影响Figure 2 Effects of GXU01 on serum SOD activity, lysozyme activity, mass concentrations of Complement 3 and Complement 4 in tilapia
2.3 肠道微生物群落结构
相应的菌落结构在门和属水平的丰度百分比见图3。与CK组相比,T5组中梭杆菌门大幅增加,而蓝细菌门大幅减少。在属水平上,T5组中鲸杆菌属 (Cetobacterium) 大幅增加,其次是Phreatobacter和艾克曼菌属 (Akkermansia);出现大幅减少的是Trachydiscus minutus、Uncultured_bacterium和Tetradesmus obliquus。表示饲喂GXU01对罗非鱼肠道菌群结构的影响较显著。
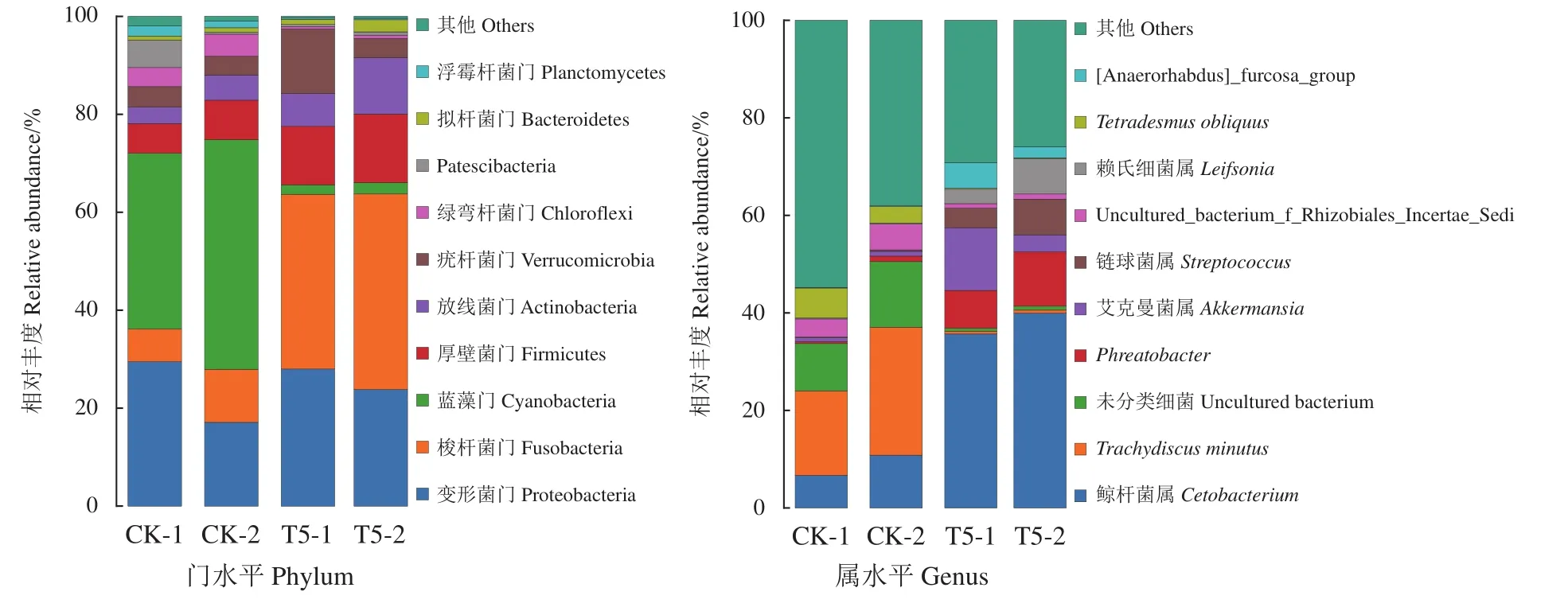
图3 基于16S rDNA基因序列的罗非鱼肠道在门水平和属水平菌群结构及相对丰度图CK和T5分别代表对照组和GXU01的实验组;投喂30 d取样标为CK-1、T5-1,投喂60 d取样标为CK-2、T5-2;表2、图4同此。Figure 3 Structure and relative abundance of intestinal flora at phylum and genus of tilapia based on 16s rDNA sequenceCK and T5 indicate control and GXU01 treated group, respectively; samples were marked as CK-1,T5-1 at 30th day and CK-2, T5-2 at 60th day of feeding. The same case in Table 2 and Figure 4.
2.4 肠道菌群多样性分析
各样品高通量测序获得的OTUs数量介于557~628,对这些序列以OTUs≥97%划分进行聚类,并对各组样品进行Alpha多样性指数评估,选用指标分别为Chao1、Simpson和Shannon(表2)。相对于CK组,T5组中的Simpson指数变大,Shannon指数偏小,表明T5组的菌落多样性降低。
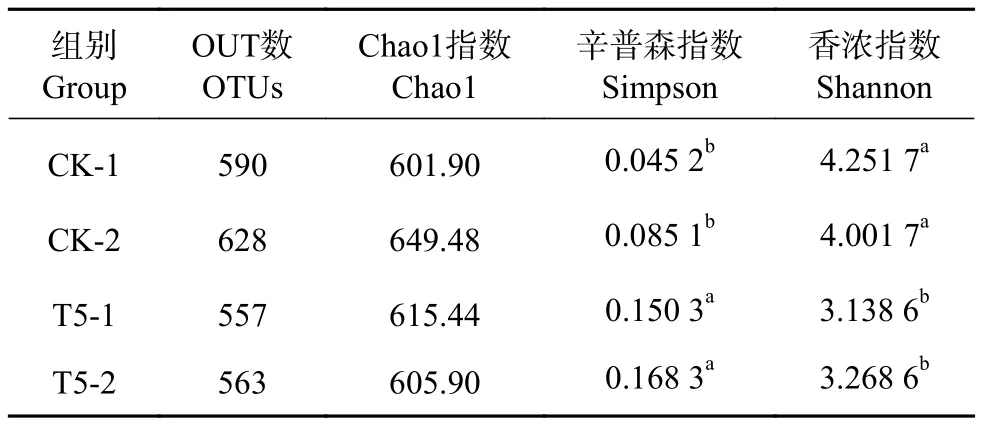
表2 Alpha多样性指数分析Table 2 Analysis of Alpha diversity index
肠道菌群相似程度用物种丰度聚类热图 (图4)展示,相对于CK组,T5组出现了较大的差异。在PCoA分析图 (图5) 中可以看出,T5组前后两次取样 (T5-1和T5-2) 肠道菌群最相近,说明饲喂GXU01更有利于维持罗非鱼肠道菌群稳定。

图4 基于属水平上的物种丰度聚类热图Figure 4 Clustering heat map based on species abundance at genus level
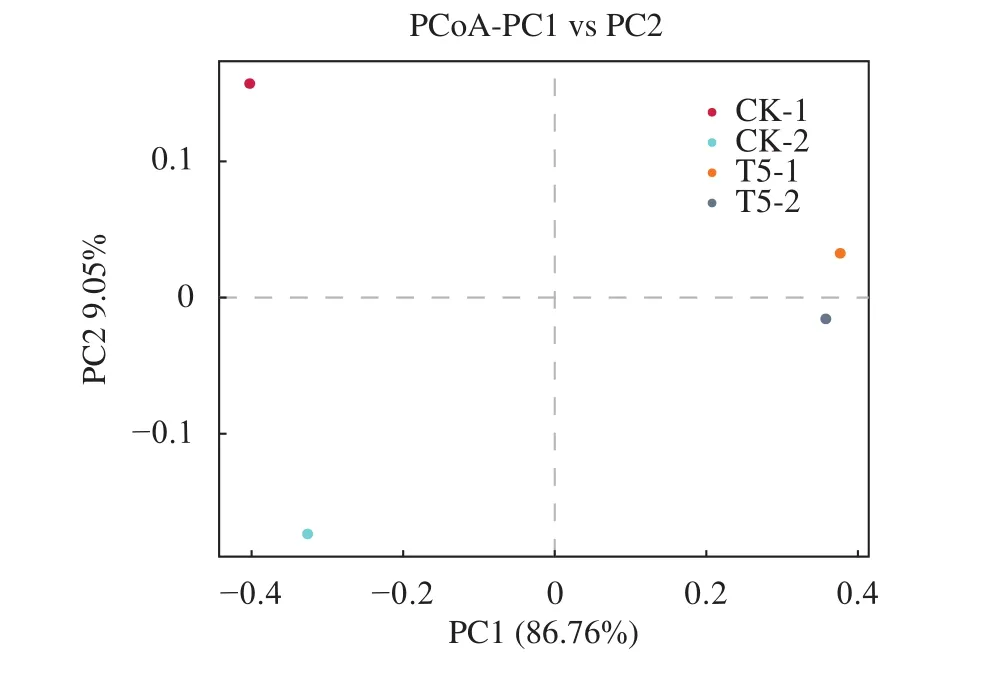
图5 基于binary_chisq距离算法的属水平PCoA分析图Figure 5 Genus level PCoA analysis diagram based on binary_chisq distance algorithm
2.5 饲喂酵母饲料对罗非鱼抗病能力的影响
细菌半致死攻毒试验是评价抗病力最直观的指标[19]。8周喂养实验后,通过统计罗非鱼在无乳链球菌攻毒后7 d累计存活情况,评价了饲喂微生物后罗非鱼的抗病效果。阴性对照组在注射PBS缓冲液后7 d内无死亡发生,而注射无乳链球菌的对照组累计成活率在感染后的前5 d明显下降,然后维持在 (40±10)%。GXU01组成活率为 (66.66±5.77)%,显著高于对照组 (图6)。说明GXU01可以显著增强罗非鱼抗无乳链球菌的能力。
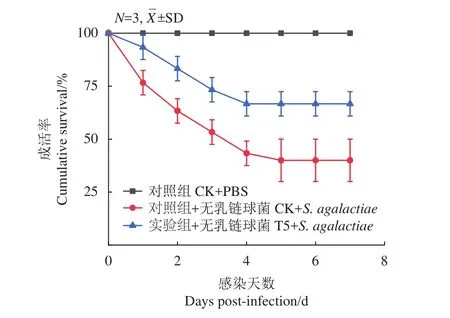
图6 用无乳链球菌进行攻毒试验后7 d成活率Figure 6 Survival rate of 7 d after challenge test with S. agalactiae
3 讨论
益生菌酵母可以作为水产养殖物种有效的生长促进剂,这已被多个研究证实[20-21]。酿酒酵母(Saccharomyces cerevisiae) 和富硒酵母均对罗非鱼的饲料利用率和生长性能有显著的促进作用[22-23]。本实验中,酵母饲料同样表现出促生长性能。酵母的促生长作用可能部分归因于酵母本身,因其富含蛋白质、碳水化合物、核酸和维生素等营养物质,可以作为动物的营养增强剂[24]。如补充全细胞酵母、n-3 HUFA 富集酵母以及β-巯基乙醇处理的酵母能改善营养物质的消化,促进虹鳟 (Oncorhynchus mykiss) 的生长[25];酵母细胞壁也可以显著促进罗非鱼生长[26-27 ]。另一种解释是可能由于消化酶活性增加,肠道的消化能力与生长性能呈正相关。本实验中添加酵母使罗非鱼消化酶活性增加;饲料中添加酵母益生菌可增强舌齿鲈 (Dicentrarchus labrax) 的消化酶活性[28-29],从而提高其生长性能;Ullah等[16]的研究也证实饲喂酵母可提高罗非鱼肠道蛋白酶、木聚糖酶和纤维素酶的活性,进而改善其生长性能。
罗非鱼血清参数与攻毒试验结果均显示,饲喂GXU01能显著增强罗非鱼的免疫抗病能力。在相似的研究中,Brattgjerd等[30]用来源于酵母细胞壁的葡萄糖注射大西洋鲑 (Salmo salar),发现大西洋鲑血清LZM活力显著提升。Yuan等[31]用3%酵母水解物替代鱼粉饲喂建鲤 (Cyprinus carpio var.Jian),使其血清溶菌酶活性、补体C3和C4水平显著增加,免疫抗病能力也随之增强。然而,酵母类物质对促进机体免疫的机理还有待进一步探究。
肠道微生物能够通过肠-脑神经影响生物体的消化吸收、生长代谢和免疫调节等机能[32]。饮食可以在很大程度上影响肠道菌群结构。研究指出对罗非鱼饲喂添加菌可有效调节肠道微生物群落结构,改善其生长、消化和免疫调节能力[33-35]。关于罗非鱼肠道微生物的报道中,有研究表明梭杆菌门、变形菌门、厚壁菌门和放线菌门是罗非鱼肠道优势菌群[36]。Tan等[17]发现梭杆菌门是罗非鱼肠道微生物的主要组成。本实验中摄食GXU01的罗非鱼肠道菌群中梭杆菌门为优势菌群,而蓝藻门的丰度大幅降低,可能原因是GXU01会抑制蓝藻类微生物的生长。投喂GXU01的罗非鱼中艾克曼菌属比例显著高于其他组,表明GXU01能促进梭杆菌门和艾克曼菌属的生长。Zhang等[37]研究发现艾克曼菌属是一种有益生潜能的肠道微生物,其增强宿主代谢和免疫力的效果显著。然而,罗非鱼及其肠道微生物作为一个互利共生的整体,酵母饲料是如何影响其整体机制的还需进一步探究。
4 结论
本研究结果显示,投喂GXU01的罗非鱼血清溶菌酶活性和补体C3含量显著增加 (P<0.05),肠道菌落结构发生了显著变化,表现为蓝藻门大幅减少,梭杆菌门显著增多;在属水平上,鲸杆菌属和艾克曼菌属两个有益菌群的丰度显著上调 (P<0.05)。结果表明,GXU01能显著增强罗非鱼肠道消化酶活性,改善罗非鱼的生长性能,提高其抗病能力,酵母饲料在罗非鱼养殖中具有较好的益生功效。
