CAD在乳腺纤维腺瘤钼靶X线诊断中的应用
2021-10-22林盼盼黄恺吴仁华
林盼盼 黄恺 吴仁华
摘要:目的:探讨计算机辅助检测(CAD)在乳腺纤维腺瘤钼靶X线诊断中的应用价值。方法:收集本院109例乳腺纤维腺瘤患者的钼靶图像,使用CAD系统标识感兴趣区域(ROIs)并观察系统勾画的病灶位置及形状,探讨CAD在乳腺纤维腺瘤诊断中的应用价值。结果:在109例乳腺纤维腺瘤患者钼靶图像中,CAD系统对脂肪型乳腺的识别率最高,达到100%,对致密型、多量腺体型和少量腺体型乳腺的识别率分别为5.88%、5.41%和4.55%。结论:CAD能够识别高于其周围腺体组织密度的乳腺纤维腺瘤,本结论对于数字图像处理的优化研究有一定参考价值。
关键词:乳腺纤维腺瘤;钼靶;计算机辅助检测
中图分类号:R445.4;R814文献标识码:BDOI:10?郾3969/j.issn.1001-0270.2021.05.03
The Value of CAD in the Mammography Diagnosis for Breast Fibroadenoma
LIN Pan-pan1, 2, HUANG Kai3, WU Ren-hua3
(1. School of Clinical Medicine, Quanzhou Medical College, Fujian 362000,China; 2. Department of Imaging, Peoples Hospital of Quanzhou Medical College, Fujian 362000, China; 3. Department of Radiology, Second Affiliated Hospital, Shantou University School of Medicine, Guangdong 515041, China)
Abstract: Objective: To investigate the value of computer-aided detection (CAD) in the diagnosis of mammography for breast fibroadenoma. Methods: We collected 109 breast fibroadenoma patients mammogram images,identifiedthe regions of interest(ROIs) by using CAD software, and observed the breast lumpslocation and shape. Results: Among the mammograms of 109 breast fibroadenoma patients, the CAD software has the 100% recognition rate for fatty breasts, and 5.88%, 5.41% and 4.55% for dense breasts, multiple glandular breastsand small amounts of glandular breasts, respectively. Conclusions: CAD could identify breast fibroadenoma with higher density than its surrounding glandular tissue, and the conclusion providescertain reference values for the optimization of image processing software.
Key Words: breast fibroadenoma; mammography; computer-aided detection
乳腺肿瘤属于妇科高发病,严重影响着全球女性的身心健康。乳腺纤维腺瘤是由纤维组织、腺上皮混合形成的良性肿瘤[1],若未能对其早期诊断和及时治疗,可能导致病灶区域梗死、硬化性乳腺病甚至乳腺癌。因此,乳腺纤维腺瘤的早期诊疗有极大的临床意义。Mittra等(2012)[2]指出,每2年对妇女的乳腺进行1次常规检查有助于降低其乳腺疾病的发病率和死亡率。钼靶X线摄影作为乳腺肿瘤首选的影像学检查技术,其诊断结果受多种因素影响,比如微小病灶不易发现、多发病灶引起重叠、病理表现复杂多变、阅片医师经验不足和诊断医师视觉疲劳等[3]。
计算机辅助检测(CAD)系统于1966年由Ledley首次提出[4],该系统能对医学图像的感兴趣区(ROIs)进行识别,已广泛应用于医学图像处理,如病灶识别以及协助医师诊断以提高病灶检出率。目前,CAD已在肺部电子计算机断层扫描(CT)[5-6],乳腺、前列腺、甲状腺和肝脏磁共振成像(MRI)[7-8],乳腺和甲状腺超声(US)[9]以及结肠镜等[10]检查中取得相关的研究成果。与此同时,Chen等(2018)[11]开发并测试了一个CAD系统,将深度学习网络结合CAD(DNN-CAD)对结肠直肠息肉进行精确分类。由此可见,CAD系统具有巨大的临床应用潜力。临床和科研工作中,评估CAD系统性能的指标包括准确率、特异性、敏感性、阳性预测值和阴性预测值等[12-14]。本研究着重分析CAD对乳腺纤维腺瘤的标识率及其与人工勾画结果的相似度,为CAD在乳腺肿瘤诊断中的应用提供参考。
1 资料与方法
1.1 一般资料
选取2018年6月至2021年1月于泉州医学高等专科学校附属人民医院影像科行钼靶X线检查,并经影像科医师诊断为乳腺纤维腺瘤的患者109例,所有受检者均为女性,年龄范围21岁至69岁,平均年龄(40.66±19.32)岁。其中,年龄低于35岁的受检者47名,占比43.12%,高于(含等于)35歲的受检者62名,占比56.88%。所有纳入研究的病例均采用美国国家癌肿研究所制定的乳腺影像报告与数据系统(BI-RADS)标准进行分级。
纳入标准:①经2名具有15年以上钼靶摄影资质和诊断经验的影像科副主任医师诊断,均为乳腺纤维腺瘤;②钼靶X线影像学资料完整、清晰;③所纳入病例具有可靠的检查前触诊记录,且记录完整、清楚;④所纳入病例均有完整的临床病历数据,包括年龄、性别和既往病史。
排除标准:①对头尾位(CC位)、双侧斜位(MLO位)显示效果不佳者;②肿瘤体积过大,ROIs未能勾画的肿块;③受检者既往存在乳房假体隆乳术等可能影响研究结果的情况;④检查过程不配合或中途退出者。
1.2 仪器和方法
1.2.1 仪器
本研究采用的仪器为意大利艾蒙斯公司GIOTTO IMAGE 3D高频乳腺钼靶机,检查前设置诊断参数。所有研究对象均通过钼靶X线机摄影,常规行乳腺CC位和MLO位摄片,并在摄片前保留完整详实的触诊记录。CAD的基点设置为1,命令框设置为正中间。
1.2.2 CAD信息采集及分析方法
本研究中CAD的图像采集信息仅包括病灶位置和形状,导入乳腺纤维腺瘤X线影像图片后,CAD自动勾画肿块边界,并生成ROIs。本院2名钼靶诊断医师共同协商并达成一致意见之后,手动勾画病灶区域,并记录乳腺纤维腺瘤在系统中的位置和形状,以便后续比较。
1.3 观察指标
①乳腺纤维腺瘤钼靶X线图像的观察指标:病灶数目(单发、多发),部位(外上象限、内上象限、外下象限、内下象限和中央区),形态(规则、不规则),形状(圆形、类圆形),边缘(光滑、不光滑),密度(均匀、不均匀),大小(如1.9cm×4.5cm)和钙化情况(大片状、簇状、细沙样和蛋壳样等)等;②CAD系统观察指标:以识别率作为其诊断乳腺纤维腺瘤的诊断效能,并观察系统勾画的位置和形状;③影像科的2名钼靶诊断医师对病灶区域进行手工勾画,并将其与系统勾画出的形状进行比较。
1.4 统计学方法
采用SPSS 25.0软件进行数据分析,计量资料表示为均数±标准差(x±s),计数资料表示为百分率(%)。
2 结果
2.1 乳腺钼靶X线诊断结果
2.1.1 乳腺纤维腺瘤钼靶X线图像特征
乳腺纤维腺瘤多呈单发,大多数位于外上象限。乳腺纤维腺瘤的钼靶X线影像表现为呈圆形、类圆形的肿块,边界光滑,部分病例边缘伴透亮晕环。本文纳入研究的109例乳腺纤维腺瘤最小约(0.5cm×0.5cm),最大约(1.9cm×4.5cm),平均大小约为(1.2cm×1.3cm),肿块密度较均匀。
本研究中,乳腺纤维腺瘤的密度与周围正常腺体比较,呈低密度的有54例,呈等密度的有22例,呈(稍)高密度的有33例。部分病例出现钙化,钙化呈片状、轮状或融合为大块状。
2.1.2 乳腺纤维腺瘤发病部位及BI-RADS分级结果统计
纳入本研究的109例乳腺纤维腺瘤中,单发肿瘤79例,其中左侧发病32例,占比29.36%;右侧47例,占比43.12%。双侧发病30例,占比27.52%。BI-RADS分级结果:1级9例,占比8.26%;2级27例,占比24.77%;3级73例,占比66.97%。
2.1.3 乳腺纤维腺瘤检出情况及初步分析
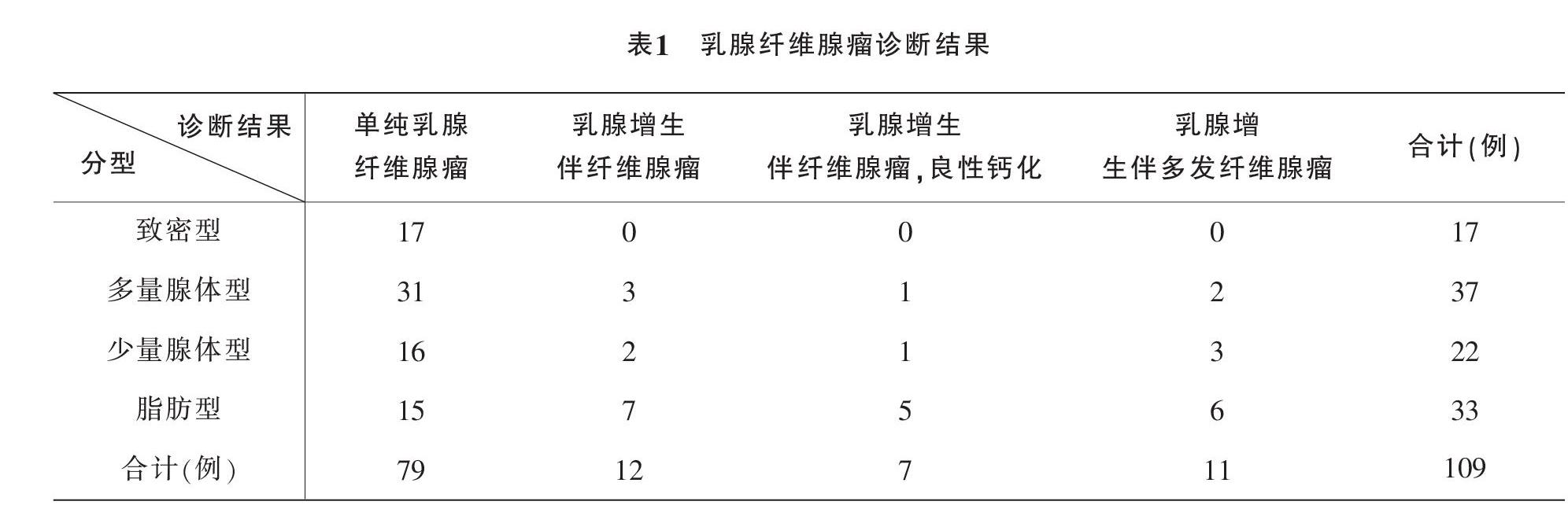
乳腺纤维腺瘤钼靶诊断结果与乳腺分型的例数汇总如表1所示。其中,乳腺增生病例为30例(27.52%),均为双侧发病。
在30例乳腺增生病例中,伴有多发纤维腺瘤的11例。经查阅临床资料可知,11例乳腺增生伴多发纤维腺瘤患者发病的平均年龄为(22.66±11.32)岁。
在30例乳腺增生病例中,伴有钙化的有7例,且钙化灶均为片状、轮状或融合为大块状。经查阅上述7例受检者的临床资料得出,7例乳腺增生伴有良性钙化的纤维腺瘤患者发病的平均年龄为(46.71±9.32)岁,受检年龄均为35岁以上。
2.2 CAD诊断结果
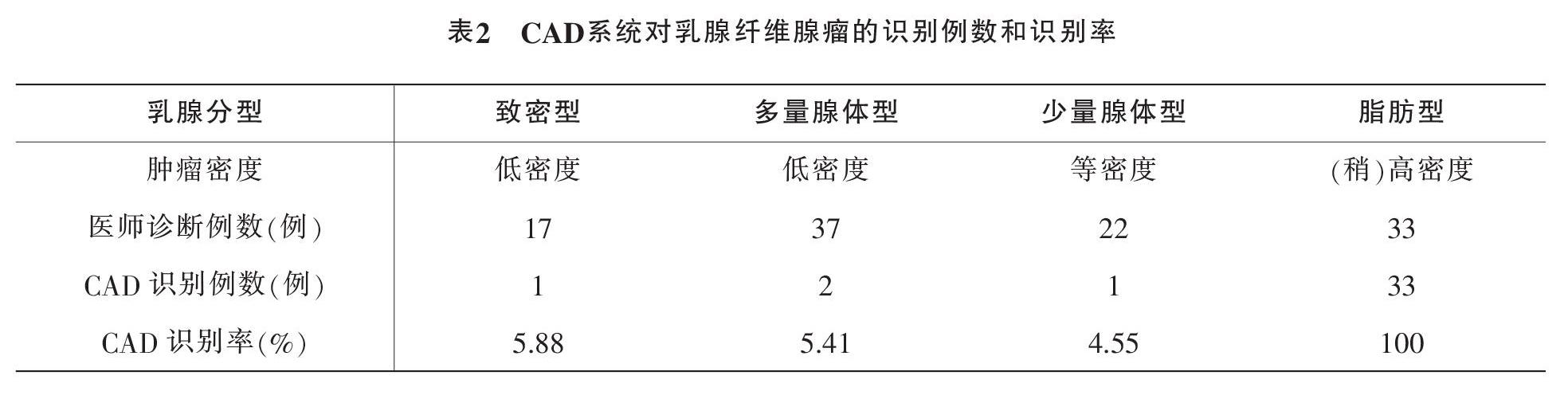
最终纳入本研究的109例乳腺纤维腺瘤样本中,有98例样本的CAD系统勾画区域无法与人工勾画区域较好贴合,占比89.91%,且这些系统勾画区域均偏大;有11例样本的自动勾画区域位于人工勾画范围内,占比仅为10.09%,这表明CAD系统自动勾画的病灶体积较手工勾画体积稍偏大的可能性较大。同时,本研究统计出CAD系统对乳腺纤维腺瘤的识别率,见表2。CAD系统对于脂肪型乳腺的识别率最高,达到100%,对致密型、多量腺体型和少量腺体型乳腺的识别率分别为5.88%、5.41%和4.55%。
3 讨论
乳腺纤维腺瘤是女性最常见的乳腺良性肿瘤,好发于外上象限,与本研究结果一致[15]。乳腺纤维腺瘤多见于青年女性,发病年龄多为14-35岁[16],绝经后的妇女少见。本研究纳入的病例中,年龄范围21-69岁,平均年龄(40.66±19.32)岁,其中,年龄低于35岁的受检者47名,占比仅为43.12%,高于(含等于)35岁的受检者62名,占比56.88%。表明本研究样本中有相当一部分受检者的发病年龄超过35岁,这可能导致本研究和乳腺纤维腺瘤密度有关的研究结果有所偏差[17-19],在今后的研究中,需要纳入更多的样本以减少此类偏差。
钼靶X线摄影具有操作简单、价格低廉的优势,是乳腺肿瘤普查的首选方法。随着受检人员的增加,需要寻找一种能够辅助医师对大规模受检人员筛查的技术手段。计算机算法能力的提升以及影像设备性能的完善,使得CAD系统逐步应用于临床[20-21]。目前CAD系统仍然需要医师对图像进行人工预处理和特征提取,工作量较大,且其辅助检测的准确性不明[22]。本研究通过分析109例乳腺纤维腺瘤的钼靶X线诊断结果,结合受检者的临床资料,探讨CAD系统在乳腺纤维腺瘤识别中的应用。针对本研究结果中CAD对乳腺纤维腺瘤的识别率作如下讨论。本研究结论指出,CAD系统对于脂肪型乳腺的识别率最高,达到100%,然而该系统对致密型乳腺的识别率仅为5.88%,即17例病例中仅识别出1例,且被CAD系统识别出的这1例乳腺纤维腺瘤病灶边缘伴透亮晕环,其余16例乳腺纤維腺瘤病灶边缘均无晕环。由此表明,该系统可能易于识别密度对比强烈的区域,而对于密度低于或者接近于周围组织的病灶无法识别或较难识别。CAD对致密型乳腺识别率较低可能存在以下原因:首先,乳腺纤维腺瘤肿块的大小和形状没有规律,难以使用常规的CAD系统进行自动识别;其次,致密型乳腺的腺体与肿块的密度接近,造成二者的对比度较差,系统辨别难度较大;第三,本研究中的乳腺纤维腺瘤平均大小约为(1.2cm×1.3cm),对于较小的乳腺纤维腺瘤,病灶可能被致密型腺体包裹,导致显示欠缺或者无法显示。因此,如果能在系统的图像预处理阶段,将致密型腺体部分去除或者降低其密度,将有助于提高识别率。进一步的研究结果表明,CAD对多量腺体型乳腺的识别率为5.41%,即在37例多量腺体型乳腺中,系统仅识别出2例病灶,其中1例病患58岁,钼靶征象显示其乳腺纤维腺瘤伴有良性钙化,另1例病患26岁,钼靶征象显示为乳腺增生伴有多发乳腺纤维腺。另外,CAD对少量腺体型乳腺的识别率为4.55%,即在22例少量腺体型乳腺中,系统仅识别出1例病灶,该病患62岁,钼靶征象显示其伴有钙化。由此可见,CAD对于钙化的识别率较高,并且这2例钼靶征象中伴有钙化的患者年龄均超过55岁。随着年龄增加,女性乳腺会逐渐出现生理性的退行性钙化,且形态多样,这些钙化在钼靶X线中的表现与乳腺癌的微钙化不同,多表现为散在分布的粗大钙化[23-24]。这与本研究中出现粗大钙化征象的患者年龄均超过55岁相一致。
乳腺的鉬靶X线图像表现存在个体差异,且同一个体在不同的年龄阶段也存在差异,这种差异和乳腺中脂肪含量、腺体含量以及二者的比例密切相关。女性的乳腺在青春期时期属于致密型乳腺,随着年龄增加,乳腺逐渐由致密型向脂肪型乳腺过渡。有报道指出,钼靶摄影对致密型乳腺的诊断有一定的局限性,而致密型乳腺是乳腺癌的独立危险因素,有必要辅以其他影像学检查手段对其进行早期筛查[25]。目前已有卷积神经网络(CNN)等深度学习模型结合CAD对病灶进行检测、识别、分割和分类诊断的研究[26-27],未来如果能进一步优化CAD系统,辅以人工智能手段,将使影像科医师从高强度的工作中解脱出来,有更多的时间和精力用于临床和科研工作。
参考文献:
[ 1 ] Krings G,Bean G R,Chen Y Y.Fibroepithelial lesions; The WHO spectrum[J].Semin Diagn Patho.,2017,34(5):438-452.
[ 2 ] Mittra I,Mishra G A,Dikshit R P,et al.Effect of screening by clinical breast examination on breast cancer incidence and mortality after 20 years:prospective,cluster randomised controlled trial in Mumbai[J].Bmj,2021,372 n256.
[ 3 ] Lee C S,Moy L,Hughes D,et al.Radiologist Characteristics Associated with Interpretive Performance of Screening Mammography:A National Mammography Database(NMD) Study[J].Radiology,2021,204379.
[ 4 ] Ledley R S.High-speed photomicrographic analysis by digital computer[J].Med Biol Illus,1966,16(2):114-115.
[ 5 ] Zhang S,Sun F,Wang N,et al.Computer-Aided Diagnosis(CAD) of Pulmonary Nodule of Thoracic CT Image Using Transfer Learning[J]. Digit Imaging,2019,32(6):995-1007.
[ 6 ] Li X,Wang X,Yang X,et al.Preliminary study on artificial intelligence diagnosis of pulmonary embolism based on computer in-depth study[J]. Ann Transl Med,2021,9(10):838.
[ 7 ] Collins M J,Hoffmeister J,Worrell S W.Computer-aided detection and diagnosis of breast cancer[J].Semin Ultrasound CT MR,2006,27(4):351-355.
[ 8 ] Alksas A,Shehata M,Saleh G A,et al.A novel computer-aided diagnostic system for accurate detection and grading of liver tumors[J]. Sci Rep,2021,11(1):13148.
[ 9 ] Wu W J,Moon W K.Ultrasound breast tumor image computer-aided diagnosis with texture and morphological features[J].Acad Radiol,2008,15(7):873-880.
[10] Hassan C,Spadaccini M,Iannone A,et al.Performance of artificial intelligence in colonoscopy for adenoma and polyp detection:a systematic review and meta-analysis[J].Gastrointest Endosc,2021,93(1):77-85.
[11] Chen P J,Lin M C,Lai M J,et al.Accurate Classification of Diminutive Colorectal Polyps Using Computer-Aided Analysis[J].Gastroenterology,2018,154(3):568-575.
[12] Fenton J J,Xing G,Elmore J G,et al.Short-term outcomes of screening mammography using computer-aided detection:a population-based study of medicare enrollees[J].Ann Intern Med,2013,158(8):580-587.
[13] Tajbakhsh N,Shin J Y,Gotway M B,et al.Computer-aided detection and visualization of pulmonary embolism using a novel,compact,and discriminative image representation[J].Med Image Anal,2019,58:101541.
[14] Fenton J J,Abraham L,Taplin S H,et al.Effectiveness of computer-aided detection in community mammography practice[J]. J Natl Cancer Inst,2011,103(15):1152-1161.
[15] Somasegar S,Li L,Thompson C L.No association of reproductive risk factors with breast cancer tumor grade[J].Eur J Cancer Prev,2018,27(2):140-143.
[16] Ajmal M,Khan M,Van Fossen K.Breast Fibroadenoma[M]. In StatPearls,StatPearls Publishing Copyright■2021,StatPearls Publishing LLC:Treasure Island(FL),2021.
[17] Conant E F,Barlow W E,Herschorn S D,et al.Association of Digital Breast Tomosynthesis vs Digital Mammography With Cancer Detection and Recall Rates by Age and Breast Density[J]. JAMA Oncol,2019,5(5):635-642.
[18] Hu C Y,Ma W J,Liu J,et al. Correlation between breast density and age,breast cancer molecular subtype[J]. Zhonghua Yi Xue Za Zhi,2019,99(1):49-52.
[19] Holowko N,Eriksson M,Kuja-Halkola R,et al.Heritability of Mammographic Breast Density,Density Change,Microcalcifications,and Masses[J].Cancer Res.,2020,80(7):1590-1600.
[20] Kooi T,Litjens G,Van Ginneken B,et al.Large scale deep learning for computer aided detection of mammographic lesions[J].Med. Image Anal.,2017,35:303-312.
[21] Lehman C D,Wellman R D,Buist D S,et al.Diagnostic Accuracy of Digital Screening Mammography With and Without Computer-Aided Detection[J]. JAMA Intern Med,2015, 175(11):1828:1837.
[22] Fenton J J,Taplin S H,Carney P A,et al.Influence of computer-aided detection on performance of screening mammography[J].New Engl. J. Med.,2007,356(14):1399-1409.
[23] Vanna R,Morasso C,Marcinnò B,et al.Raman Spectroscopy Reveals That Biochemical Composition of Breast Microcalcifications Correlates with Histopathologic Features[J].Cancer Res.,2020,80(8):1762-1772.
[24] Luiten J D,Voogd A C,Luiten E J T,et al.Recall and Outcome of Screen-detected Microcalcifications during 2 Decades of Mammography Screening in the Netherlands National Breast Screening Program[J].Radiology,2020, 294(3):528-537.
[25] Kim S H,Kim H H,Moon W K. Automated Breast Ultrasound Screening for Dense Breasts[J].Korean J. Radiol.,2020,21(1):15-24.
[26] Al-Antari M A,Al-Masni M A,Kim T S. Deep Learning Computer-Aided Diagnosis for Breast Lesion in Digital Mammogram[J].Adv. Exp. Med. Biol.,2020,1213:59-72.
[27] Non. Deep Learning Algorithm Aids Breast Cancer Detection by Mammography[J].Cancer Discov,2021,11(3):9.
